不同发育期小鼠卵巢组织中Wnt5a 蛋白表达水平及其对卵母细胞自噬的影响
马亚博, 原筱潭, 谢贤国, 刘新峰, 徐金瑞, 杨 易
(1. 宁夏大学西部特色生物资源保护与利用教育部重点实验室,宁夏 银川 750021;2. 宁夏大学生命科学学院微生物与分子生物学系,宁夏 银川 750021)
随着研究的不断深入,研究者对Wnt 信号通路的了解也越来越多。迄今为止,在人类基因组中发现了19 个无翼相关/MMTV 整合家族(Wnts) 成员,包 括Wnt1、Wnt2、Wnt2b、Wnt3、Wnt3a、Wnt4、Wnt5a、Wnt5b、Wnt6、Wnt7a、Wnt7b、Wnt8a、 Wnt8b、 Wnt10a、 Wnt10b、 Wnt11、Wnt14、Wnt15 和Wnt16。这些分泌的糖蛋白通常含有350~400 个氨基酸[1],可以通过一个或多个Wnt 信号转导通路发出信号,并且可以以旁分泌或自分泌的方式发出信号,表现出独特的表达模式和发育功能[2]。Wnt 信号通路是一种复杂而基本的发育途径[3],该通路通过与Wnt 靶基因的β-catenin 结合,在胚胎发育、稳态过程、细胞分化、细胞极性、细胞增殖和细胞迁移等方面发挥重要作用[4]。Wnt 信号的失调与各种疾病有关,如癌症、衰老、阿尔茨海默病、代谢性疾病和色素沉着障碍[5]。Wnt5a 是一种非经典的Wnt 配体,其在进化上是保守的,在发育中起着重要作用[6-7]。 虽然经典的Wnt 信号通路在调节卵泡生长和类固醇生成中的作用[8]已经被证实,但非经典的Wnt 信号通路在卵巢中是否表达,是否对卵巢的发育有调控作用目前尚未可知。
自噬是一种严格调控的细胞内管家机制,可降解长寿命蛋白质和不必要的、无功能的细胞器[9]。微管相关蛋白轻链3B (microtubule-associated protein light chain 3B,LC3B)是LC3 的编码基因,是自噬途径的中心蛋白。在自噬过程中,LC3 的羧基末端被迅速切割以产生细胞质LC3-Ⅰ。LC3-Ⅰ被脂化为LC3-Ⅱ,从而将LC3 与自噬囊泡结合。自噬体中存在LC3 和转化为向下迁移的LC3-Ⅱ,是自噬的标志。因此,细胞内自噬的变化可以通过细胞分布和LC3B 的变化来监测[10]。P62 也是常见的自噬蛋白,在自噬发生时,其通常与底物同时降解。Wnt5a 在小鼠卵巢组织中自噬调控方面的研究尚未见相关报道。因此,本研究通过收集出生前后不同发育时期的小鼠卵巢组织,采用Western blotting 法和免疫荧光实验探讨Wnt5a 在卵巢组织中的表达模式及潜在作用,为非经典Wnt 信号对卵巢组织的调控研究奠定基础。
1 材料与方法
1.1 实验动物、主要试剂和仪器无特定病原体(specific pathogen free,SPF) 级CD-1 (ICR) 小鼠50 只,8 周龄,动物生产许可证号:SCXK(京)2020-0006,由北京维通利华实验动物技术有限公司提供,在宁夏大学实验动物房饲养。DMEM 培养基、胎牛血清和胰蛋白酶(美国Gibco 公司),1%青霉素-链霉素(美国Hyclone 公司),rWnt5a(美国RD 公司),IWP2(美国APEXBIO 公司),BOX5(美国Sigma 公司),Wnt5a 抗体、GAPDH抗体和叉头盒子L2 (forkhead Box L2,FOXL2)抗体(中国Proteintech 公司),DEAD 家族多肽4(DEAD-box helicase 4, DDX4) 抗 体 ( 美 国Abcom 公司),Hoechst 抗体(碧云天生物技术有限公司),羊抗兔二抗(北京中杉金桥生物科技有限公司),BCA 蛋白定量检测试剂盒(江苏凯基生物公司)。Enspire 荧光酶标仪(美国PerkinElmer公司),化学发光检测仪(美国GE 公司)。
1.2 小鼠卵巢的摘取胚胎期(days post coitum,dpc)小鼠卵巢的分离:颈椎脱臼法处死所需胎龄胚胎期13.5 d、胚胎期15.5 d 和胚胎期17.5 d(13.5 dpc、15.5 dpc 和17.5 dpc)的孕鼠,75%酒精对孕鼠腹部全面消毒,用手术剪将带有胚胎的子宫完全剪下,置于无菌培养皿中,用眼科剪沿宫纵轴方向将子宫剪开,将胚胎从子宫中分离出来,将胚胎小鼠置于磷酸盐缓冲液(phosphate buffered solution,PBS) 溶液中,用眼科剪沿腹部侧斜方向将小鼠头腹部和尾部分离,在解剖镜下根据性腺的形态学差异区分胎鼠性别,用尖头镊子轻轻将卵巢与卵巢囊剥离,5 号注射器针头剥离卵巢周围附属组织,将胚胎小鼠卵巢完整分离出来。新生小鼠卵巢的分离:颈椎脱臼法处死新生1 d(1 day post partum,1 dpp)、2 dpp 和3 dpp 小鼠,将其表面消毒,用眼科剪沿腹部侧斜向头部的方向将小鼠的头腹部和尾部分离,用眼科镊、眼科剪和一次性注射器5 号针头等手术器械在解剖镜下根据雌雄性腺差异分辨出雌性小鼠,尖头镊子轻轻摘取雌性小鼠卵巢和卵巢囊,并剥离卵巢周围系膜等附属组织,取得完整的卵巢。
1.3 Western blotting 法检测卵巢组织中Wnt5a 和自噬相关蛋白的表达水平按照上述步骤收集小鼠围产期卵巢组织,其中胚胎期13.5 d 为对照组,分别装入1 mL 离心管中,加入大小磁珠,细胞破碎仪破碎组织数次,离心吸取上清液,BCA 试剂盒检测蛋白浓度,加入6×Loading Buffer 并煮沸蛋白,按照每孔10 μL 蛋白样品进行电泳,转膜,常温下封闭2 h,PBS 缓冲液洗膜后加入一抗,4 ℃孵育过夜,PBS 缓冲液洗膜数次,室温孵育二抗1 h,经PBS 缓冲液洗膜后,采用化学发光仪爆片。目的蛋白均由直条图表示,详细步骤见文献[11]。
1.4 组织免疫荧光共定位收取1 dpp 小鼠卵巢,4%组织细胞固定液固定卵巢3.5 h,卵巢组织按从低到高酒精梯度进行脱水、透明、浸蜡、包埋和切片,组织切片逆酒精梯度复水,抗原修复,待自然冷却后PBS 缓冲液清洗组织切片,10%驴血清封闭1 h,一抗4 ℃孵育过夜,PBS 缓冲液清洗组织切片,37 ℃避光孵育荧光二抗1 h,PBS 缓冲液清洗组织切片后荧光显微镜观察并拍照。卵母细胞胞质标记物DDX4、颗粒细胞标记物FOXL2 分别与目的抗体Wnt5a 和细胞核标记物Hoechst 共染,确定Wnt5a 蛋白定位情况,详细步骤见文献[12]。
1.5 卵巢组织培养6 孔细胞培养板中加入1 mL含10%胎牛血清和1%青霉素-链霉素的DMEM/F12 培养基,将分离的胚胎期17.5 d(17.5 dpc)卵巢组织每组10 个,放入完全培养基中,分别加入rWnt5a、抑制剂IWP2 和BOX5 处理卵巢组织,置于37 ℃恒温CO2培养箱中培养,每天拨巢2 次(保证卵巢组织处于悬浮状态),每隔2 d 换1 次培养基,体外培养4 d 后收取卵巢组织。
1.6 统计学分析采用Graph Pad Prism 5.0 统计软件进行统计学分析。各组卵巢组织中Wnt5a、LC3 和P62 蛋白表达水平均以±s表示,多组间样本均数比较采用单因素方差分析,组间均数两两比较采用LSD-t法。以P<0.05 为差异有统计学意义。
2 结果
2.1 Wnt5a 在小鼠围产期卵巢组织中的表达分别收取13.5 dpc、 15.5 dpc、 17.5 dpc、 1 dpp、2 dpp 和3 dpp 小鼠卵巢组织,提取蛋白后采用Western blotting 法检测Wnt5a 蛋白表达水平。Wnt5a 在小鼠围产期卵巢组织中均表达,呈先升高后降低的趋势,与对照组比较,Wnt5a 蛋白在17.5 dpc 高 水 平 表 达(P<0.01), 1 dpp 之 后,Wnt5a 蛋白表达水平持续降低。见图1。

图1 Wnt5a 在不同发育期小鼠卵巢中蛋白表达电泳图(A)和直条图(B)Fig. 1 Electrophoregram(A) and histogram (B) of expressions of Wnt5a protein in ovary tissue of mice at different development stages
2.2 各组卵巢卵母细胞中Wnt5a 蛋白的表达不同发育时期的卵巢组织总蛋白显示Wnt5a 蛋白均有表达,故本研究选择了新生1 d 雌性小鼠卵巢组织,采用免疫荧光法探讨Wnt5a 在卵巢组织中的位置。见图2。

图2 Wnt5a 与DDX4 荧光共定位图(Bar=200 μm)Fig.2 Fluorescence co-location of Wnt5a and DDX4 (Bar=200 μm)
2.3 各组卵巢颗粒细胞中Wnt5a 蛋白的表达Wnt5a 蛋白在新生1 d 雌性小鼠卵巢颗粒细胞中表达。见图3。
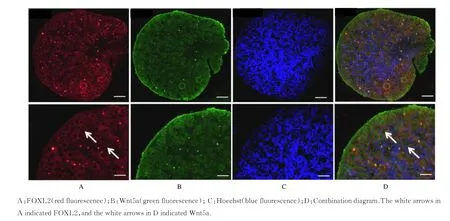
图3 Wnt5a 与FOXL2 荧光共定位图(Bar=200 μm)Fig.3 Fluorescence co-localization of Wnt5a and FOXL2 (Bar=200 μm)
2.4 Wnt5a 重组蛋白和抑制剂处理卵巢后Wnt5a的表达分离完整的17.5 dpc 小鼠卵巢组织,经rWnt5a (1 mol·L-1)、 IWP2 (1 mol·L-1) 和BOX5(1 mol·L-1)处理,体外培养4 d,Western blotting 法检测结果显示:rWnt5a 处理组Wnt5a 蛋白表达水平明显高于对照组(P<0.01),而抑制剂IWP2 和抑制剂BOX5 组均低于对照组(P<0.01),其中抑制剂IWP2 组对Wnt5a 抑制效果最为明显。见图4。

图4 各组小鼠卵巢组织中Wnt5a 蛋白表达电泳图(A)和直条图(B)Fig.4 Electrophoregram (A)and histogram (B)of Wnt5a protein expressions in ovary tissue of mice in various groups
2.5 抑制剂IWP2 处理卵巢后Wnt5a 蛋白的表达IWP2(1 mol·L-1)处理17.5 dpc 小鼠卵巢组织,体外培养4 d后,与对照组比较,抑制剂IWP2组卵巢中卵母细胞和颗粒细胞数量均减少,而卵母细胞数量减少更为明显。见图5。

图5 Wnt5a 重组蛋白和抑制剂免疫荧光图(Bar=200 μm)Fig.5 Immunofluorescence images of Wnt5a recombinant protein and inhibitor (Bar=200 μm)
2.6 Wnt5a 重组蛋白和抑制剂处理卵巢后LC3 蛋白的表达Wnt5a 重组蛋白(1 mol·L-1)和抑制剂IWP2(1 mol·L-1)处理17.5 dpc 卵巢组织,体外培养4 d,Western blotting 法检测结果显示:自噬蛋白LC3 表达水平在rWnt5a 组高于对照组(P<0.05),抑制剂IWP2 组低于对照组(P<0.01)。见图6。

图6 各组小鼠卵巢组织中LC3 蛋白表达电泳图(A)和直条图(B)Fig.6 Electrophoregram (A)and histogram (B)of LC3 protein expressions in ovary tissue of mice in various groups
2.7 Wnt5a 重组蛋白和抑制剂处理卵巢后P62 蛋白的表达Wnt5a 重组蛋白(1 mol·L-1)和抑制剂IWP2(1 mol·L-1)处理17.5 dpc 卵巢组织,体外培养4 d, Western blotting 法检测结果显示:rWnt5a 组P62 蛋白表达水平低于对照组(P<0.05),抑制剂IWP2 组P62 蛋白表达水平高于对照组(P<0.05)。见图7。

图7 各组小鼠卵巢组织中P62 蛋白表达电泳图(A)和直条图(B)Fig.7 Electrophoregram (A)and histogram (B)of P62 protein expressions in ovary tissue of mice in various groups
3 讨论
在雌性哺乳动物中,卵母细胞以卵泡的形式存在于卵巢中,原始卵泡库建立完成,卵泡的数目便不再增加,在原始卵泡库建立过程中,只有1/3 卵母细胞形成原始卵泡,并排出成熟卵子,2/3 卵母细胞丢失,然而参与围产期卵母细胞丢失的关键因子和调控机制尚不清楚[13]。鉴于Wnt 家族调控的多种生理过程,卵巢中Wnt 信号成分的存在和活性并不意外。Wnt 信号通路的组成部分已被证实影响生殖功能,包括性器官的胚胎发育和控制出生后卵巢类固醇生成的卵泡成熟调节[14-15]。新的证据强调了Wnt 信号分子在生殖周期中调控卵巢动态变化的复杂性。虽然Wnt 信号级联的中断已经被认为对正常的性发育存在不利的影响,但最近的研究开始强调这些分子在成人卵巢功能中的重要性,这些功能与卵泡发育、黄体形成、类固醇生成和生育有关[16-18]。Wnt5a 作 为 卵 母 细 胞 中 最 丰 富 的Wnt 成员,其必然参与调控卵巢卵泡发育[19-20]。本研究结果显示:Wnt5a 在17.5 dpc 小鼠卵巢组织中表达水平较高,之后直到3 dpp 均处于较低水平,Wnt5a降低并维持较低水平的这个时间段正好是卵母细胞大量丢失的时间段,这提示Wnt5a 可能在卵母细胞丢失过程中发挥一定作用。为探究Wnt5a 如何调控卵巢卵母细胞,本研究采用体外培养卵巢组织的方法,通过抑制剂IWP2 阻断Wnt 蛋白分泌,结果显示:IWP2 实验组卵巢卵母细胞减少,初步判定Wnt5a 可能参与调控卵巢卵母细胞数量。
早期研究[21]显示:自噬及其相关基因和蛋白在卵泡发育中起着关键和重要的作用,自噬发生在卵泡发育的所有阶段,然而,发生这种情况的机制是可变的。因此,迫切需要研究不同阶段或不同物种卵母细胞和颗粒细胞自噬的差异,不仅有助于研究者全面了解卵泡发育的机制,而且为卵巢早衰和卵巢癌的发生奠定了基础。Wnt5a 的自噬研究通常表现在肿瘤细胞中,早期研究[22]表明Wnt5a 在黑色素瘤等细胞中促进自噬,而其在卵巢组织中的自噬作用尚未见相关报道。本研究结果显示:过表达Wnt5a 自噬蛋白LC3 表达水平升高,P62 蛋白表达水平降低,其抑制剂结果相反,表明Wnt5a 促进卵母细胞发生自噬。
综上所述,Wnt5a 可能通过影响卵巢内自噬水平,从而调控卵母细胞的存活,后续本课组会继续深入研究Wnt5a 对小鼠卵巢和卵泡数目的调控机制。

