内质网应激PERK-eIF2α-ATF4 信号通路在延缓APP/PS1 小鼠移植瘤生长中的作用
董 营, 郭家女, 王思懿, 郭 丹, 王力可, 温 旭, 刘立峰, 曲 萌, 于春艳, 刘楠楠,王 丹, 陈昌捷
(1. 北华大学基础医学院病理教研室,吉林 吉林 132013;2. 北华大学基础医学院人体解剖学教研室,吉林 吉林 132013;3. 北华大学基础医学院分子生物教研室,吉林 吉林 132013;4. 北华大学附属医院检验科,吉林 吉林 132013)
恶性肿瘤和阿尔茨海默病(Alzheimer’s disease,AD)是威胁人类健康的两大疾病,二者之间的关系受到越来越多的关注[1]。本课题组前期研究[2]结果显示:淀粉样蛋白前体蛋白(amyloid precursor protein,APP)/早 老 素1 (presenilin 1,PS1) 双转基因小鼠,同时移植黑色素瘤B16 细胞,复制同时患有AD 和恶性肿瘤的小鼠模型,移植瘤组织生长缓慢可能与线粒体动力学紊乱有关。线粒体和内质网作为细胞内2 个重要的细胞器,二者紧密联系对线粒体动力学等进行调控[3-4],影响细胞稳态,但内质网是否在其中发挥作用尚不清楚。有研究[5-8]显示:在小鼠成纤维细胞中线粒体Mfn2 缺失诱导内质网应激(endoplasmic reticulum stress, ERS), 且 蛋 白 激 酶R 样 内 质 网 激 酶(protein kinase R-like endoplasmic reticulum kinase,PERK) - 真 核 翻 译 起 始 因 子2α (eukaryotic translation-initiation factor 2α,eIF2α)-活化转录因子4(activating transcription factor 4,ATF4)信号途径增强,ERS 的PERK 持续激活,并与线粒体功能失调有关。因此本研究旨在从PERK-eIF2α-ATF4 介导的ERS 通路角度探讨其在APP/PS1 移植瘤组织生长中的作用,为探讨AD 与肿瘤之间的关系及防治提供基础指标,具有重要的临床意义及应用前景。
1 材料与方法
1.1 实验动物、细胞、主要试剂和仪器健康C57BL/6J 小鼠和APP/PS1 移植瘤小鼠各7 只,均为雄性,体质量16~20 g,购于北京华阜康股份有限公司,SPF级(No. 11401300086251),动物生产许可证号:SCXK(京)2014-0004,小鼠饲养在安静、通风的环境中,定时喂食饮水。黑色素瘤B16细胞购于吉林大学基础医学院。Trizol 试剂购于美国Invitrogen 公司,预混型逆转录试剂购于美国Trans 公司,葡萄糖调节蛋白78(glucose regulated protein 78, GRP78)、 PERK、 磷 酸 化PERK(p-PERK)、FAM 134B、ATF4、eIF2α、磷酸化eIF2α (p-eIF2α) 和 β -actin 抗 体 均 购 自 中 国Proteintech 公 司,p-PERK 购 自Cell Signaling 公 司,GRP78、PERK 和GAPDH 引物由生工生物工程(上海)有限公司合成。蛋白浓度分析仪、蛋白质电泳装置、转移系统和凝胶成像系统(美国Bio-Rad 公司)。
1.2 移植瘤模型的制备培养黑色素瘤B16 细胞,细胞生长处于对数期时采用不含EDTA 的0.25%胰酶消化并收集细胞。先用无菌PBS 缓冲液冲洗2 次, 再 用PBS 缓 冲 液 重 悬, 细 胞 浓 度 为1×107mL-1时再用无菌注射器将100 μL 细胞悬液接种到C57 小鼠和APP/PS1 移植瘤小鼠背部右侧皮下[9]。小鼠饲养在22 ℃~24 ℃恒温、湿度为40%~60%的动物房中,每天观察小鼠的状态和肿瘤生长状况。在体移植瘤通过游标卡尺测量移植瘤的长径(a)、宽径(b) 和厚径(c),通过V=πabc/6 的方法准确计算出移植瘤体积及推算出移植瘤质量。
1.3 实时荧光定量PCR(real-time fluorescence quantitative PCR,RT-qPCR)法检测2 组小鼠移植瘤组织中GRP78、PERK 和溶酶体组织蛋白酶L(cathepsin L)mRNA 表达水平2 组小鼠于接种B16 细胞的第11 天手术,每个冻存移植瘤组织称取30 mg,加入液氮后充分研磨,应用Trizol 试剂提取总RNA,用Pure Link RNA mini 试剂盒纯化。纯化后经Nanodrop 分光光度计NP-1000 测定260 和280 nm 波长处吸光度(A)值,计算样本总RNA 浓度并评估纯度。应用预混型逆转录试剂,RNA(1 μg)得到第一条链cDNA。每个样本的5 ng cDNA应用RT-qPCR试剂盒,通过RT-qPCR法进行扩增,应用检测仪进行mRNA 水平检测,引物序列见表1。

表1 基因引物序列Tab.1 Primer Sequence of genes
反应条件:50 ℃、2 min,95 ℃、2 min 预变性,95 ℃、15 s,64 ℃、15 s,72 ℃、45 s,共40 次循环,72 ℃、10 min。系统将采集到的各反应管的荧光强度增长指数与对应的循环数绘制成每一反应管的荧光变化曲线。采用2-ΔΔCt法计算目的基 因mRNA 的 相 对 表 达 水 平,ΔCt=Ct目的基因-Ct内参照基因,依据公式求得2 组ΔCt,ΔCt 值越大表明基因表达量越低。每个基因mRNA 表达水平用定量Ct 法与管家基因水平比值作为基本水平,计算相对表达水平。
1.4 Western blotting 法检测2 组小鼠移植瘤组织中 GRP78、PERK、p-PERK、eIF2α、p-eIF2α 和ATF4 及内质网自噬标记蛋白FAM 134B 蛋白表达水平移植瘤组织中按1 mL /100 mg 加入RIPA裂解液,提取总蛋白,采用Bio-Rad 法测蛋白浓度,配制12%聚丙烯酰胺凝胶,以β-actin 水平作为等量蛋白质上样对照,取30 μg 蛋白质样品进行SDS-PAGE 电泳,恒压100 V 将蛋白转至PVDF膜,再用10%脱脂奶粉室温封闭1 h 后用含0.01%吐温20 的TBST 漂洗3 次,每次10 min;加入相应的抗体GRP78 (1∶3000)、PERK (1∶1000)、p-PERK(1∶100)、eIF2α (1∶200)、p-eIF2α(1∶200)、ATF4(1∶500)、FAM 134B(1∶500)和β-actin(1∶5000),4 ℃孵育过夜。TBST 漂洗3 次后,再加入相应的辣根过氧化物酶标记的二抗(1∶2000),室温摇床孵育2 h;再用TBST 漂洗3 次,每次10 min;ECL 发光试剂盒显色,凝胶成像分析系统拍照,以β-actin 为内参照,进行蛋白表达分析,按照下列公式计算蛋白表达水平。目的蛋白表达水平=目的蛋白条带的A 值/β-actin 条带的A 值。
1.5 免疫组织化学法检测各组小鼠移植瘤组织中蛋白质二硫异构酶(protein disulfide isomerase,PDI)蛋白表达情况石蜡切片进行透明、脱水和抗原修复后,加一抗、二抗和显色剂,苏木素复染,脱水,封片,显微镜下观察,具体染色步骤按免疫组织化学试剂盒说明书进行。
1.6 荧光法检测2 组小鼠移植瘤组织中腺嘌呤核苷三磷酸(adenosine triphosphate,ATP)水平称取20 mg 移植瘤组织加入200 μL 裂解液冰上玻璃匀浆器匀浆,台式离心机,4 ℃、12000 g离心5 min,取上清。取20 mg 组织加入200 μL 裂解液,用匀浆器进行匀浆,保证组织完全裂解。裂解后4 ℃、12000 g 离心5 min 取上清液。每个孔加入100 μL工作液,室温静置3~5 min。每个孔加样品/标准品20 μL 迅速混匀,间隔2 s,检测样品置于多功能酶标仪中,测定ATP 水平,获得相对发光单位归一化为蛋白质丰度和线粒体DNA (mitochondrial DNA,mtDNA)水平。
1.7 统计学分析采用SPSS 20.0 统计软件进行统计学分析。2 组小鼠肿瘤体积,移植瘤组织中GRP78、PERK 和cathepsin L mRNA 表 达 水 平,GRP78、p-PERK/PERK、p-eIF2α/eIF2α、ATF4和FAM 134B 蛋白表达水平及ATP 水平均符合正态分布且方差齐,以-±s表示,2 组间样本均数比较采用两独立样本t检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 2 组小鼠移植瘤组织生长情况C57 移植瘤组小鼠第4 天开始出瘤,第11 天移植瘤体积为(94.5±12.1)mm3。APP/PS1 移植瘤组小鼠在第7 天开始出瘤,第11 天移植瘤体积为(19.1±8.9) mm3。与C57 移植瘤组比较,APP/PS1 移植瘤组小鼠出瘤时间晚,肿瘤体积小(P<0.05)。
2.2 2 组小鼠移植瘤组织中GRP78 和PERK mRNA 表达水平与C57 移植瘤组比较,APP/PS1 移植瘤组小鼠肿瘤组织中GRP78 和PERK mRNA 表达水平升高(P<0.05)。见表2。
表2 2 组小鼠移植瘤组织中GRP78 和PERK mRNA 表达水平Tab. 2 Expression levels of GRP78 and PERK mRNA in transplanted tumor tissue of mice in two groups (n=7,±s)

表2 2 组小鼠移植瘤组织中GRP78 和PERK mRNA 表达水平Tab. 2 Expression levels of GRP78 and PERK mRNA in transplanted tumor tissue of mice in two groups (n=7,±s)
*P<0.05 compared with C57 transplanted tumor group.
Group C57 transplanted tumor APP/PS1 transplanted tumor GRP78 PERK 1.00±0.001.00±0.001.39±0.29* 1.26±0.15★
2.3 2 组小鼠移植瘤组织中ERS 相关蛋白表达水平与C57 移植瘤组比较,APP/PS1 移植瘤组小鼠肿瘤组织中ERS 相关蛋白GRP78 和ATF4 蛋白表 达 水 平 及p-PERK/PERK 和p-eIF2α/eIF2α 比 值均升高(P<0.05)。见图1。
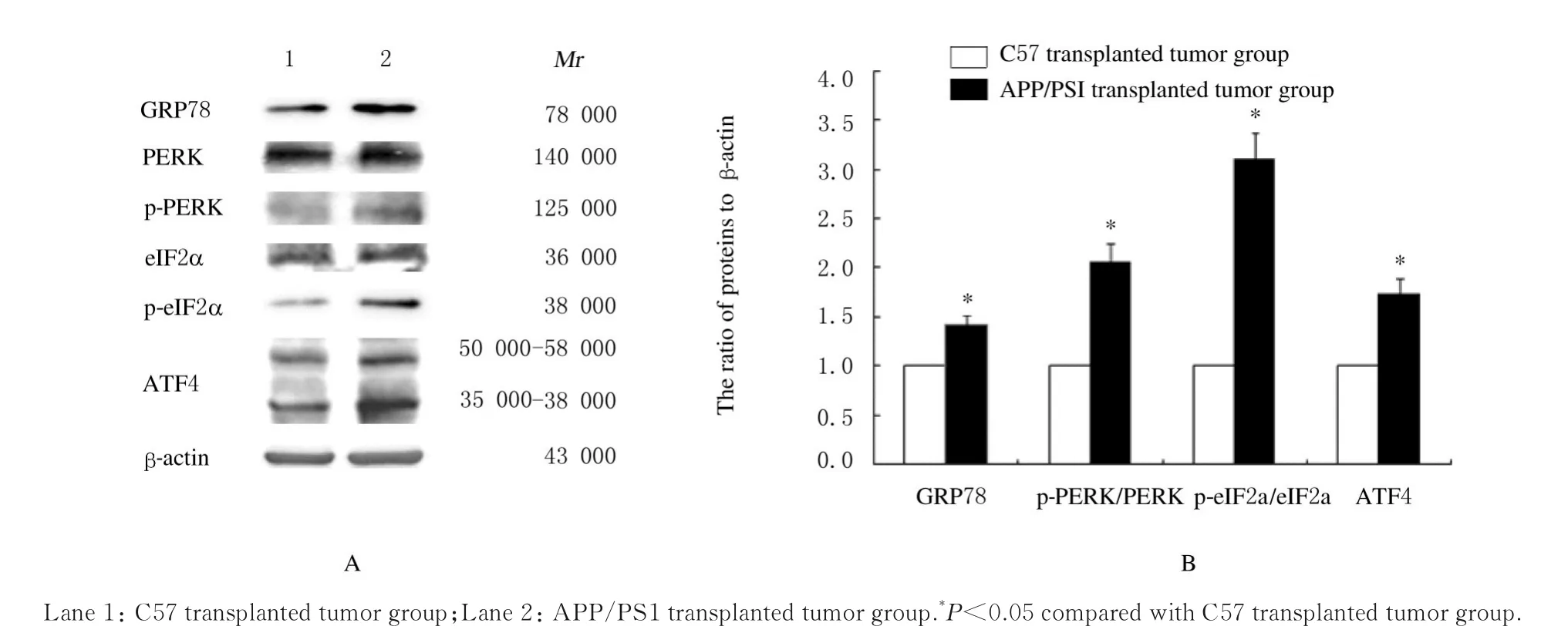
图1 Western blotting 法检测各组小鼠移植瘤组织中GRP78、PERK、p-PERK、eIF2α、p-eIF2α 和ATF4 蛋白表达电泳图(A)和直条图(B)Fig.1 Electrophoregram(A)and histogram (B) of expressions of GRP78, PERK, p-PERK, eIF2α, p-eIF2α and ATF4 proteins in transplanted tumor tissue of mice in two groups detected by Western blotting method
2.4 2 组小鼠移植瘤组织中PDI 蛋白表达C57 移植瘤组小鼠肿瘤细胞胞质内多见黑色素颗粒,为移植瘤组织的形态特征,可见少量棕黄色颗粒,为PDI 阳性颗粒。APP/PS1 移植瘤组小鼠肿瘤细胞胞质内可见少量黑色素颗粒和广泛表达的棕黄色颗粒。见图2。

图2 免疫组织化学法检测2 组小鼠移植瘤组织中PDI 蛋白表达(×400)Fig.2 PDI expressions in transplanted tumor tissue of mice in two groups detected by immunohistochemistry(×400)
2.5 2 组小鼠移植瘤组织中FAM134B 蛋白表达水平与C57 移植瘤组(1.00±0.00) 比较,APP/PS1 移植瘤组小鼠肿瘤组织中内质网自噬标记FAM 134B 蛋 白 表 达 水 平(1.41±0.06) 升 高(P<0.05)。见图3。

图3 Western blotting 法检测2 组小鼠移植瘤组织中FAM 134B 蛋白表达电泳图Fig. 3 Electrophoregram of expressions of FAM 134B protein transplanted tumor tissue of mice in two groups detected by Western blotting method
2.6 2 组小鼠移植瘤组织中cathepsin L mRNA 表达水平与C57 移植瘤组(1.00±0.00) 比较,APP/PS1 移植瘤组小鼠移植瘤组织中cathepsin L mRNA 表达水平(3.28±0.58)升高(P<0.05)。
2.7 2 组小鼠移植瘤组织中ATP 水平与C57 移植瘤组(1.00±0.00) 比较,APP/PS1 移植瘤组小鼠肿瘤组织中ATP 水平(0.54±0.06) 降低(P<0.05)。
3 讨论
本研究基于同时患有AD 和恶性肿瘤的动物模型,从ERS 通路PERK-eIF2α-ATF4 的角度,探讨移植瘤小鼠肿瘤生长情况的差异及可能的作用机制。
当细胞出现营养缺乏、缺氧、能量不足或氧化应激时,内质网会发生功能紊乱并应激释放直接产物PERK[10]。PERK 是一类具有丝氨酸/苏氨酸激酶结构域的蛋白,当PERK 被释放并通过自身磷酸化活化后,进一步激活eIF2α,短期应激时PERK 通过eIF2α 使蛋白合成停止。在细胞内主要定位于内质网的PDI,细胞内表达水平的上调可能是缓解内质网中产生过多的错误折叠蛋白压力的有效措施之一[11]。本研究结果显示:与C57 移植瘤组比较,APP/PS1 移植瘤组小鼠肿瘤组织中ERS相关蛋白GRP78 和p-PERK/p-eIF2α 蛋白表达水平升高,细胞浆PDI 阳性表达增强,均提示在APP/PS1 移植瘤组织中ERS 未折叠蛋白反应被激活。
尽管有研究[12]表明:在ERS 早期,细胞通过促进PERK-eIF2α 途径表达和提高PDI 蛋白表达,从而降低蛋白质的翻译和促进蛋白折叠水平,减少内质网腔中未折叠或错误折叠蛋白质的积累,以维持细胞内环境的稳态,但是细胞针对内质网蛋白折叠障碍时诱导的内质网未折叠蛋白反应,根据应激时间长短,所发生的作用不同。本研究结果显示:与C57 移植瘤组比较,APP/PS1 移植瘤组小鼠肿瘤组织中ATF4 蛋白表达水平升高。这与长期ERS时PERK 介导eIF2α 磷酸化、诱导ATF4 产生,激活了促凋亡蛋白产生[13]的结果相一致。细胞浆PDI 也可以靶向促凋亡蛋白Bak 形成二聚体,诱导凋亡[14]。同时有研究[15-16]表明:氧化蛋白折叠和钙离子运输进入内质网是消耗能量的过程,因此内质网被认为是细胞中ATP 消耗的主要部位。本研究结果显示:与C57 移植瘤组比较,APP/PS1 移植瘤组肿瘤组织中ATP 水平降低,以上结果均提示PERK-eIF2α-ATF4 途径可能诱导肿瘤发生凋亡,与移植瘤组织生长缓慢有关。
PERK 途径不仅与凋亡有关,与自噬和代谢也均关系密切[17]。研究[18-20]显示:在哺乳动物细胞中ERS 可以诱发自噬,在ERS 条件下可以选择性地针对内质网本身触发自噬,多余的内质网片段被递送到溶酶体,这个过程被称为内质网自噬“ERphagy”。这个过程首先有持续的PERK 寡聚化,随后PERK 下游产物ATF4 增加了自噬相关基因ATG5 的产生,然后与自噬相关基因ATG12 和ATG16L 组装, 介导微管相关蛋白轻链3(microtubule associated protein light chain 3,LC3)形成[21]。FAM 134B 是内质网自噬相关受体之一,其可以促进特异的内质网膜降解。当缺乏FAM 134B 时内质网扩张,过量表达FAM 134B 活性时内质网与LC3 相互作用被破坏,随后内质网蛋白被靶向溶酶体降解[22]。
综上所述,APP/PS1 移植瘤组织中自噬相关蛋白LC3-Ⅱ/LC3-Ⅰ表达水平升高[2],内质网自噬标记蛋白FAM 134B 蛋白表达水平和cathepsin L mRNA 表达水平均升高,提示内质网自噬与内质网未折叠蛋白反应存在密切联系,PERK-eIF2α-ATF4 途径可能参与了内质网自噬调控,在移植瘤组织生长缓慢中发挥作用。

