基于蛋白质组学技术对竹叶青蛇毒染毒家兔模型血清蛋白质变化的检测及其意义
杨尾莲, 王世军, 沈芳华, 张 勇, 陈福伟, 苏秋香, 史 超, 余沁瑶, 陈 涛
(1. 福建中医药大学附属人民医院蛇伤科,福建 福州 350004;2. 福建中医药大学研究生院,福建 福州 350122)
毒蛇咬伤是一种毁灭性的公共卫生威胁,正日益引起医学研究者的重视[1]。全世界有超过2700种蛇,其中约五分之一有毒,蛇毒一旦注入血液,将通过血液循环扩散到体内,引起各种局部或系统性中毒症状[2]。中国每年约发生10 万起毒蛇咬伤事件,其死亡率为5%~10%,另外25%~30%的受害者将遭受永久性组织损伤[3]。福建省地处亚热带地区,多丘陵,是毒蛇咬伤发生率最高的省份之一,也是毒蛇种类最多的省份之一,其中最常见的为竹叶青蛇,其为中国最毒的10 种毒蛇之一,染毒后常会导致患者神经肌肉抑制、肌肉瘫痪甚至呼吸衰竭[4]。竹叶青蛇咬伤临床的危急重症,在急诊科较为常见[5]。研究[6]显示:蛇毒从染毒部位可以迅速被吸收,进入机体血液循环,造成毒素迅速发作,这也是蛇毒中毒早期出现全身表现的原因。然而竹叶青蛇蛇毒毒液进入患者血液循环后,相关血清蛋白质的变化尚无明确报道。早期对蛇毒染毒后机制的研究一般采用免疫荧光法、酶联免疫吸附测 定 (enzyme-linked immunosorbent assay,ELISA)法和酶活性检测等传统方法,但这些方法效率较低,容易漏掉关键因素[7]。蛋白质组学作为一种新兴技术已被广泛应用于血清、脑脊液、乳头浸出液、眼泪、唾液、羊水、尿液和腹水等体液中的蛋白质谱和特性的研究[8]。MALIH 等[9]利用蛋白质组学方法研究眼镜蛇蛇毒毒液蛋白质组的交叉反应,以探究蛇咬中毒后的治疗机制。CHANG等[10]应用蛋白质组学方法鉴定了来自东南亚地区和中国2 个省份(广西省和海南省)的眼镜蛇毒液的地理变异情况。蛋白质组学可能成为研究蛇毒毒性机制的有力工具[11]。因此,为了深入了解蛇毒对血液循环的影响,本研究采用绝对定量同位素标记(tandem mass tag,TMT)技术分析竹叶青蛇蛇毒毒液染毒家兔模型后血清蛋白质的表达情况,筛选蛇毒毒液染毒过程中关键的作用蛋白,探究蛇毒染毒作用的生物学基础,为识别竹叶青蛇蛇毒染毒损伤的生物标志物提供理论和实验依据。
1 材料与方法
1.1 实验动物、试剂和主要仪器健康日本大耳兔12 只,雌雄各半,体质量2.5~3.0 kg,购于赣州畜牧研究所,动物生产许可证号:SCXK (赣)2018-0009;于SPF 级屏障环境中饲养,12 h 明暗循环,于实验开始前适应性喂养1 周。竹叶青蛇毒(福州万隆生物技术有限公司),TMT10 试剂盒(90111LCS,美国ThermoFisher 公司)、血浆去高丰度蛋白试剂盒(85165,美国ThermoFisher 公司)、BCA 蛋白定量试剂盒(CW0014S,北京康为世纪生物科技有限公司),30% 丙烯酰胺(A1010,北京索莱宝科技有限公司),Marker(#26617,美国ThermoFisher 公司),PVDF 膜(IPVH00010,美国Millipore 公司),封闭专用脱脂奶粉(P1622,北京普利莱基因技术有限公司),牛血清白蛋白(A8020, 北京索莱宝科技有限公司),超敏发光液(RJ239676,美国ThermoFisher 公司)。Q Exactive HF 质谱仪和Easy-nLC 1200 液相系统(美国ThermoFisher 公司),低温高速离心机(型号5424R,德国Eppendorf 公司),全自动酶标仪(型号WD-2102B,北京市六一仪器厂),蛋白垂直电泳仪(型号DYY-6C,北京市六一仪器厂),超高灵敏度化学发光成像系统(型号Chemi DocTMXRS+,上海伯乐生命医学产品有限公司)。
1.2 实验动物分组和模型制备12 只日本大耳兔按照随机数字表法分为假手术组和模型组,每组6 只。模型组:将竹叶青蛇毒干粉用PBS 缓冲液配制为注射液后,按照20 mg·kg-1将蛇毒注射于家兔右后腿肌肉;假手术组:按照相同剂量于右后腿肌肉注射生理盐水。4 h 后2 组家兔戊巴比妥钠麻醉后心脏采血,分离血清,用于后续检测。
1.3 样本蛋白提取每个样品取40 μL 血液,以结合缓冲液10 倍稀释,将柱体放入一个新的大小适合的收集管中,让其依靠重力流过柱体,再次以600 μL 结合缓冲液清洗柱体,收集洗脱组分即为去除白蛋白和球蛋白后的样本。将溶液在室温下12000 g 离心10 min,取上清,重复离心1 次取上清。上清即为样品的总蛋白溶液,进行BCA 蛋白浓度测定并分装后于-80 ℃储存备用。
1.4 样品蛋白胰蛋白酶酶解根据BCA 法测定的蛋白浓度,每个样品取50 μg 的蛋白,加入裂解液后加入二硫苏糖醇(dithiothreitol,DTT),在55 ℃孵育30 min。加入相应体积的碘乙酰胺,在以上溶液中加入6 倍体积的丙酮沉淀蛋白。加入100 μL 四 乙 基 溴 化 铵 (tetraethylammonium bromide,TEAB)(200 mmol·L―1)复溶沉淀,加入1/50 样品质量的1 g·L―1胰蛋白酶,并于37 ℃消化过夜。酶解后的样品冻干后于-80 ℃保存。
1.5 TMT 肽段标记实验向冻干样品中加入50 μL、100 mmol·L―1TEAB 缓冲液,涡流混匀,取出TMT 试剂,平衡至室温,加入88 μL 无水乙腈,涡流5 min,离心。取41 μL TMT 试剂加入样品中,涡流混匀,室温放置1 h。加入8 μL 5%羟胺终止反应15 min,冻干后于-80 ℃保存。
1.6 高效液相色谱-串联质谱(high performance liquid chromatography-tandem mass spectrometry,HPLC-TMS)分析处理后 样 本 在 EASY-nLC 1000液相中Agilent 1100HPLC色谱柱,先在95%的缓冲溶液中平衡,然后样品以350 nL·min―1的流速上样到预柱,再经分析柱75 μm×150 mm 分离。
样本经色谱分离后采用Q-Exactive 质谱仪进行质谱分析。检测方式为正离子母离子,扫描范围为350~165 m·z―1, 一 级 质 谱 分 辨 率 为120000(200 m·z―1),最大离子注入时间为30 ms,动态排 除时间为40 s。每次全扫描后采集20 个碎片图谱(MS2 scan),MS2 激活类型为HCD,隔离窗口为2 m·z―1,二级质谱分辨率为60000(200 m·z―1),共 进 行15 个1 h 的HPLC-TMS 分析,得出原始质谱数据。
1.7 样品筛选差异蛋白数据采用Proteome Discover 2.4 蛋白质组学分析软件分析注释信息、目标蛋白、重要信号通路和信号网络。对倍数变化≥1.2 倍,且P<0.05 的差异蛋白质进行生物信息学分析,包括利用差异表达蛋白(differentially expressed proteins,DPEs)进行样本差异蛋白基因本体(Gene Ontology,GO)和京都基因与基因组百 科 全 书 (Kyoto Encyclopedia of Genes and Genomes,KEGG)的富集分析。使用String 数据库(https://cn.string-db.org/)预测可能的蛋白-蛋白互作(protein-protein interaction,PPI)网络。
1.8 Western blotting 法检测各组日本大耳兔血清中肌酸激酶(creatine kinase,CK)和溶质载体家族16 成员1(solute carrier family 16 member 1,SLC16A1)表达水平提取各组日本大耳兔血清样本总蛋白。根据BCA 试剂盒测定蛋白浓度。蛋白变性,上样,进行十二烷基苯磺酸钠凝胶电泳1~2 h,后湿法转膜30~50 min。一抗溶液孵育,4 ℃过夜;二抗溶液中室温孵育1~2 h。在膜上滴加ECL 曝光液,在凝胶成像系统中曝光。使用图像软件Image Pro 进行定量分析,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/内参条带灰度值。
1.9 统计学分析采用SPSS 20.0 统计软件进行统计学分析。2 组日本大耳兔血清CK 和SLC16A1表达水平呈正态分布,以±s表示,2 组间样本均数比较采用两独立样本t检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 2 组样本可信蛋白相关性分析主成分分析(PCA 分析) 结果显示:与模型组(M1、M2 和M3) 比较,假手术组(CK1、CK2 和CK3) 坐标点在PCA 分析3D 图上的位置相对较远,明显分成2 簇。见图1。

图1 2 组PCA 分析3D 图Fig.13D diagram of PCA analysis in two groups
2.2 2 组样本差异蛋白表达水平与假手术组比较,模型组共鉴定出差异蛋白199 个,其中139 个蛋白表达上调,60 个蛋白表达下调,筛选条件为差异倍数(Foldchange) ≥1.2 倍且P<0.05。其中上调蛋白主要包括骨骼肌快肌肌钙蛋白2(troponin Ⅰtype 2, fast skeletal muscle,TNNI2)和小清蛋白α(parvalbum alpha,PV),参与肌肉收缩活动、 调节钙离子转运; 肌红蛋白(myoglobin,MB) 和CK 参与催化ATP 和各种磷酸原之间的转移,在能量转导中起着核心作用;SLC16A1 参与调节中枢代谢过程等。根据假手术组与模型组的差异蛋白列出明显上调的前30 个蛋白和明显下调的前30 个蛋白。见表1 和2。

表1 竹叶青蛇蛇毒染毒后前30 位上调的差异表达蛋白Tab 1 Top 30 up-regulated of differentially expressed protein after poison of snake venom of Trimeresurus stejnegeri
2.3 样本差异蛋白GO 富集分析为了明确TMT检测到的假手术组和模型组之间所有下调和上调差异蛋白的生物学过程、细胞组分和分子功能分类,进行GO 富集分析。结果显示:GO 富集度较高的生物学过程主要包括先天性免疫应答、磷脂酰胆碱分解代谢过程的调控、血小板活化因子分解代谢过程、脂肪氧化过程、免疫应答中自然杀伤细胞分化的调控、补体激活的调控和细胞质翻译的正向调控等。参与胞外调节功能过程的差异蛋白最多,其次为钙离子调节和蛋白降解调节过程蛋白。见图2。

图2 样本差异蛋白GO 富集分析直条图Fig.2 Histogram of GO enrichment analysis of sample differential proteins
2.4 KEGG 富集分析为了确定已鉴定差异蛋白在竹叶青蛇蛇毒染毒的代谢过程和生物发生过程中的作用,进行差异蛋白信号通路KEGG 分析。其中KEGG 主要富集通路分别为细胞外基质(extracellular matrix,ECM) 受体交互作用通路、磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)信号通路、补体系统改变通路、糖酵解和糖质新生等通路,其中参与ECM 受体交互作用通路和PI3K/Akt信号通路的差异蛋白最多,可能为蛇毒血液循环损伤的关键信号通路。见图3。
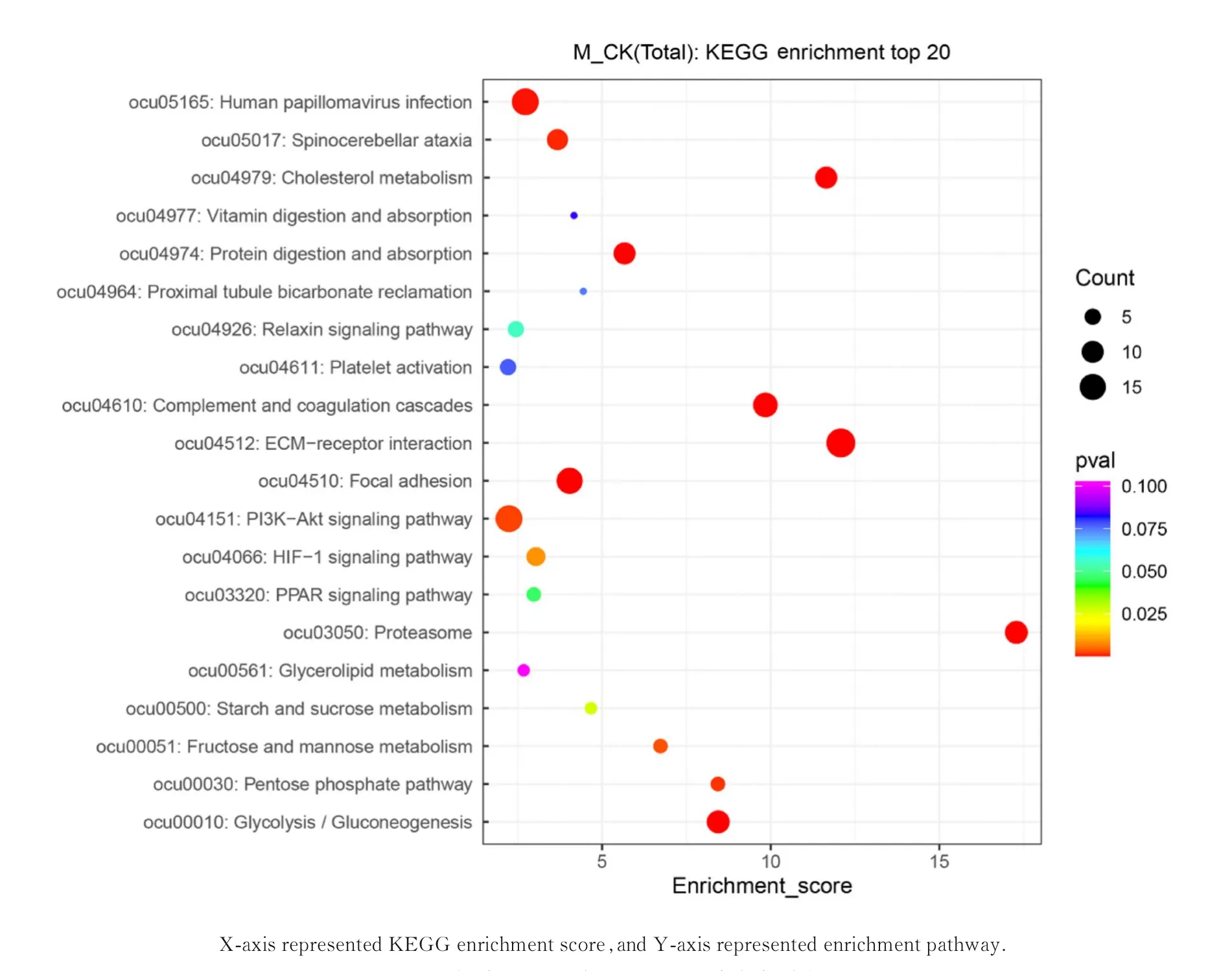
图3 样本差异蛋白KEGG 通路富集分析Fig.3 KEGG pathway enrichment analysis of sample differential proteins
2.5 差异蛋白PPI 网络分析为了对差异蛋白PPI网络进行分析,采用基因/蛋白质的搜索工具11.0(String 11.0) 数据库进行检索,得到的PPI 网络生成25 个蛋白节点和90 条边,并将数据文件直接导入Cytoscape 软件进行可视化编辑,在PPI 网络中,连接比其他更高的差异蛋白被认为是枢纽蛋白,这些枢纽蛋白可能在调控网络中发挥重要作用。 其中前4 位的分别为清蛋白(albumin,ALB)、血管性血友病因子(von willebrand factor,vWF)、糖原磷酸化酶(glycogen phosphorylase,PYGM) 和磷酸丙糖异构酶1 (triose phosphate isomerase 1,TPI1)。见图4。

图4 样本差异蛋白PPI 图Fig.4 PPI diagram of sample differential proteins
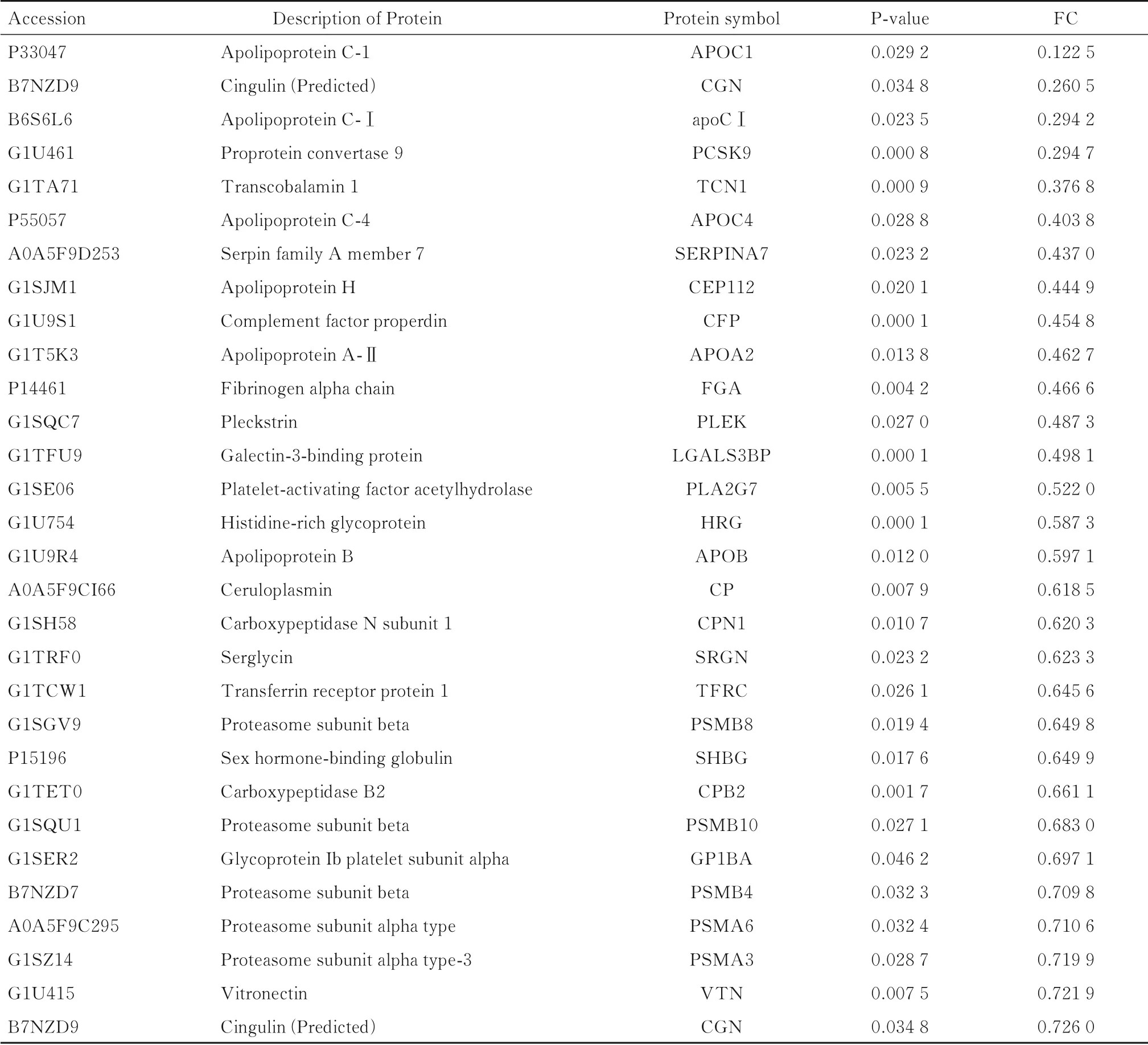
表2 竹叶青蛇蛇毒染毒后前30 位下调的差异表达蛋白Tab 2 Top 30 down-regulated of differentially expressed protein after poison of snake venom of Trimeresurus stejnegeri
2.6 Western blotting 法检测2组样本差异蛋白表达水平采用Western blotting 法对TMT 蛋白组学差异蛋白表达水平进行验证。TMT 蛋白组学检测结果显示:模型组CK 和SLC16A1 蛋白表达水平明显升高。Western blotting 法检测结果显示:与假手术组比较,模型组CK 和SLC16A1 蛋白表达水平均明显升高(P<0.05)。见图5。
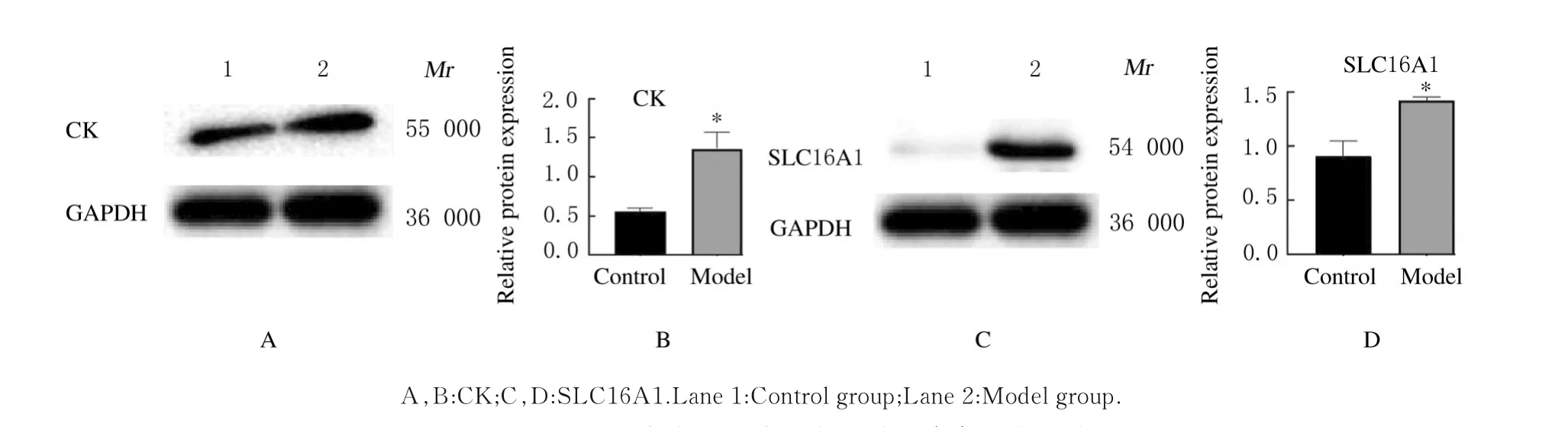
图5 2 组差异蛋白表达电泳图(A,C)和直条图(B,D)Fig.5 Electrophoregram(A,C)and histogram(B,D)of expressions of differential proteins in two groups
3 讨论
剧毒种类蛇的咬伤是致命的,然而临床诊断中暂无对于毒蛇咬伤导致染毒明确的诊断标志物或试剂盒,只能通过观察患者的临床表现进行判断,尚缺乏对毒蛇咬伤后血清蛋白谱的详细研究。因此,本研究采用竹叶青蛇蛇毒毒液建立日本大耳兔染毒模型,收集血液上清进行蛋白质组学分析,探究蛇毒染毒过程中的生物学改变情况。有助于理解竹叶青蛇蛇毒诱导机体染毒的复杂发病机制,并为其染毒临床诊断提供新的生物标志物。
本研究结果显示:竹叶青蛇蛇毒毒液诱导的毒性损伤主要影响机体先天性免疫应答、磷脂酰胆碱分解代谢调控和血小板活化因子分解代谢等过程。此外竹叶青蛇蛇毒毒素还可诱导并激活多种氧化酶和炎症相关反应。血清CK 水平已被用来作为危重患者的可能预后因素[12],但已有研究[13]指出:血清CK 水平可代表肌肉、心脏和脑损伤的出现,如心肌梗死、横纹肌溶解、自身免疫性肌炎和肾脏损伤等器官损伤通常由血液中CK 的存在来确定。本研究通过分析蛋白组学中PPI 相互作用网络发现:主要集簇聚集在心脏与骨骼肌调节的相关激酶里。心脏和骨骼肌收缩过程中受到相关激酶的调节,这些不同亚型激酶在微调肌蛋白钙离子敏感性、协同性和pH 耐受性方面发挥作用。研究[14]指出:在有重要脏器损伤危险的患者中,测定血清CK 水平能够在确定毒性严重程度方面起到重要作用,而采用Western blotting 法检测结果进一步验证了蛇毒咬伤后日本大耳兔蛋白质组学血清CK 表达水平升高。因此可以猜测CK 可能是蛇毒染毒后起到关键作用的激酶,CK 在大脑、心脏和肌肉等不同类型的身体器官中影响能量供应,而这些器官的损伤变化也往往是由于能量供应受损所致。GO 和KEGG 富集分析结果也显示钙离子信号通路改变,钙网蛋白是一种钙离子依赖蛋白,广泛分布于真核细胞中,一旦钙网蛋白与钙离子结合,即被激活,可以触发一系列激酶和磷酸酶,从而调节新陈代谢过程[15]。
此 外 包 括TNNI2、 角 蛋 白15 (keratin 15,KRT15)和肌球蛋白重链4(myosin heavy chain 4,MYH4)等多种蛋白的表达水平也在竹叶青蛇蛇毒日本大耳兔染毒模型中明显升高,提示竹叶青蛇蛇毒毒液对肌肉有明显的损伤作用[16]。另外甘油三磷酸脱氢酶1 (glycerol-3-phosphate dehydrogenase 1,GPD1)、脂肪酸结合蛋白5(fatty acid binding protein 5,FABP5) 和SLC16A1 蛋白表达水平升高,这些蛋白与代谢过程中多条信号通路的激活有关[17-19],提示竹叶青蛇蛇毒毒液进入血液循环可能通过损伤机体代谢平衡进而发挥损伤作用。SLC16A1 是一个质子连接的一元羧酸转运蛋白,催化许多一元羧酸(乳酸和丙酮酸)在质膜上的转运,SLC16A1 蛋白表达上调可以促进乳酸积累进而调节免疫炎症反应。研究[20]显示:T 细胞通过SLC16A1 转运乳酸并感知到微环境中乳酸浓度变化。高浓度乳酸抑制了T 细胞的迁移运动能力,增加炎症细胞因子的产生,最终增加了慢性炎症进程。
研究[21-24]显示:明显下调的蛋白主要包括载脂蛋白C1(apolipoprotein C1,APOC1)、转钴胺素蛋白1(transfer cobalamin protein 1,TCN1)和前蛋白转化酶枯草杆菌蛋白酶9 (proproteinin vertase Bacillus subtilisproteinase 9,PCSK9)等这些蛋白是参与信号转导的重要蛋白,具有炎症、代谢和细胞凋亡等多种生物学功能,其缺失会导致机体损伤的进一步加剧,严重者将导致死亡。
综上所述,本研究的血清蛋白组学结果反映了竹叶青蛇蛇毒染毒过程中血液循环中各类蛋白的功能分类改变情况。差异表达的高丰度蛋白CKM 和SLC16A1 为后期临床区分毒蛇咬伤提供了新的生物标志物。蛋白与蛋白间的相互作用网络有助于理解蛇毒毒液诱导机体染毒的复杂发病机制。

