肝癌患者CT 灌注成像参数与黏蛋白1、存活蛋白及微血管密度的关系
高鹏飞,李娜,景引军
1陕西省第四人民医院影像科,西安 710043
2西安唐城医院影像科,西安 710032
肝癌是临床常见的恶性肿瘤,易出现早期侵袭及转移,这也是导致肝癌患者术后复发率高的原因,可严重影响患者的生存率。因此,提高早期诊断准确率,早期给予有效的免疫治疗十分必要[1-2]。黏蛋白1(mucin 1,MUC1)也称为多态性上皮黏蛋白,有研究发现,黏蛋白与多种肿瘤相关,MUC1是其中重要的成员,可在胃癌、结肠癌、乳腺癌等肿瘤组织中异常表达[3]。肝癌作为多血管性肿瘤,血管生成是其恶性生物学行为的基础。有研究表明,存活蛋白(survivin)在肿瘤血管生成中发挥重要作用,可促进细胞增殖并抑制细胞凋亡[4]。微血管密度(microvessel density,MVD)是目前评估肿瘤血管生成的有效指标[5]。MUC1、survivin及MVD均为肝癌的早期诊断指标。随着影像学技术的发展,CT灌注成像(CT-perfusion imaging,CTPI)逐渐应用于临床,在各种肿瘤诊断中发挥重要作用[6]。为评估CTPI对肝癌的早期诊断价值,本研究分析肝脏CTPI参数与MUC1、survivin及MVD间的关系,以评估CTPI对肝癌血管生成及分化程度的诊断效能,现报道如下。
1 资料与方法
1.1 一般资料
选取2018年1月至2020年6月陕西省第四人民医院收治的原发性肝癌患者。纳入标准:①经术后病理学检查证实为原发性肝癌;②临床资料完整;③均在术前行CTPI检查。排除标准:①存在检查禁忌证;②影像学图像质量差;③合并其他恶性肿瘤;④检查前进行放疗、化疗、介入治疗、免疫治疗等。依据纳入和排除标准,本研究共纳入73例原发性肝癌患者,其中男45例,女28例,年龄38~71岁,平均(46.25±6.18)岁;分化程度:高分化10例,中分化49例,低分化14例。取73例原发性肝癌患者的肝癌组织和至少15 mm处癌旁正常组织。本研究经医院伦理委员会审批通过,所有患者及家属均知情同意并签署知情同意书。
1.2 CTPI 检查方法
采用GE 16排多层螺旋CT,检查前去除患者身上所有影响扫描的金属异物,患者平躺于扫描床上,取仰卧位。先行定位扫描,选取相应的序列扫描上腹部。扫描参数:管电压为120 kV,管电流采用自动毫安秒技术,扫描层厚7 mm,层距7 mm,螺距1.375∶1,视野25 cm×25 cm。行平扫和增强扫描,在平扫后使用双筒高压注射器,以5 ml/s速率经肘静脉注入非离子型对比剂碘普罗胺注射液50 ml,等渗盐水 40 ml,延迟扫描时间 13~16 s,双期或三期扫描。扫描完成后利用相关图像处理工作站,选择感兴趣区(region of interest,ROI),选择ROI时需避开坏死区,肝实质ROI选择时需避开大血管分支,病灶组织的ROI需要离病灶1 cm以上。测量各部位ROI的CT值,生成对应的时间-密度曲线(time-density curve,TDC),获得灌注参数图。灌注参数包括:总肝灌注量(total liver perfusion,TLP)、肝动脉灌注量(hepatic artery perfusion,HAP)、肝动脉灌注指数(hepatic artery perfusion index,HAI)、门静脉灌注量(hepatic portal vein perfusion,HPP)等,由2名专业医师进行评估。
1.3 免疫组化法检测MUC1、survivin表达情况及MVD
MUC1、survivin及MVD的检测采用免疫组化法,选取73例原发性肝癌患者的肝癌组织和至少15 mm处的癌旁正常组织,石蜡包埋,5 μm切片,连续切3张,其中2张用于免疫组化染色。免疫组化染色采用链霉菌抗生物素蛋白-过氧化物酶连结(streptavidin-peroxidase,SP)法进行检测,标本均经微波法抗原修复。滴加MUC1单克隆抗体、兔抗人survivin多克隆抗体、鼠抗人CD34单克隆抗体(用于MVD),4℃下孵育过夜;滴加生物素标记的二抗,室温下分别孵育30 min;二氨基联苯胺(diaminobenzidine,DAB)显色1~3 min;苏木素复染、脱水、透明封片后进行光镜观察。以空白实验代替阴性对照,保证特异性与可靠性。
结果判定:MUC1主要定位于细胞膜,以细胞膜出现棕黄色颗粒为阳性;survivin主要定位于细胞质,细胞质出现棕黄色判定为阳性;将与周围组织有明显区别的任何棕色染色内皮细胞或细胞丛作为MVD,记录5个高倍镜(×200)视野下的值,取平均数。MUC1、survivin阳性表达情况根据染色强度和阳性细胞所占比例进行评估,染色强度评分:无着色计0分,浅棕黄色染色计1分,棕黄色染色计2分,深棕黄色染色计3分;根据阳性细胞所占比例进行评分:阳性细胞所占比例≤5%计0分,>5%且≤25%计1分,>25%且≤50%计2分,>50%且≤75%计3分,>75%计4分。将染色强度评分与阳性细胞所占比例评分相加,≤2分判定为阴性,>2分判定为阳性。
1.4 统计学方法
采用SPSS 22.0软件对所有数据进行统计分析,计量资料以均数±标准差(±s)表示,组间比较采用t检验;计数资料以例数和率(%)表示,组间比较采用χ2检验;CTPI灌注参数与MUC1、survivin、MVD的相关性采用Pearson相关分析;以P<0.05为差异有统计学意义。
2 结果
2.1 灌注参数的比较
肝癌组织中HPP、TLP均明显低于癌旁正常组织,HAP、HAI均明显高于癌旁正常组织,差异均有统计学意义(P<0.01)。(表1)
表1 肝癌组织和癌旁正常组织中CTPI灌注参数的比较(±s)

表1 肝癌组织和癌旁正常组织中CTPI灌注参数的比较(±s)
?
2.2 MUC1、survivin及MVD表达情况比较
肝癌组织中MUC1、survivin阳性表达率和MVD均明显高于癌旁正常组织,差异均有统计学意义(P<0.01)。(表2)
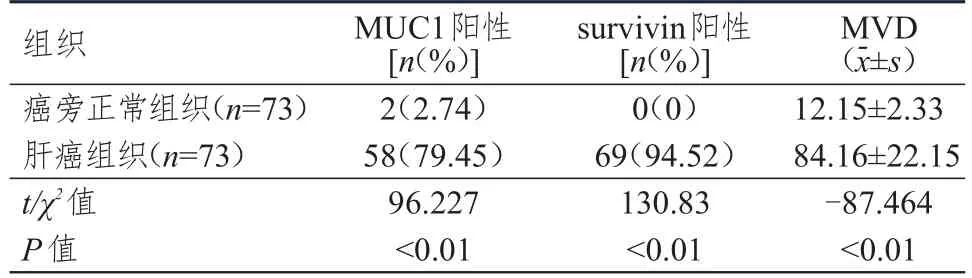
表2 肝癌组织和癌旁正常组织中MUC1、survivin及MVD表达情况的比较
2.3 CTPI灌注参数与MUC1、survivin及MVD的相关性分析
Pearson相关分析结果显示,HAP与survivin、MUC1、MVD均呈正相关(P<0.01);HPP、TLP与survivin、MUC1、MVD均无相关性(P>0.05);HAI与MVD呈正相关(P<0.01),但与MUC1、survivin均无相关性(P>0.05)。(表3)
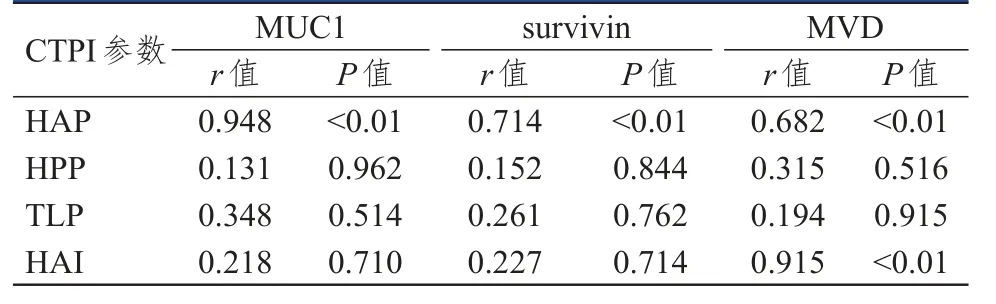
表3 CTPI灌注参数与MUC1、survivin及MVD的相关性分析
2.4 典型病例
患者男,80岁,上腹部CTPI增强扫描显示,肝Ⅶ段、肝Ⅷ~Ⅳ段呈现2个不均质团块影,病变最大截面积分别为5.4 cm×4.8 cm、4.7 cm×5.1 cm;动脉期病灶呈明显不均匀强化,中间斑片状低密度区无强化,病灶周围可见多发大小不等的环形强化影;门静脉期病灶内对比剂退出洗脱明显。(图1)
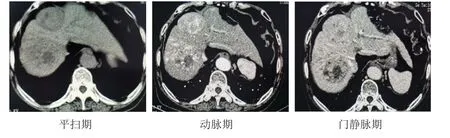
图1 上腹部CTPI 增强扫描图像
3 讨论
MUC1属于Ⅰ型跨膜蛋白,正常情况下,MUC1在正常腺细胞中表达很低,主要分布于腺细胞表面或以分泌形式存在于腺腔内,不会被免疫系统识别[7]。既往研究发现,MUC1在多种肿瘤中属于抗黏附因子,可抑制细胞黏附,但E-钙黏蛋白的表达下调可促进肿瘤细胞转移[8]。此外,也有研究显示,肿瘤细胞侵袭性增强与MUC1的表达上调密切相关[9]。survivin作为抑制凋亡蛋白家族成员,可选择性地在肿瘤组织中表达,在正常组织中几乎不表达,具有双重生物学效应,在肿瘤的发生发展中发挥重要作用[10]。血管内皮生长因子是目前已知最强的促血管生成因子,有研究提出,survivin对肝癌血管生成的作用可能是因其可介导血管内皮生长因子及碱性成纤维细胞生长因子从而促进了肿瘤血管生成[11]。MVD是血管生成的重要评价指标[12]。
目前,彩超、核素、MRI灌注成像、CTPI等无创检查是评估肝脏血流变化的主要影像学方法。其中CTPI的重复性好,可有效反映病变部位的血流动力学特征,提高对微小病灶检出率及对血管的显示能力;此外,CTPI可减少运动伪影影响,一次即可获得灌注成像、血管重建、增强检查等多个任务;此外,CTPI可利用后期专业软件分析,避免病变位置及范围影响所获得的血流灌注信息,成为评估肝肿瘤血管生成情况及其活性的首选检查方式[13-14]。本研究结果显示,肝癌组织中HPP、TLP均明显低于癌旁正常组织,HAP、HAI均明显高于癌旁正常组织,所得结果与肝癌临床及病理认知相符,HAP、HAI增高与以下3方面有关:①血管增多增粗;②新生血管基底膜不完整导致对比剂外渗增加;③灌注量增加[15]。肝癌患者多伴有肝硬化或门静脉高压,导致向肝性血流减少,门静脉至肝动脉的分流增加,且由于某些血管活性物质导致门静脉血管阻力增加导致HPP下降。碱性磷酸酶(alkaline phosphatase,ALP)下降可能是因为肝硬化状态下肝动脉缓冲效应低下、门静脉血供减少且无法被肝动脉血供代偿所致[16]。本研究结果显示,肝癌组织中MUC1、survivin阳性表达率和MVD均明显高于癌旁正常组织,提示MUC1、survivin可能参与了肝癌的发生发展过程,且与MVD可能有一定关系。本研究分析MUC1、survivin、MVD与CTPI灌注参数的相关性显示,HAP与survivin、MUC1、MVD均呈正相关(P<0.01),HAI与MVD呈正相关(P<0.01),提示CTPI灌注参数在一定程度上可反映肿瘤微循环状况及肿瘤血管生成因子的表达情况,从而为评估肿瘤血管生成提供参考依据。
综上所述,肝癌患者肝脏CTPI灌注参数与MUC1、survivin及MVD可能有关,可为肿瘤血管生成及相应生物学行为提供实时、无创的评价,为早期诊断、治疗方案拟订提供参考依据。

