表皮生长因子受体-酪氨酸激酶抑制剂耐药机制及治疗决策相关进展
王智,朱宇熹
重庆医科大学附属第一医院肿瘤科,重庆 400042
非小细胞肺癌是全球发病率和病死率最高的肿瘤[1],表皮生长因子受体(epidermal growth factor receptor,EGFR)突变是肺癌中常见的驱动基因突变,中国约62%的非小细胞肺癌患者存在EGFR突变[2],最常发生的是19号外显子缺失(47%)和21号外显子L858R突变(41%)[3]。常见的酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)在驱动基因突变晚期非小细胞肺癌的一线治疗中无进展生存期(progression-free survival,PFS)和缓解率方面均优于化疗,与化疗联合应用时可进一步延长总生存期(overall survival,OS)[4-5]。然而大多数 EGFR突变的患者在接受EGFR-TKI治疗9~14个月后会对EGFR-TKI产生耐药[6-7]。其耐药机制的研究以及耐药后的治疗策略是晚期肺癌临床治疗的难点与关键。了解晚期非小细胞肺癌患者EGFR靶向治疗药物的耐药机制,准确识别耐药的基因改变,有助于临床医师选择更合适的治疗方案,提高晚期非小细胞肺癌的治疗效果。本文就EGFR靶向治疗药物的耐药机制及治疗策略进展进行综述。
1 EGFR突变依赖性TKI耐药
1.1 T790M 突变
一代、二代EGFR-TKI 最常见的耐药机制是EGFR 20号外显子获得性T790M突变,约50%的患者耐药后检测到T790M突变[8]。目前三代TKI奥希替尼、阿美替尼、艾维替尼等可用于有EGFR T790M突变的患者。FLAURA研究结果显示,奥希替尼较一代TKI药物治疗晚期非小细胞肺癌患者显著延长PFS(18.9个月vs 10.2个月,HR=0.46,P<0.01),降低疾病进展风险[9]。2021年美国临床肿瘤学会(American Society of Clinical Oncology,ASCO)公布阿美替尼一线用于EGFR突变阳性、局部晚期或转移性非小细胞肺癌患者,Ⅲ期AENEAS研究结果显示,阿美替尼组患者中位PFS为19.3个月,显著长于吉非替尼组患者的9.9个月(HR=0.46,P<0.01)[10]。在一线TKI治疗失败后二线使用奥希替尼联合化疗或抗血管治疗,患者均无生存获益[11-12]。一线吉非替尼联合化疗的NEJ009研究显示,联合组OS有获益(50.9个月vs 38.8个月,HR=0.722,P=0.021),提示单药组部分患者在耐药后迅速死亡,没有机会接受二线治疗[13]。可见一线TKI耐药后不仅面临靶点改变,同时出现的T790M突变肿瘤细胞的克隆可能会影响细胞毒化疗的敏感性,以及暴露于联合治疗前的肿瘤再生引起微环境变化,从而导致对抗血管生成药物产生抵抗。初治时缓解率越高,残余的肿瘤负荷越低,既能减少肿瘤细胞克隆多样性,又能降低肿瘤细胞耐药性,能够更好地延缓耐药。三代TKI药物一线联合治疗是否效果更佳,需等待FLAURA2、WJOG9717L等研究的探索结果。
1.2 C797S 突变
EGFR C797S突变是奥希替尼耐药中最常见的突变,一代、二代药物耐药后二线奥希替尼治疗的AURA3试验中,有15%的奥希替尼耐药原因是出现了继发性EGFR C797S突变[14]。三代药物耐药后,获得性C797S突变与T790M突变有顺式或反式两种存在。如果C797S与T790M反式存在(两种突变各自位于不同的等位基因上),第一代和第三代EGFR-TKI联用可能会有抗肿瘤效应[15-16];然而,当C797S和T790M突变以顺式存在(两种突变各自位于相同的等位基因上),即有着EGFR、T790M、C797S三重突变的患者,经计算模拟后发现间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)抑制剂,即布加替尼(Brigatinib)更适合与三突变体EGFR的ATP口袋结合[17]。有病例报道提出,布加替尼联合EGFR单抗西妥昔单抗或血管内皮生长因子受体抗体贝伐珠单抗治疗三突变患者效果良好[18-19]。未来可考虑联合治疗为EGFR、T790M、C797S三重突变患者的新方向。除了C797S外,也发现了新的耐药突变,如L792突变、G796突变[20-21]等。
随着肿瘤进展,突变在不断发生,C797S顺、反式也可以进行转换。有病例报道,患者奥希替尼耐药后先出现C797S反式突变,进展后又出现顺式突变,导致奥希替尼和吉非替尼耐药,再次进展后发现C797S的顺、反式同时出现[22]。肿瘤的异质性及耐药突变多样性,提示在靶向治疗的各阶段多次进行基因检测很有必要。
1.3 20外显子插入
20外显子插入突变(exon 20 ins)占EGFR突变的4%~12%,仅次于19del及L858R突变[23]。EGFR exon 20 ins的高度异质性导致了患者对EGFR-TKI展现出不同的敏感性,763_764insFQEA是目前发现的exon 20 ins突变中对一代、二代TKI均有敏感性的突变,而其他突变普遍缺乏敏感性[24]。回顾性分析EGFR exon 20 ins患者的PFS和OS同样发现,这类患者对化疗、TKI及免疫治疗效果均欠佳[25]。埃万妥单抗(Amivantamab)为新型EGFR-cMET特异性双抗体,可阻断原发性及继发性EGFR突变体和cMET通道,有效降低EGFR-cMET水平和诱导免疫介导的抗肿瘤活性,抑制细胞增殖[26]。2021年ASCO会议报道了真实世界中埃万妥单抗对比外部对照(包括化疗、免疫治疗、EGFR-TKI),中位OS分别为22.8个月和13.1个月(HR=0.53),获益明显,埃万妥单抗已获批用于EGFR exon 20 ins的非小细胞肺癌治疗[27]。2021年ASCO会议中还报道了埃万妥单抗联合Lazertinib(一款三代EGFR抑制剂)针对奥希替尼耐药后新的治疗策略,客观缓解率(objective response rate,ORR)达到36%,中位缓解持续时间为9.6个月,中位PFS为4.9个月,初步可见优异的疗效[28]。
其他EGFR突变罕见,包括T854A、D761Y和L747S等可见于病例报道[29-30]。
2 EGFR 非依赖性耐药
EGFR胞内酪氨酸激酶被EGFR-TKI抑制后,其他酪氨酸激酶受体可形成异源二聚体,代偿激活转导下游信号。如肝细胞生长因子(hepatocyte growth factor,HGF)/间质表皮转化因子(mesenchymal to epithelial transition factor,MET)扩增[31]、人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)扩增[32]、胰岛素样生长因子 1受体(insulin-like growth factor 1 receptor,IGF1R)/EGFR异二聚体形成[33]、磷脂酰肌醇-4,5二磷酸3-激酶催化亚单位α(phosphatidylinositol-4,5-bisphosphate 3-kinase catalytic subunit alpha,PIK3CA)突变、磷酸酶张力蛋白同源物(phosphatase and tensin homolog,PTEN)缺失、鼠肉瘤病毒基因家族(rat sarcoma virus gene,RAS)突变/扩增、鼠类肉瘤病毒癌基因同源物B1(v-raf murine sarcoma viral oncogene homolog B1,BRAF)融合突变等[34-35]多种信号通路参与EGFR-TKI旁路激活耐药机制发生。
2.1 MET 扩增
MET基因扩增激活蛋白诱导自身磷酸化并与人类表皮生长因子受体3(human epidermal growth factor receptor 3,ERBB3)结合,ERBB3通过激活磷脂酰肌醇-3-羟激酶(phosphatidylinositol 3-hydroxy kinase,PI3K)/蛋白激酶 B(protein kinase B,PKB,又称AKT)信号通路来促进肺癌吉非替尼获得性耐药[36]。MET拷贝数增加并不能用于判断EGFRTKI疗效,除非经证实确定存在MET扩增,对此类患者来说EGFR-TKI疗效差、易产生耐药[31]。一代、二代EGFR-TKI耐药患者中MET基因扩增发生率为5%~20%[37],一线及二线的奥希替尼耐药患者中MET基因扩增患者比例则高达15%~19%[38-39]。MET扩增可致EGFR-TKI耐药,但EGFR通路仍然活跃,可考虑在原有EGFR-TKI的基础上联合MET抑制剂。TATTON研究显示,对于一代、二代耐药后患者,无论T790M状态,赛沃替尼联合奥希替尼治疗的ORR为65%~67%,中位PFS为9~11个月。而奥希替尼耐药合并MET扩增人群,联合治疗的ORR为30%,中位PFS为5.4个月[40]。
2.2 HER2基因扩增
HER2和EGFR相互结合可以不依赖EGFR间接激活PI3K,HER2拷贝数增加也可能为EGFR靶向治疗潜在的耐药机制[32]。在奥希替尼一线、二线耐药后分别有2%及5%的患者发现了HER2扩增[38-39]。对于一线治疗的患者,二代药物作为ERBB家族不可逆抑制剂可供选择。在肺癌细胞实验中证明了曲妥珠单抗药物(T-DM1)可以克服奥希替尼耐药性[41]。对于存在HER2扩增的奥希替尼耐药患者,可考虑联合T-DM1给药作为一种潜在治疗策略。
2.3 BRAF 突变
1.5%~3.5%的非小细胞肺癌患者存在BRAF突变[42],可分为V600E和非V600E BRAF突变。BRAF突变可激活下游MEK-ERK通路,也是三代EGFRTKI的耐药机制之一[43]。约3%奥希替尼耐药患者继发BRAF V600E突变[44]。BRF113928研究结果显示,BRAF V600E突变非小细胞肺癌患者一线接受达拉非尼联合曲美替尼治疗后,中位PFS和OS分别达到了14.6个月和24.6个月[45]。对于奥希替尼耐药诱导的BRAF V600E突变,已有多个病例报道使用达拉非尼、曲美替尼联合奥希替尼来探索治疗[46-47]。虽然联合治疗患者疗效尚可,但最佳药物关联和剂量以及不良反应在很大程度上是未知的,因此需要对联合机制进一步研究,在此基础上再开展相应临床研究。
2.4 PI3K/AKT/雷帕霉素靶蛋白(mechanistic target of rapamycin kinase,MTOR)通路激活
作为EGFR下游通路,PI3K通路的旁路激活可以通过PIK3CA突变/扩增和PTEN缺失两种途径发生[34]。与大多数致癌驱动基因突变的互斥性相反,肺腺癌TKI耐药后的患者可见PIK3CA突变与其他致癌驱动基因突变同时发生的现象[48]。在AURA3研究后续进行二代测序分析中,2/3的奥希替尼耐药病例中有PIK3CA扩增与HER2扩增共同发生[39]。但依维莫司作为MTOR1抑制剂联合EGFR-TKI对PI3K通路异常的非小细胞肺癌患者的抗肿瘤活性有限[49]。
3 细胞表型转变
尽管非小细胞肺癌和小细胞肺癌病理学特征和基因组不同,但其可能具有共同的细胞来源。EGFR-TKI耐药的患者中存在非小细胞肺癌转化为小细胞肺癌的现象从而产生耐药,占3%~15%的比例[50],可尝试选择使用传统依托泊苷/伊立替康联合铂类药物化疗方案进行治疗,在小细胞肺癌的标准化疗方案进展后可以选择安罗替尼进行治疗[51]。非小细胞肺癌患者的视网膜母细胞瘤基因1(retinoblastoma 1,RB1)[52]和肿瘤蛋白53基因(tumor protein 53,TP53)失活[50]以及神经元特异性烯醇化酶(neuron specific enolase,NSE)[53]、血浆胃泌素释放肽前体(progastrin-releasing peptide,ProGRP)[54]可作为揭示潜在的小细胞肺癌转化的临床监测指标。靶向治疗进展后肿瘤活检成为常规项目,存在小细胞肺癌转化的耐药患者将会被更多地发现。一项多中心回顾性研究表明,转化后仍然存在EGFR突变的患者可继续接受靶向治疗联合化疗或化疗间期服药,有部分患者可获益,而后续选择使用免疫治疗的患者则没有应答[55]。这让人进一步联想到是否存在小细胞肺癌转化的肿瘤在生物学行为学上更类似于亲代的EGFR突变型腺癌,而不是传统的小细胞肺癌病例,也就意味着EGFR突变患者免疫治疗效果欠佳。
4 其他非典型机制
另外肿瘤通过外泌体包装释放lncRNA H19也可促进非小细胞肺癌对吉非替尼耐药[56]。miRNA可通过对PI3K/AKT/MTOR信号通路的调控、介导上皮-间充质转化调节以及干扰EGFR-TKI诱导的细胞凋亡来导致耐药[57]。
5 EGFR-TKI 原发性耐药与程序性死亡受体配体1(programmed cell death1 igand 1,PDCD1 LG1,也称PD-L1)表达
目前EGFR-TKI获得性耐药的部分机制已明确,但原发性耐药机制研究却相对较少。不同于获得性耐药会通过上调PD-L1表达促进肺癌细胞的免疫逃逸[58],有多项研究探讨了PD-L1表达水平与原发性耐药之间的关系[59]。其中Su等[60]发现PD-L1高表达与PD-L1低表达、阴性表达患者相比,客观反应率显著降低(35.7%vs63.2%vs67.3%,P=0.002),PFS缩短(3.8个月vs6.0个月vs9.5个月,P<0.01)。此外,PD-L1阳性表达多见于原发性耐药患者,而非获得性耐药患者(66.7%vs30.2%,P=0.009)。有研究认为,PD-L1可能通过上调转化生长因子-β(transforming growth factor-β,TGF-β)/Smad信号通路进一步诱导上皮-间充质转化并促进迁移和侵袭,最终导致EGFR-TKI原发性耐药[61]。联合靶向PD-L1的免疫治疗也许能逆转EGFR-TKI耐药性。
本文总结一些常见的耐药机制及用药选择,详见表1。
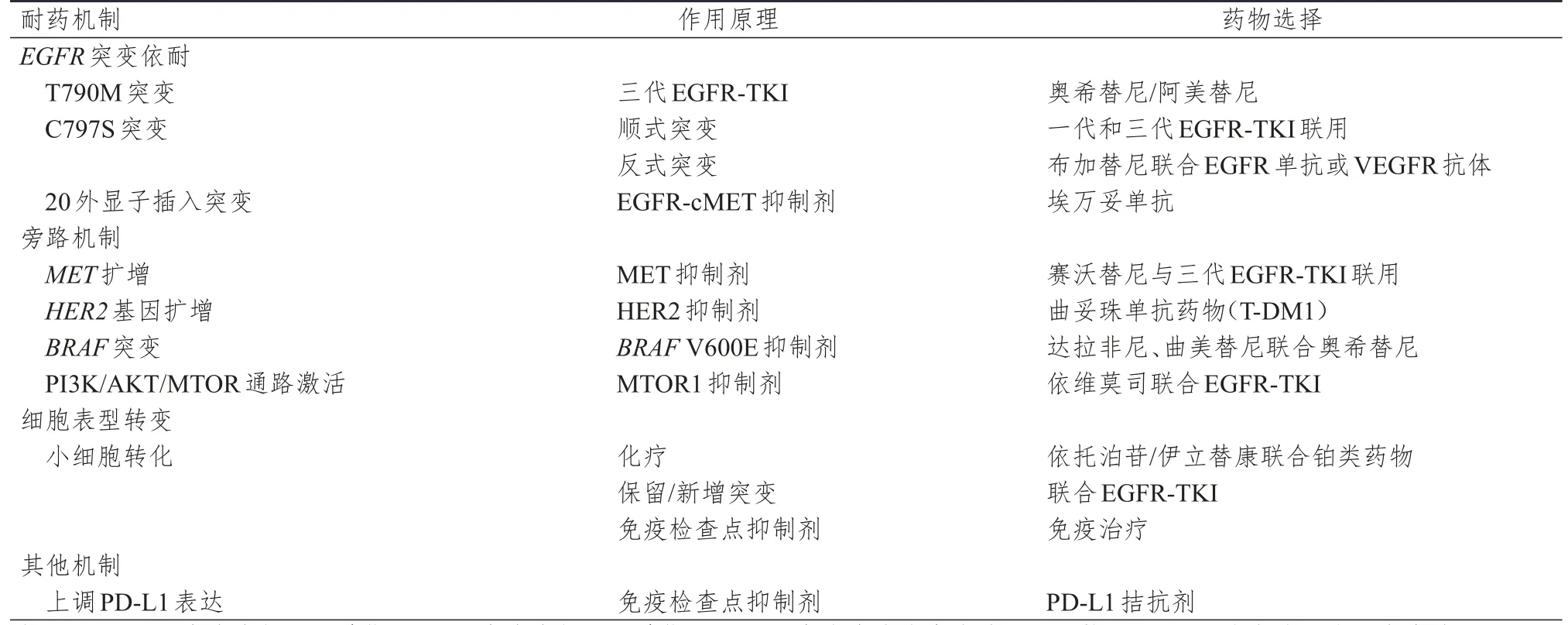
表1 常见耐药机制及用药选择
6 EGFR-TKI与免疫治疗
研究显示存在EGFR突变的肿瘤总体上对免疫检查点抑制剂的反应率较低,但仍有一些报道称EGFR突变亚型会影响免疫检查点抑制剂的效果。EGFR 19外显子缺失相比EGFR野生型患者,运用PD-L1拮抗剂后总体反应率(7%vs 22%,P=0.002)及OS更差(HR=0.69,P=0.03),L858R突变患者与野生型患者相似。对于EGFR-TKI耐药患者,T790M的状态并不影响治疗获益[62]。然而,实际临床上效果欠佳,与纳武单抗联合治疗时EGFR-TKI导致的间质性肺炎风险显著增加(5.09%vs 1.22%)[63]。奥希替尼联合度伐利尤单抗致间质性肺病的发生率高达38%[64]。度伐利尤单抗和吉非替尼联合应用后PFS未见显著延长,且有35%的患者因转氨酶升高而停药[65]。应用PD-L1抑制剂后继续使用奥希替尼会发生严重的免疫相关不良事件。但当奥希替尼先于PD-L1抑制剂或当PD-L1抑制剂后使用其他EGFR-TKI时,未观察到免疫相关不良事件[66]。EGFR-TKI和PD-L1抑制剂的使用顺序也是一个非常值得关注的问题。必要时二次活检评估PD-L1表达是否出现变化,同时可完善组织免疫浸润细胞分类,明确肿瘤微环境是否能产生免疫应答。避免无法产生免疫应答情况下长时间使用免疫检查点抑制剂带来的相应不良反应。总之,获得更多证据之前,临床上应谨慎使用PD-L1抑制剂联合EGFR-TKI治疗。
7 小结与展望
晚期非小细胞肺癌患者虽然经过EGFR-TKI靶向治疗有较好的临床疗效,但随着治疗时间延长部分患者会导致继发性耐药。充分了解耐药的机制有助于临床针对性治疗,大部分晚期非小细胞肺癌再次完善活检较为困难,为更加明确耐药基因改变,建议采用二代测序检测技术,以防止不断更换的治疗药物选择压力下出现未识别到的新耐药突变,从而降低患者的临床获益。
对于晚期非小细胞肺癌靶向治疗耐药后患者的处理,需要根据耐药的新突变制订方案。新突变出现后既往的驱动基因并未完全失活,联合用药可以做到更全面覆盖突变通路,但联合用药如何做到疗效与不良反应协调、药物减量及如何选择最佳组合模式,需要针对联合药物进行基础机制探索,进而推进临床试验。晚期耐药肺癌治疗复杂且多变,必要时可结合公共数据库信息,采用大数据个体化方法分析实际耐药相关基因,也鼓励针对个体化方案及剂量的深入探索,等待将来更多更好的药物为患者带来最大的生存获益。

