FAstV、FPV 和FECoV 三重PCR 检测方法的建立及应用
肖 连,郭 琪,黄 坚,杨晓农,李 妍
(1. 西南民族大学畜牧兽医学院,四川 成都 610041;2. 四川医疗器械生物材料和制品检验中心有限公司,四川 成都 610000)
猫腹泻性疾病在临床上较为多发,尤其是传染性病原引起的临床危害最为突出,其中以猫泛白细胞减少症病毒(Feline parvovirus,FPV)为代表的肠道病毒是引起幼年猫发病死亡的主要原因[1-2].因此,对FPV的临床关注要高于其他已知的猫肠道病毒.病毒宏基因组学研究的结果表明,猫粪便样本中存在FPV 与猫星状病毒(Feline astrovirus,FAstV)、猫肠道冠状病毒(Feline enteric coronavirus,FECoV)以及其他多种肠道病毒混合感染的情况[3]. 临床上FPV 与FECoV可引发不同程度的呕吐和(或)腹泻等消化道症状.FECoV 感染猫康复后可隐性带毒,导致该病原对周围环境的持续污染[4].虽暂无致病性试验证实FAstV 与猫腹泻直接相关,但通过电子显微镜可从腹泻猫的粪便样本中鉴定出FAstV[5],且FAstV 在不同国家和地区猫群的粪便样品中呈现一定的检出率(7.0% ~36.2%)[6-8].目前对于这三种病原直接临床诊断较为困难,且依然缺乏同步的病原鉴别诊断方法,因此需要建立多重PCR 方法以实现准确的同步检测.
FPV 为双股DNA 病毒,其结构蛋白VP2 为主要的抗原衣壳蛋白,且不同来源毒株的VP2 基因同源性大于99%[9],因此常作为特异性的分子检测靶点.FAstV 为单股正链 RNA 病毒,包括3 个重叠的 ORF片段,其中编码非结构蛋白的 ORF1b 片段更为保守[10],作为靶标已成功用于FAstV 的分子检测[8].FECoV 为单股正链RNA 病毒,包括11 个 ORF 片段,而针对膜蛋白N 基因设计的RT-PCR 检测方法可以获得最高的阳性检出率[11],因此是稳定的检测靶标.研究团队在过往研究中分析了成都市区猫群中FPV、FAstV 和FECoV 的感染情况[8],发现多病原混合感染情况较为普遍,但均采用单一PCR 方法进行检测,故诊断效率不高. 目前国内尚未有同时检测 FPV/FAstV/FECoV 的分子检测方法,因此本研究拟建立能在同一反应体系中快速检测上述病原的三重PCR 方法,并对临床样本进行检测分析,了解当下成都市区这三种病毒的流行现状,丰富流行病学资料.
1 材料与方法
1.1 材料
1.1.1 样本来源
猫星状病毒(FAstV)、猫细小病毒(FPV)、猫肠道冠状病毒(FECoV)、猫诺如病毒(Feline Norovirus,FNoV)、猫鼻气管炎病毒(Feline rhinotracheitis virus,FRV)、猫嵌杯状病毒(Feline calicivirus,FCV)、犬细小病毒(Canine parvovirus,CPV)和犬冠状病毒(Canine coronavirus,CCoV)的阳性样本均由本西南民族大学动物医学实验室鉴定保存. 207 份猫粪便样本(66 份临床健康样本,141 份腹泻样本)采集自于成都市区5 家宠物医院(2019 年 11 月 ~2020 年11 月).
1.1.2 主要试剂
病毒基因组DNA/RNA 提取试剂盒、大肠杆菌DH5α 感受态细胞和 DNA Marker Ⅱ、2 × Taq PCR Mastermix 购自天根生化科技(北京)有限公司产品;RNAiso Plus、pMD19-T 载体、Prime ScriptTMRT 购自宝生物工程(大连)有限公司产品;E. Z. N. A©Gel Extraction Kit 胶回收试剂盒和E. Z. N. A.©PlasmidDNA Mini Kit 质粒提取试剂盒购自OMEGA Bio-Tek 公司.
1.1.3 引物设计和合成
根据GenBank 中FECoV(KY566208.1)N 基因序列,应用Primer Premier 5 软件设计检测引物,FAstV ORF1b[8]和FPV VP2[12]的引物序列引自参考文献,由生工生物工程(上海)股份有限公司负责合成,引物信息见表1.
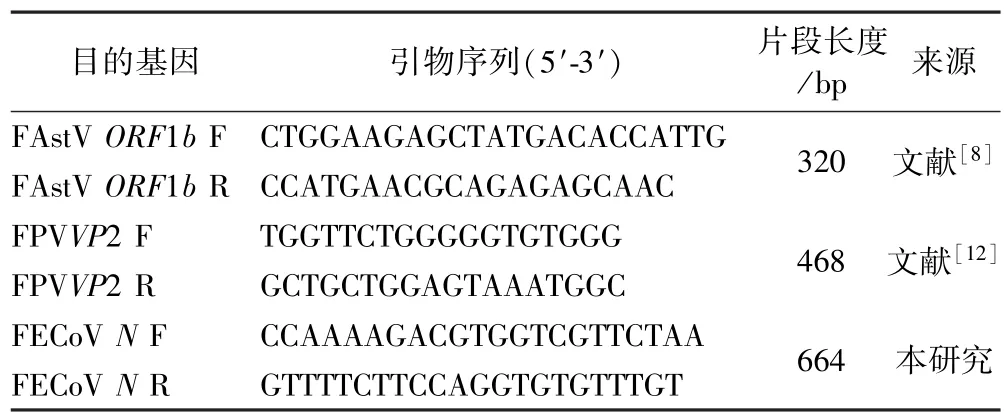
表1 引物信息Table 1 Primer information
1.2 方法
1.2.1 样品处理及核酸的提取及cDNA 制备
将采集到的粪便样本用1% ~2%双抗+PBS,分装EP 管,于-80 ℃反复冻融 3 次,5 000 r/min,离心8 min后,取上清液.按照试剂盒说明书操作步骤提取DNA 或RNA.按照Prime ScriptTMRT 说明书的方法配置反应体系,将提取的RNA 反转录成cDNA.反转录体系为20 μL,含 5 × PrimeScript Buffer 4 μL、PrimeScript RT Enzyme Mix 1 μL、Random 6 mers 2 μL、RNA 4 μL、RNAase Free dH2O 9 μL. 反转录反应条件:37 ℃,15 min;85 ℃,15 s;16 ℃,10 min,将 cDNA 置于-20 ℃冰箱保存.
1.2.2 PCR 扩增及电泳检测
利用表 1 合成的 FAstV、FPV 和 FECoV 的 3 对引物分别对cDNA 进行PCR 扩增,不同引物退火温度设置不同.反应程序为:95 ℃,2 min;95 ℃,30 s;52 ℃ /49 ℃ /56 ℃,30 s,72 ℃,30 s, 35 个循环;72 ℃,10 min,反应体系为 20 μL(2 ×Tap Master Mix 10 μL、上下游引物各 1 μL、cDNA 2 μL、ddH2O 6 μL). PCR产物经1.5%琼脂糖凝胶电泳鉴定.
1.2.3 质粒标准品的制备
将阳性PCR 产物按照E. Z. N. A. © Gel Extraction Kit 试剂盒说明书操作步骤进行胶回收,并连接于pMD19-T 载 体, 分 别 构 建 得 到 pMD19-T-FAstV ORF1b、pMD19-T-FPV VP2 和 pMD19-T-FECoV N 三种重组质粒,转化大肠杆菌DH5α 感受态细胞,挑选阳性克隆并由生工生物工程(上海)股份有限公司进行序列测定.将测序正确的阳性菌分别接种于含Amp(50 μg/mL)的2 ×YT 液体培养基中振荡培养过夜,按照 E. Z. N. A.©PlassmidDNA Mini Kit 试剂盒说明书操作步骤进行质粒的提取,使用Nanodrop 分光光度计测定质粒浓度.
1.2.4 FAstV、FPV 和 FECoV 三重 PCR 的建立及条件优化
将提取的 FPV、FAstV 和FECoV 质粒稀释到相同的数量级后,分别取20 μL 混匀,作为三重PCR 的检测模板,用以优化反应体系的引物终浓度和退火温度. 引物浓度优化的 PCR 总反应体系为 25 μL:FAstV、FPV 和 FECoV 检测模板 DNA 1.5 μL:2 × Taq PCR Master Mix 12.5 μL,将表 1 合成的 FAstV、FPV和FECoV 三对引物按不同添加量加入反应体系中见表2,引物的初始浓度均为10 μM,其余体积用ddH2O补足. 扩增程序为:95 ℃预变性 2 min,95 ℃ 30 s,52 ℃ 30 s,72 ℃ 30 s,共 35 个循环,最后 72 ℃ 延伸10 min.扩增结束后,取8 μLPCR 产物用1.5%琼脂糖凝胶电泳检测,以能同时扩增出清晰的三条目的条带做为判定标准选择最佳引物浓度.退火温度优化的总反应体系为 25 μL:FAstV、FPV 和 FECoV 混合模板DNA 1.5 μL;2 × Taq PCR Master Mix 12.5 μL;以优化后的引物浓度条件添加入三对引物,其余反应体系由ddH2O 补足.扩增程序中退火温度分别设置为48 ℃、50 ℃、52 ℃ 、54 ℃、56 ℃和 58 ℃共 6 个不同的梯度,并设置阴性对照.PCR 扩增产物用1.5%琼脂糖凝胶电泳检测,以能同时扩增出清晰的三条目的条带做为判定标准选择最佳退火温度.

表2 三重PCR 的引物浓度正交筛选Table 2 Orthogonal Screening of final concentration of primers for triple PCR
1.2.5 三重PCR 方法的检验
1.2.5.1 特异性试验
为评价优化的三重 PCR 的特异性,分别对FAstV/FPV/FECoV 的混合模板和FAstV、FPV 和 FECoV 单一模板以及猫诺如病毒(FNoV)、猫轮状病毒(FRV)、猫杯状病毒(FCV)、犬细小病毒(CPV)和犬冠状病毒(CCoV)的阳性核酸模板进行检测.
1.2.5.2 敏感性试验
为评价优化的三重PCR 的敏感性,将获得的三种质粒模板分别进行10 倍梯度稀释,共计8 个梯度,分别为 1 × 100、1 × 101、1 × 102、1 × 103、1 × 104、1 ×105、1 ×106、1 ×107;各个稀释梯度分别取 0.5 μL 质粒混匀,作为模板进行扩增.
1.2.5.3 重复性试验
为评价该三重 PCR 的稳定性,对 FAstV/FPV/FECoV 混合核酸样本进行4 个批次的重复试验.
1.2.6 临床应用
应用建立的 FAstV、FPV 和 FECoV 三重 PCR 对207 份猫粪便样本(66 份临床健康样本和141 份腹泻样本) 进行检测,同时用针对三种病原的单一PCR[9,12]进行验证.
2 结果
2.1 FAstV/FPV/FECoV 三重PCR 条件优化及反应建立
2.1.1 引物浓度的优化结果
三对引物均能扩增出相应的病毒靶基因,电泳结果和测序结果均与参考基因相符. 在三重PCR 的反应体系中改变三对引物的添加量进行正交试验,引物添加量为0.4 ~0.7 μL,对应的引物终浓度为0.16 ~0.28 μM.结果如图 1 显示,泳道 13、15、16、31 能清晰扩增出三条目的条带(FPV 为468 bp,FAstV 为320 bp,FECoV 为664 bp).而泳道31 与其它三个泳道相比没有产生明显的引物二聚体,且引物浓度合理,因此最终确定三重 PCR 的25 μL 反应体系中 FAstV、FPV 和 FECoV 的引物添加量分别为 0.4 μL、0.4 μL和0.4 μL,即引物浓度均为0.16 μM.

图1 三种病毒引物浓度的正交试验M:DNA Marker II;1-36:样本;N:阴性对照.Fig.1 Orthogonal tests of three virus primer concentrations
2.1.2 退火温度的优化结果
设定6 个不同的退火温度进行三重PCR 扩增,结果见图2.以能同时扩增出三条目的条带且亮度理想为标准,最终选择适宜的退火温度为54 ℃.
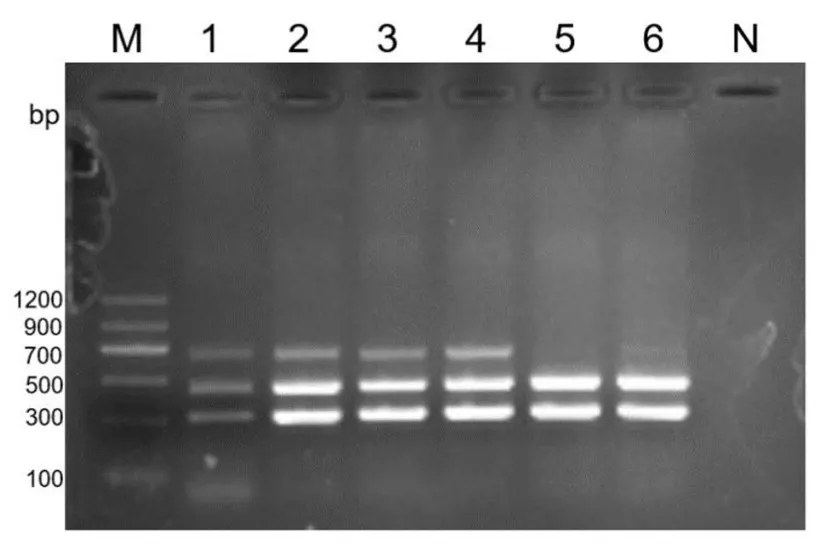
图2 三重PCR 退火温度的优化M:DNA Marker II;1-6:48 ℃、50 ℃、52 ℃、54 ℃、56 ℃、58 ℃;N:阴性对照Fig.2 Optimized annealing temperature of the triple PCR
2.2 FPV/FAstV/FECoV 三重 PCR 的检验结果
2.2.1 特异性
用已建立的三重PCR 对8 种犬猫病原的阳性模板进行检测,除FPV、FAstV 和FECoV 外,另外五种病原均不能扩增出相应条带(图3). 结果表明,本研究建立的三重PCR 特异性良好.

图3 三重PCR 的特异性试验M:DNA Marker II;1-3:FPV、FAstV 和 FECoV;4:FPV、FAstV 和 FECoV 的混合质粒;5-9:FRV、FCV、FNoV、CPV 和 CCoV;N:阴性对照Fig.3 Triple PCR specificity test
2.2.2 敏感性
分光光度计测定FPV、FAstV 和FECoV 的质粒浓度分别为 24.1ng/μL、71.2ng/μL 和 51.0 ng/μL. 使用建立的三重PCR 方法对梯度稀释的质粒进行检测,结果显示,FPV、FAstV 和 FECoV 的最低限分别为2.4 pg/μL、7.1 pg/μL 和5.1 pg/μL(图4),即拷贝数分别为 4.7 × 106copy/μL、2 ×107copy/μL 和 7 × 106copy/μL.

图4 三重PCR 敏感性试验M:DNA MarkerII;1-8:100、101、102、103、104、105、106、107梯度稀释;N:阴性对照Fig.4 Triple PCR sensitivity test
2.2.3 重复性
用建立的三重 PCR 对 FPV、FAstV 和 FECoV 的模板进行了4 个批次的重复检测,均稳定获得一致的试验结果,表明该方法的重复性良好.
2.3 临床应用
同时使用已建立的三重PCR 和单一PCR 对207份猫肛拭子样本进行病毒分子检测. 三重PCR 检测结果显示FAstV 检出率为24.2%(50/207),其中腹泻猫的检出率为24.8%(35/141)略高于临床健康猫22.7%(15/66);FPV 的检出率为 37.2%(77/207),其中腹泻猫的检出率为48.9%(69/141)显著高于临床健康猫 12.1% (8/66);FECoV 检出率为 15.5%(32/207),其中腹泻猫的检出率为12.7%(20/141)低于临床健康猫18.2%(12/66).部分临床样本扩增结果见图5.其中,FPV/FAstV、FPV/FECoV 和 FAstV/FECoV 的混合感染率分别为9.2%(19/207)、6.3%(13/207)和 6.3% (13/207),FPV/FAstV/FECoV 的三重混合感染较少见(2.4%,5/207). 检测结果与单一PCR 结果符合度为100%,表明该三重PCR 能够快速的检测这三种病原.

图5 部分样本三重 PCR 扩增结果M:DNA Marker II;1-22:部分临床样本;N:阴性对照;P:混合质粒模板.Fig.5 Triple PCR amplification results of partial samples
3 讨论
FPV 仍然是猫病毒性腹泻的主要多发病原,因而临床上对其进行诊断的方法也较为成熟[13],而FAstV和FECoV 引起的明显或亚临床发病的情况并未得到足够重视,且多病原混合感染对疾病的进程和治疗转归的影响也缺乏有效评估[8,14-15],其中的原因之一便是缺少针对这些病原的高效检测方法. 因此,本研究通过条件优化获得了特异性、敏感性和稳定性良好的FPV/FAstV/FECoV 三重PCR 检测方法. 考虑到DNA和RNA 病毒在核酸提取及扩增效率上的差异,对引物浓度、酶浓度和退火温度等条件的正交筛选及优化可以极大程度上兼顾反应体系中不同病毒的扩增效率.优化建立的三重PCR 方法对模板梯度稀释后得到的最低检测限为 2.4 ~7.1 pg/μL(4.7 ×106copy/μL ~2 ×107copy/μL),与报道的各病原单一 PCR 方法的检测限相当[8,16-17],且三重PCR 与单一PCR 对临床样本的检测符合率为100%,表明成功为这三种病原的同步临床检测提供了一种快速准确的方法.
对现有207 份猫粪便样本的检测结果显示,腹泻猫只的FPV 与FAstV 或FECoV 的混合感染率仍显著高于健康猫,提示这些病原的复制可能在宿主机体发生免疫抑制时变得活跃[14-15,18],而健康猫只携带的相关病原也存在触发疾病和在猫群内持续流行的风险.根据 Zhang 等人报道,2016 ~2017 年中国东北5 个城市的 FPV 和 FAstV 检出率分别为 37.06% 和23.35%,其中 FPV 与 FAstV 的混合感染率为8.63%[16].在过往研究中,作者对2017 ~2018 年成都市区315 只家养猫粪便中的FPV、FAstV 和FECoV进行了检测,阳性检出率分别为 38.4% (健康:40.2%;腹泻:36.6%)、23.2%(健康:17.7%;腹泻:27.2%)和19.5%(健康:24.5%;腹泻:19.3%),其中多病原混合感染的检出率为18.3%[8]. 相比之下,2019 ~2020 年成都市区猫只中的FPV(总阳性检出率:37.2%;健康:12.2%;腹泻48.94%)、FAstV(总阳性率:24.2%;健康:17.65%;腹泻:27.23%) 和FECoV(总阳性率:15.5%; 健康:18.2%; 腹泻:14.2%)的感染率仍居高不下,而多重病原的混合感染(24.1%)相对升高,提示本地区猫群中三种病原的携带感染情况未得到明显改观,其防控形势依然严峻,需要引起持续关注.
4 结论
本研究建立的三重PCR 检测方法能同时快速检测三种猫腹泻相关病原FPV、FAstV 及FECoV,特异性、敏感性、稳定性较好,为临床猫腹泻性疾病的快速诊断及流行病学调查提供了可靠手段.
——一道江苏高考题的奥秘解读和拓展

