脾多肽联合TP方案对非小细胞肺癌患者TLR4、PD-1、HMGB1水平的影响
陆友国,夏丽丽,朱洋,闫萍
(淮南新华医疗集团新华医院肿瘤科,安徽 淮南 232052)
肺癌患者的发病率及致死率均极高,居恶性肿瘤病死率的第1位,其病理类型以非小细胞肺癌为主,约占所有肺癌的85%,且70%以上患者诊断时已发展为晚期,失去手术机会,5年生存率仅为10%~12%,极大威胁人类健康及生命安全[1-2]。目前,临床主要采用化疗、靶向放疗治疗晚期非小细胞肺癌,其能够通过控制局部病灶进展延长患者生存期,但放化疗药物多具有细胞毒性,可破坏免疫细胞结构及功能,引发骨髓抑制、胃肠道等重要脏器损害,且大部分患者于治疗1年后即开始产生耐药,治疗效果不理想[3-4]。因此,在保证放化疗临床疗效的同时减少其不良反应对提高患者预后具有重要意义。
近年来,有研究显示,作为Toll样受体(Toll-like receptor,TLR)家族成员之一的TLR4、程序性细胞死亡受体1(programmed cell death receptor 1,PD-1)、高迁移率族蛋白B1(high mobility group box 1 protein,HMGB1)均可通过调节机体免疫反应参与肺癌细胞的发生、发展及免疫逃逸[5-6]。而脾多肽作为由脾脏中提取的天然活性物质,能够通过诱导肝脏生成干扰素调节机体免疫功能,提高巨噬细胞和淋巴细胞功能,激活和增强自然杀伤细胞活性,从而促进T细胞亚群的成熟以及白细胞生成,在抑制恶性肿瘤发展的同时,减少化疗及靶向放疗过程中的免疫抑制现象[7-8]。但目前关于脾多肽对TLR4、PD-1、HMGB1水平影响的报道较少。本研究旨在探讨脾多肽联合紫杉醇+顺铂(Paclitaxel+Cisplatin,TP)方案对非小细胞肺癌患者TLR4、PD-1、HMGB1水平的影响,以为脾多肽的临床应用提供参考。
1 资料与方法
1.1一般资料 回顾性分析2019年4月至2021年4月淮南新华医疗集团新华医院收治的136例局部晚期非小细胞肺癌患者的临床资料,按照治疗方法不同分为试验组和对照组,各68例。纳入标准:①经病理学或细胞学检查确诊为局部晚期非小细胞肺癌;②无远处转移;③预计生存期>3个月;④卡氏功能状态(Karnofsky performance status,KPS)评分≥70分;⑤患者均签署了知情同意书。排除标准:①具有放化疗禁忌证;②具有其他部位恶性肿瘤病史;③并发严重甲状腺功能障碍性疾病、肝肾功能损害、肾上腺皮质损害性疾病、血液系统疾病、慢性呼吸系统疾病等;④依从性较差或合并精神疾病等;⑤妊娠期、哺乳期女性。两组患者的性别、年龄、病例类型、临床分期、KPS评分及吸烟史比较差异无统计学意义(P>0.05),见表1。本研究经淮南新华医疗集团新华医院医学伦理委员会批准(批准文号:2019-2)。
1.2治疗方法 对照组行TP方案化疗,常规口服醋酸地塞米松片(浙江仙琚制药股份有限公司生产,批号:190324、200105)、静脉注射西咪替丁注射液(山东方明药业集团股份有限公司生产,批号:20190821,20200821)及肌内注射盐酸异丙嗪注射液(上海禾丰制药有限公司生产,批号:13190321、13191204)等抗过敏,补液、止吐、保肝等预处理后,静脉滴注紫杉醇注射液(哈药集团有限公司生产,批号:201902012、202004012)120或135 mg/m2,间隔1 h后静脉滴注顺铂注射液(江苏豪森药业集团有限公司生产,批号:601190101、601200404)80 mg/m2,每日1次,3 周为1个疗程,共治疗3个疗程。每周复查1次血常规,一旦出现白细胞降低需增加复查次数,不良反应在Ⅲ级及以上者暂停治疗,行对症支持治疗至症状缓解。
试验组在对照组的基础上联合应用脾多肽注射液(梅河口市融致丰生制药有限公司生产,批号:20190305、20201011),将6 ml脾多肽注射液加入至500 ml 5%葡萄糖注射液或500 ml 0.9%氯化钠注射液内稀释后,静脉滴注,每日1次,3~5 d为1个疗程,共治疗3个疗程。复查方式同对照组。
1.3观察指标及判断标准 治疗3个疗程后,评估患者临床疗效:肿瘤体积增大25%以上为进展,肿瘤体积增大25%及其以下或缩小50%以下为稳定,肿瘤体积缩小50%及其以上为部分缓解,肿瘤完全消失为完全缓解。总有效率=(完全缓解例数+部分缓解例数)/总例数×100%,控制率=(完全缓解例数+部分缓解例数+稳定例数)/总例数×100%[9]。
分别于治疗前及治疗结束后评估两组患者的KPS评分:死亡为0分,濒临死亡为10分,病重并需住院治疗为20分,生活完全不能自理为30分,生活基本不能自理为40分,个人生活常需他人照料为50分,个人生活基本能够自理但偶尔需要他人帮助为60分,个人生活可自理但不能维持正常生活和工作为70分,有临床症状和体征但可正常活动为80分,有轻微症状和体征且能正常活动为90分,无症状和体征且能正常活动为100分,分值越高表示生存质量越好[10]。
治疗前及治疗结束后,分别抽取患者空腹外周肘静脉血5 ml,以离心半径10 cm、4 ℃环境下3 000 r/min离心10 min,取上层清液置于无菌EP管,-8 ℃保存待检。严格按照仪器及试剂盒说明书采用酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)检测血清TLR4、PD-1及HMGB1水平。其中,TLR4、HMGB1 ELISA试剂盒由北京博奥派克生物科技有限公司生产(TLR4试剂盒批号:453728、454154,HMGB1试剂盒批号:562814、566217);PD-1 ELISA试剂盒由上海鑫乐生物科技有限公司生产(批号:19031124、20052136);BIO-RAD-Model1680型酶标仪由美国BioTek公司生产。观察并记录两组患者的不良反应发生情况,如胃肠道反应、骨髓抑制、肝肾损害、脱发、神经毒性反应等。

2 结 果
2.1两组的临床疗效比较 试验组总有效率为91.18%(62/68),抑制率为97.06%(66/68);对照组总有效率为77.94%(53/68),抑制率为92.65%(63/68)。试验组的总有效率高于对照组(χ2=4.561,P=0.033),两组的抑制率比较差异无统计学意义(χ2=1.355,P=0.244);试验组的临床疗效明显优于对照组(Z=2.295,P=0.022),见表2。

表2 两组局部晚期非小细胞肺癌患者的临床疗效比较 (例)
2.2两组KPS评分比较 不同时点间KPS评分的主效应差异有统计学意义(P<0.01);不考虑测量时间,两组KPS评分的主效应差异有统计学意义(P<0.01);KPS评分的时点间与组间存在交互作用(P<0.05),随着治疗时间的延长两组患者KPS评分均呈升高趋势,且试验组高于对照组(P<0.05),见表3。

表3 两组局部晚期非小细胞肺癌患者的KPS评分比较 (分,
2.3两组TLR4、PD-1、HMGB1水平比较 不同时点间TLR4、PD-1、HMGB1水平的主效应差异有统计学意义(P<0.01);不考虑测量时间,两组TLR4、PD-1、HMGB1水平的主效应差异有统计学意义(P<0.01);TLR4、PD-1、HMGB1水平的时点间与组间存在交互作用(P<0.05),随着治疗时间的延长两组患者TLR4、PD-1、HMGB1水平均呈降低趋势,且试验组明显低于对照组(P<0.05),见表4。

表4 两组局部晚期非小细胞肺癌患者的TLR4、PD-1、HMGB1水平比较
2.4两组不良反应发生情况比较 试验组的总不良反应发生率明显低于对照组(χ2=4.980,P=0.026),见表5。
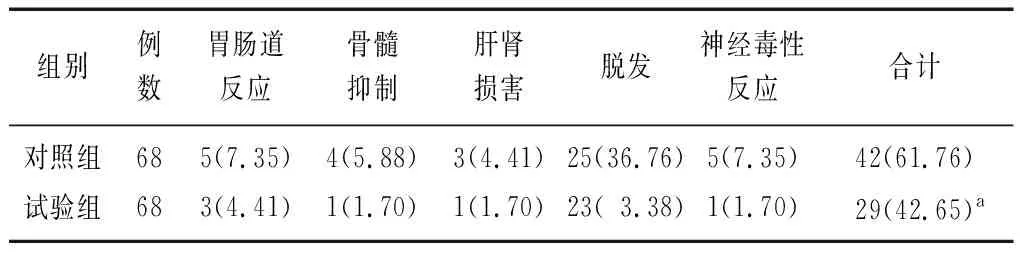
表5 两组局部晚期非小细胞肺癌患者的不良反应发生情况比较 [例(%)]
3 讨 论
目前,临床治疗局部晚期非小细胞肺癌仍以化疗及靶向放疗为主,紫杉醇作为广谱抗癌药物之一,其能够通过促进微管蛋白聚合、抑制微管蛋白降解,
达到稳定非功能性微管束,进而破坏肿瘤细胞有丝分裂的目的[11]。顺铂可通过影响DNA链内及链间的交链影响DNA修复,进而触发肿瘤细胞凋亡[12]。然而,紫杉醇及顺铂的应用均会导致一系列不良反应致使治疗中断,影响治疗效果[13]。因此探寻有效的方法,在保证紫杉醇及顺铂抗肿瘤效果的同时,减少其不良反应显得尤为重要。
相关研究显示,TLR4作为TLR家族中的固有免疫分子成员之一,广泛表达于巨噬细胞以及树突状细胞表面,其能够通过识别革兰阳性菌磷壁酸、革兰阴性菌脂多糖等外源性病原体相关模式分子及热激蛋白、纤维蛋白原、硫酸肝素等内源性损伤相关模式分子,进而触发髓样分化蛋白88/两面神激酶2、促分裂原活化的蛋白激酶/肠激酶、核因子κB等相关信号转导通路,诱导大量白细胞介素-6、白细胞介素-12等促炎因子和Ⅰ型干扰素的产生,同时协助肿瘤细胞逃避T淋巴细胞以及自然杀伤细胞的攻击,介导肺癌的发生、发展[14-15]。本研究结果显示,试验组患者的TLR4水平明显低于对照组(P<0.05)。可见,脾多肽能够通过调控TLR4的水平进而达到抑制肺癌的目的,但具体作用机制尚不明确,且相关报道较少,需进一步深入探讨。
PD-1作为B7蛋白家族成员之一,广泛分布于T细胞、B细胞以及多种肿瘤细胞的表面。PD-1可通过与其受体结合发生酪氨酸磷酸化,从而招募含有2个Scr同源结构域的蛋白酪氨酸磷酸酶与其免疫受体结合,进而激活磷脂酰肌醇-3-激酶/蛋白激酶B和Ras通路,抑制T细胞活化,达到促使肿瘤细胞逃避免疫系统监视,形成免疫抑制性肿瘤微环境而加快肿瘤发生、发展的目的[16-17]。有研究显示,阻断PD-1及其配体的结合可增强效应性CD8+细胞功能,逆转肿瘤免疫微环境,强化抗肿瘤的内源性免疫效应[18]。且有研究证实,TLR-4可通过促分裂原活化的蛋白激酶/胞外信号调节激酶、核因子κB等多条信号通路上调PD-1的表达,抑制CD4+细胞的增殖及其相关细胞因子的产生[16]。本研究结果显示,试验组患者的PD-1水平明显低于对照组(P<0.05),表明脾多肽可下调PD-1的表达水平。张渤等[17]研究显示,脾多肽可下调三阴性乳腺癌化疗患者PD-1的表达。本研究结果与此研究结果一致。
HMGB1作为高迁移率族蛋白家族成员之一,具有诱导巨噬细胞分泌更多促炎因子的作用,与肿瘤的发生、发展密切相关。缺氧状态下HMGB1可缓慢向细胞外释放,进而提高肿瘤微环境中晚期糖基化终末产物受体的表达水平,并与其相结合,激活核因子κB信号通路,诱导血管内皮生长因子等相关细胞因子的产生,加快肿瘤细胞的增殖速度[19-20]。有研究证实,抑制晚期糖基化终末产物与其受体结合,可增加基质金属蛋白酶的表达,促进细胞外基质蛋白降解,从而抑制肿瘤的生长及转移[21]。也有研究认为,HMGB1可通过与TLR4受体结合激活树突状细胞,招募PD-1阳性的T细胞向肿瘤部位聚集,发挥杀伤效应[22]。本研究结果显示,试验组患者的HMGB1水平明显低于对照组(P<0.05)。可见,调控HMGB1水平可能是脾多肽抑制肺癌的部分分子学作用机制,值得进一步深入探讨。
既往研究显示,脾多肽能够在促使未致敏淋巴细胞向致敏淋巴细胞激活转化以及促进T淋巴细胞成熟的同时,提高自然杀伤细胞的活性,从而提高淋巴细胞免疫功能,加强对肿瘤细胞的杀伤作用[23]。本研究结果显示,试验组患者的临床疗效优于对照组,KPS评分高于对照组(P<0.05),进一步证实脾多肽可增强肿瘤细胞的杀伤作用,提高患者的生活质量。此外,本研究中试验组的总不良反应发生率明显低于对照组,证实脾多肽可减轻化疗药物的不良反应,与既往研究报道结果一致[24]。分析其原因可能为脾多肽是由牛脾脏提取物制成的分子量<6 000的游离氨基酸、多肽、核酸、糖的无菌水溶液,由多种免疫调节因子组成,具有双向调节免疫功能,能够在抑制肿瘤细胞糖酵解,促使肿瘤细胞代谢障碍的同时,刺激骨髓细胞增殖,产生大量外周淋巴细胞,增强巨噬细胞免疫应答反应,减轻化疗药物的不良反应[25]。
综上所述,局部晚期非小细胞肺癌患者在TP方案化疗的基础上联合应用脾多肽可提高患者的治疗效果,降低不良反应发生率,临床应用价值较高。

