微小RNA靶向胰岛再生源蛋白3A对肺上皮细胞增殖和凋亡的影响
王文涛 郭健 解敏 郑志方 王燕
承德医学院附属医院 1小儿内科,2新生儿科(河北承德 067000);3承德医学院图书馆(河北承德 067000)
小儿肺炎是婴幼儿期的常见病,容易引发全 身性炎症反应和多种病原菌感染[1-2]。目前小儿肺炎依然是致5 岁以下儿童死亡的重要因素之一[3]。肺上皮细胞覆盖在肺泡上,具有屏障功能,也可作为病原体的重要识别系统[4]。
miRNA 是一类小分子非编码RNA,具有转录后调节功能[5-6]。胰岛再生源蛋白3A(REG3A)是一种分泌型蛋白,具有抗氧化、抗炎、抗凋亡等功能[7-8]。本研究通过生物信息学工具Target Scan以及结合阅读相关文献,筛选出几种可能靶向抑制REG3A 的候选miRNA,包括:miR⁃425⁃5p、miR⁃137、miR⁃325⁃3p、miR⁃342⁃3p、miR⁃203a⁃3p 及miR⁃9⁃3p,拟通过检测重症肺炎患儿血清中以上miR⁃NA 与REG3A 是否异常表达,进而探究该现象对肺上皮细胞增殖与凋亡的影响。
1 材料与方法
1.1 样本来源选取2019年6月至2020年6月本院收治的86 例重症肺炎患儿为研究对象(记为SP 组),男47 例,女39 例,年龄1~8 岁,平均年龄(4.27±0.43)岁。所有患儿均符合《儿童社区获得性肺炎管理指南》的诊断标准。排除心肺功能不全、患其他呼吸系统疾病以及免疫系统缺陷者,入院前一个月未接受激素、抗菌类等药物治疗。同期选取本院进行健康体检的20 例儿童作为对照组,其中男14 例,女6 例,年龄3~9 岁,平均年龄(5.12±0.49)岁。所有参与本次研究的儿童均征得家长同意并签署知情同意书,此外本研究已获得医院伦理委员会许可。
1.2 主要材料与试剂肺上皮细胞系A549(中国科学院上海细胞库),胎牛血清(杭州四季青公司),青⁃链霉素、DMEM 培养液(美国Sigma 公司),TRIzol 和Lipofectamine 2000 试剂盒(美国Invitrogen公司),反转录试剂盒和实时荧光定量PCR 试剂盒(日本Takara 公司),双荧光素酶报告基因检测试剂盒(北京索莱宝公司),CCK⁃8 试剂盒和EdU 细胞增殖检测试剂盒(上海联迈生物公司),Annexin V⁃FITC/7⁃AAD 细胞凋亡检测试剂盒(上海贝博生物公司),抗体REG3A、Caspase⁃3、Bcl⁃2、Bax、p53、GAPDH(英国Abcam 公司),WT⁃REG3A 3'⁃UTR 和MUT⁃REG3A 3'⁃UTR 质粒载体、引物序列、miRNA mimic 及阴性对照序列均交由上海生工生物工程公司合成构建。
1.3 方法
1.3.1 标本收集重症肺炎患儿和健康儿童均空腹(禁食>8 h)静脉采血3 mL,置于混有EDTA 的离心管中,4 ℃下以4 000 r/min 离心10 min,吸取上层液相至预冷离心管,4 ℃下以12 000 r/min 离心15 min,取上清液保存于-80 ℃冰箱。
1.3.2 实时荧光定量PCR 实验Trizol 试剂提取血清或细胞总RNA,逆转录合成cDNA,随后进行qRT⁃PCR 扩增,具体参照SYBR®Premix Ex TaqTMⅡ试剂盒说明书进行,miRNA 与REG3A 分别以U6、β⁃actin 作为内参。以2⁃ΔΔCt法计算基因mRNA 相对表达水平,各引物序列见表1。

表1 各基因引物序列Tab.1 Primer sequence of each gene
1.3.3 细胞培养与转染在A549 细胞中添加含10%胎牛血清、1%青⁃链霉素双抗的DMEM 完全培养液,置于37 ℃、5%CO2培养箱培养,汇合度达到70%时,进行转染操作。实验分为5 组,包括miR⁃137 NC 组、miR⁃137 mimic 组、miR⁃342⁃3p NC 组、miR⁃342⁃3p mimic 组,并选择正常A549 细胞作为空白对照组。按照Lipofectamine 2000 说明书进行操作,转染4 h 后更换为新鲜完全培养基,继续培养48 h,收集细胞进行后续研究。
1.3.4 Western blotRIPA 裂解液提取各组细胞总蛋白,BCA法测定蛋白质量。取等量各蛋白样品加到10%SDS⁃PAGE 凝胶孔,经电泳分离后,对目的蛋白区域切胶,电转至PVDF 膜,5%脱脂奶粉封闭2 h。TBST 洗膜,加入一抗,4 ℃下共孵育过夜。次日,TBST 洗膜,加入对应二抗,室温孵育1 h,TBST 洗膜,ECL 显影,凝胶成像系统拍照,Image Pro⁃Plus 系统分析各蛋白条带灰度值。
1.3.5 双荧光素酶报告基因检测Target Scan软件预测miR⁃137、miR⁃342⁃3p 与REG3A 3'⁃UTR 是否存在结合位点。根据靶位点序列设计所需的启动子片段,构建WT⁃REG3A 3'⁃UTR 和MUT⁃REG3A 3'⁃UTR 质粒载体。将A549 细胞以1×105个/孔接种于24 孔板,使用Lipofactamine 2000 分别将miR⁃137 mimic、miR⁃342⁃3p mimic 或对应阴性对照联合构建好的质粒载体转染至细胞,根据双荧光素酶报告基因检测试剂盒操作说明书操作检测各组细胞荧光素酶活性。
1.3.6 CCK⁃8法收集各组A549细胞,置于37 ℃、5%CO2培养箱内继续培养,分别于24、48、72、96 h时,在各孔加入10 μL CCK⁃8,混匀后继续培养2 h,通过酶联免疫检测仪测定450 nm处吸光度值。
1.3.7 EdU染色将各组A549细胞以1×105个/孔接种于24 孔板中,过夜培养后,换用含10 μmol/L EdU 处理2 h,PBS 洗涤,4%多聚甲醛固定30 min,甘氨酸处理5 min,0.5%Triton X⁃100再处理10 min,洗涤后,加Apollo567 避光孵育30 min,再以DAPI避光孵育30 min,洗涤后封片,晾干,通过激光共聚焦显微镜观察细胞染色情况,随机选择5 个视野,计数该视野下总细胞数目与EdU 标记阳性细胞数目,计算EdU+阳性率。
1.3.8 Annexin V⁃FITC/7⁃AAD 双染法使用胰酶消化各组A549 细胞,PBS 洗涤,用适量1×bind⁃ing buffer 重悬,调整密度为1×106个/mL,吸取100 μL悬液,依次加入5 μL Annexin V⁃FITC与5 μL 7⁃AAD,室温避光孵育15 min,再用200 μL 1×bind⁃ing buffer 重悬,立即通过流式细胞仪上机检测细胞凋亡百分比。
1.4 统计学方法SPSS 23.0 进行数据统计与分析,计量资料用均数±标准差表示,多组间比较采用单因素方差分析,组间数据比较采用LSD⁃t检验;以P<0.05 为差异有统计学意义。
2 结果
2.1 miRNA在重症肺炎患儿和健康儿童中的表达比较重症肺炎患儿血清中miR⁃425⁃5p、miR⁃137、miR⁃325⁃3p、miR⁃342⁃3p、miR⁃203a⁃3p 及miR⁃9⁃3p相对表达量均高于健康儿童(P<0.05),见图1。其中miR⁃137 和miR⁃342⁃3p 相对表达量分别呈高、低表达。
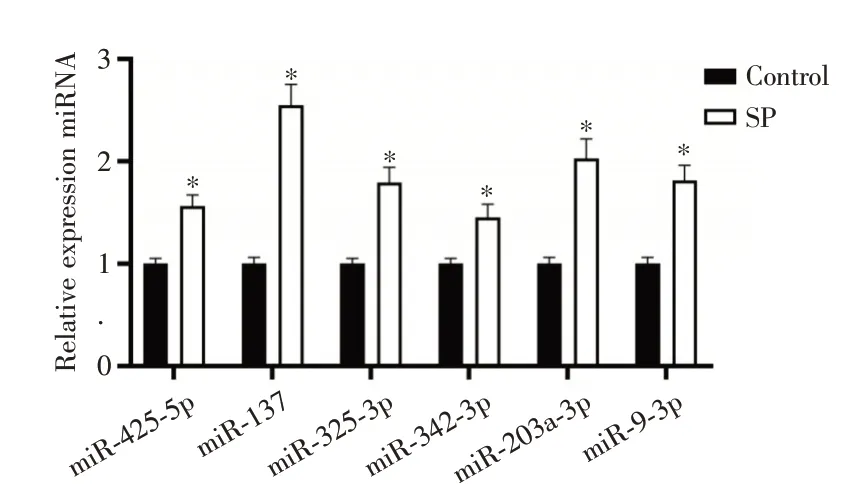
图1 重症肺炎患儿和健康儿童血清中miRNA 表达检测Fig.1 Detection of miRNA expression in the serum of children with severe pneumonia and healthy children
2.2 REG3A 在重症肺炎患儿和健康儿童中的表达比较经检测发现,REG3A 的mRNA 相对表达量在重症肺炎患儿血清中低于健康儿童血清(P<0.05),见图2。
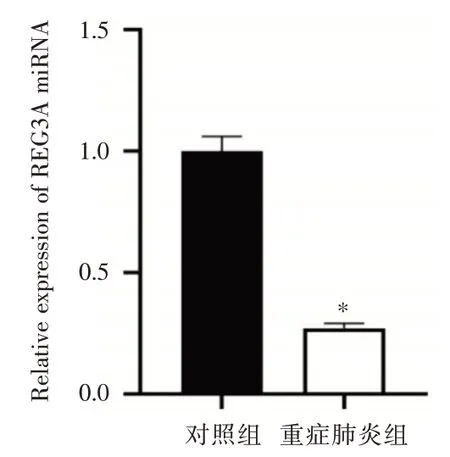
图2 重症肺炎患儿和健康儿童血清中REG3A mRNA 表达比较Fig.2 Comparison of REG3A mRNA expression in serum between children with severe pneumonia and healthy children
2.3 miR⁃137、miR⁃342⁃3p 与REG3A 的靶向关系检测经预测发现miR⁃137 与REG3A 3'⁃UTR 以及miR⁃342⁃3p 与REG3A 3'⁃UTR 均在特定区域存在碱基互补现象,见图3A。与miR⁃137 NC比较,miR⁃137 mimic 和WT⁃REG3A 3'⁃UTR 重组质粒共转染组的相对荧光值降低(P<0.05);与miR⁃342⁃3p NC 比较,miR⁃342⁃3p mimic 和WT⁃REG3A 3'⁃UTR重组质粒共转染组的相对荧光值降低(P<0.05),见图3B。
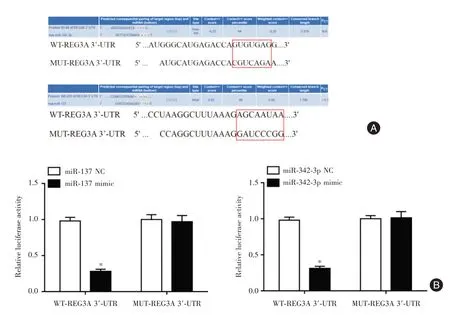
图3 miR⁃137、miR⁃342⁃3p 与REG3A 3'⁃UTR 靶向关系Fig.3 Targeting relationship between miR⁃137,miR⁃342⁃3p and REG3A 3'⁃UTR
2.4 细胞转染后miR⁃137、miR⁃342⁃3p 及REG3A蛋白表达检测miR⁃137 mimic 组A549 细胞中miR⁃137 相对表达量高于空白对照组(P<0.05),miR⁃342⁃3p mimic 组细胞miR⁃342⁃3p 相对表达量高于空白对照组,见图4。miR⁃137 mimic组REG3A蛋白相对表达量较空白对照组下降(P<0.05),与空白对照组比较,miR⁃342⁃3p mimic 组REG3A 蛋白相对表达量下降(P<0.05)。见图5。
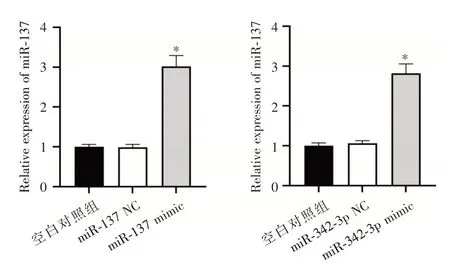
图4 qRT⁃PCR 检测各组细胞miR⁃137 与miR⁃342⁃3p 表达Fig.4 qRT⁃PCR detection of the expression of miR⁃137 and miR⁃342⁃3p in each group of cells
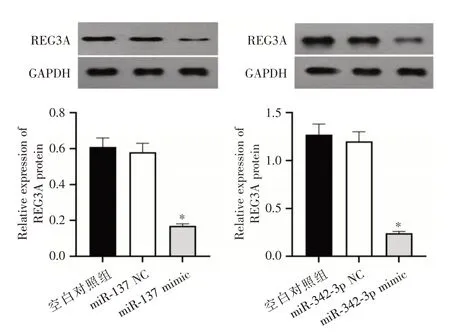
图5 Western blot 检测各组细胞REG3A 蛋白表达Fig.5 Western blot detection of REG3A protein expression in each group of cells
2.5 miR⁃137 与miR⁃342⁃3p 高表达对肺上皮细胞增殖的影响在各检测时间点,miR⁃137 mimic组细胞活性较空白对照组均下降(P<0.05),miR⁃342⁃3p mimic组细胞活性较空白对照组下降(P<0.05),见图6A。此外,与空白对照组比较,miR⁃137 mimic组EdU 阳性细胞率下降(P<0.05),miR⁃342⁃3p mimic 组EdU 阳性细胞率也较空白对照组下降(P<0.01),见图6B。
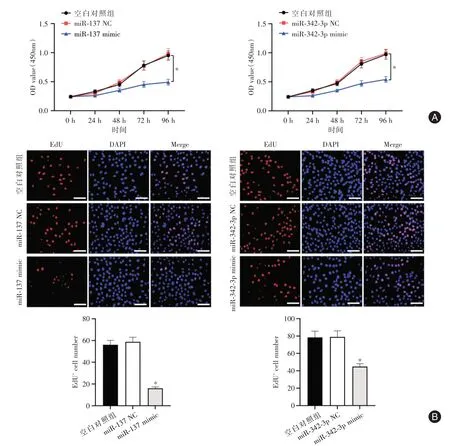
图6 各组细胞增殖检测Fig.6 Cell proliferation detection in each group
2.6 miR⁃137 与miR⁃342⁃3p 高表达对肺上皮细胞凋亡的影响miR⁃137 mimic 组细胞凋亡率较空白对照组升高(P<0.05),miR⁃342⁃3p mimic 组细胞凋亡率较空白对照组升高(P<0.05),见图7。与空白对照组比较,miR⁃137 mimic 组细胞Caspase⁃3、Bax 和p53 蛋白表达量增加,Bcl⁃2 蛋白表达量减少(P<0.05);与空白对照组比较,miR⁃342⁃3p mimic组细胞Caspase⁃3、Bax和p53蛋白表达量增加,Bcl⁃2蛋白表达量减少(P<0.05),见图8。
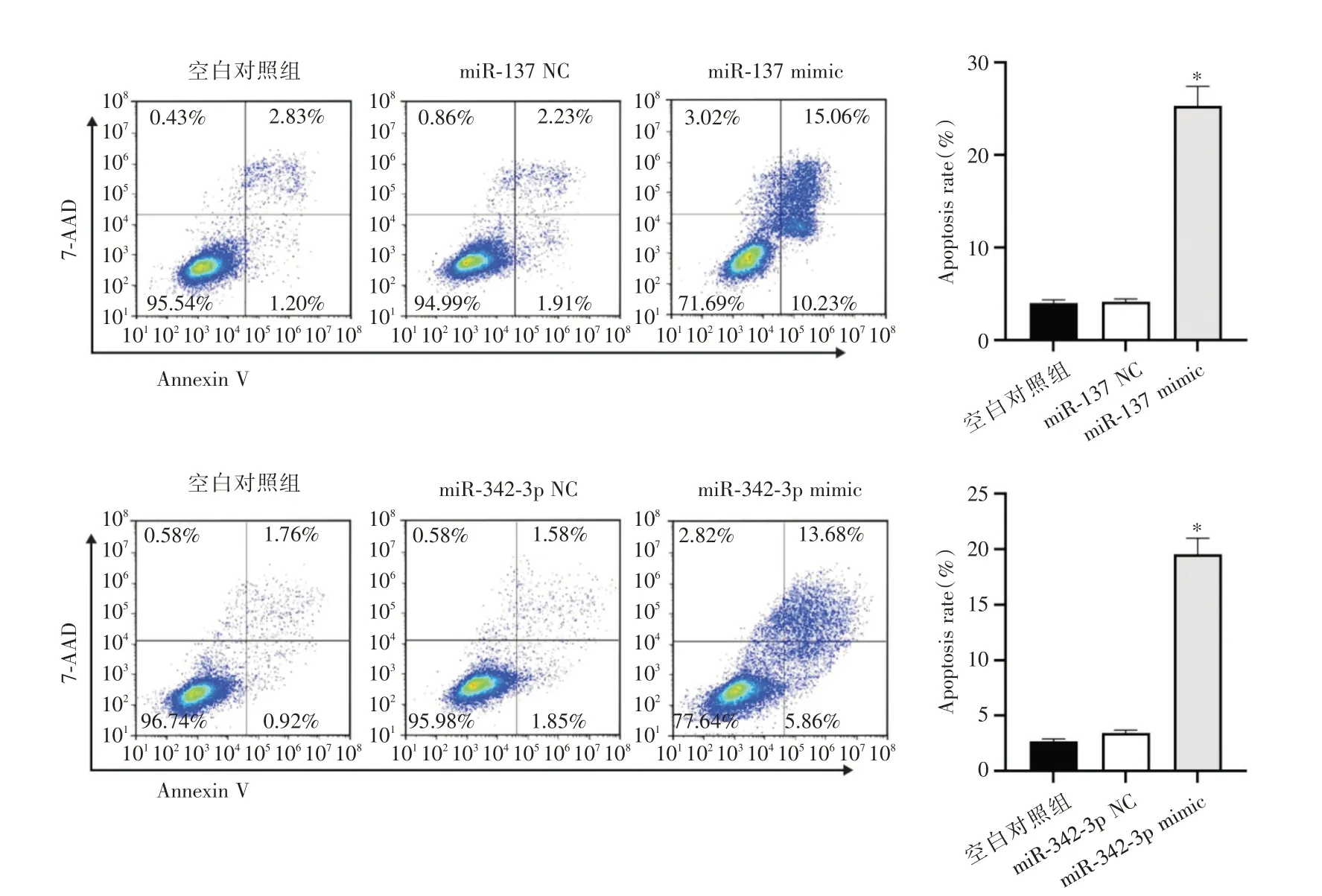
图7 Annexin Ⅴ⁃FITC/PI 双染法检测各组A549 细胞凋亡Fig.7 Annexin Ⅴ⁃FITC/PI double staining method to detect A549 cell apoptosis in each group

图8 Western blot 检测各组细胞凋亡相关蛋白表达Fig.8 Western blot detection of apoptosis⁃related protein expression in each group
3 讨论
肺炎支原体感染后,人体通过免疫反应介导炎症反应,临床表现为细支气管炎、肺炎等[9-11]。多项研究指出miRNA 与肺部炎症疾病密切相关,例如:缺乏miR⁃155 的小鼠肺支气管肺泡中白细胞数量增加[12];脂多糖诱导的肺炎小鼠肺部检测到多个miRNA 表达异常[13]。因此,关注miRNA 在肺部炎性反应中的调节功能有望为小儿肺炎的诊断和治疗提供新方向。
本研究发现,在重症肺炎患儿血清中miR⁃425⁃5p、miR⁃137、miR⁃325⁃3p、miR⁃342⁃3p、miR⁃203a⁃3p、miR⁃9⁃3p 的表达水平均明显高于健康儿童,其中miR⁃137 的表达水平较高,miR⁃342⁃3p 的表达水平较低。已有研究表明miR⁃137 和miR⁃342⁃3p 参与组织损伤或炎症性疾病的发生发展。LI 等[14]报道指出miR⁃137 是一种缺氧反应基因,其过表达会加重缺氧诱导的视网膜神经节细胞凋亡;ELGE⁃BALY 等[15]研究表明miR⁃137 可作为不稳定型心绞痛患者的早期炎症诊断的新型生物标志物;RAY 等[16]研究表明miR⁃342⁃5p 在动脉粥样硬化中可诱导促炎介质NOS2 和IL⁃6 的表达,加重炎症反应。本研究在肺上皮细胞中过表达miR⁃137 或miR⁃342⁃3p 后发现,细胞增殖活性和EdU 阳性细胞率均下降,细胞凋亡率升高,促凋亡因子Cas⁃pase⁃3、Bax 和p53 的蛋白表达量增加,抗凋亡因子Bcl⁃2 蛋白表达量减少。说明miR⁃137 和miR⁃342⁃3p 的高表达能够抑制肺上皮细胞增殖能力,并促进细胞凋亡,提示这种异常表达现象可能是肺炎发生的病理机制之一。
REG3A 是REG 蛋白家族的成员,参与组织损伤修复反应,能够抵抗细菌在受伤部位的增殖[17]。在小鼠肺金葡菌感染后,肺上皮细胞可通过STAT3/REG3A 信号轴抵御金葡菌的入侵[18];在糖尿病疾病中,REG3A 的异常表达会放大皮肤伤口中的炎症,并且可能是糖尿病个体延迟伤口愈合的关键因素[19]。由此可见,REG3A 在炎症反应中发挥重要作用,可能参与小儿肺炎感染过程。本研究结果显示,REG3A 在肺炎重症患儿血清中表达降低,并通过生物信息学软件预测发现miR⁃137 与REG3A 3'⁃UTR 以及miR⁃342⁃3p 与REG3A 3'⁃UTR均在特定区域存在碱基互补现象,验证了miR⁃137与miR⁃342⁃3p 靶向调控REG3A 的表达,初步揭示了REG3A 的调控机制。
综上所述,本研究表明在重症肺炎患儿血清中miRNA 表达异常,miR⁃137 与miR⁃342⁃3p 的高表达可抑制肺上皮细胞增殖并促进细胞凋亡,其机制与靶向下调REG3A 有关,这为小儿肺炎的诊断与治疗提供了新的靶点。但本研究仅从肺上皮细胞的体外研究出发探究了miR⁃137 与miR⁃342⁃3p对细胞的影响,小儿肺炎作为常见且复杂的肺部疾病,关于这两种miRNA 在机体内是否参与该疾病的发展以及过程中是否还涉及其他分子的参与,这均有待后续进行实验探究。

