基于TCMSP数据库的分子对接虚拟筛选JAK3特异性抑制剂
万祥宏,蔡沐彬,游清徽
江西师范大学生命科学学院,南昌 330022
Janus激酶(Janus kinase,JAKs)属于细胞内酪氨酸激酶家族,由JAK1、JAK2、JAK3和TYK2四个成员组成,在许多细胞因子受体的信号传递过程中起着中枢作用[1]。通过信号转导子和转录激活子(signal transducers and activators of transcription,STATs)启动下游靶基因,进而发挥其细胞生物功能的调控作用[2]。JAK-STAT信号通路在细胞的增殖、分化、凋亡和免疫调节等重要生物学过程均有参与,JAK-STAT信号通路的异常激活会加速癌细胞的增殖过程,例如急性早幼粒细胞白血病,其细胞系HT93A诱导分化时就会激活JAK-STAT,导致其增殖加快[3]。JAK-STAT通道还会被NADPH氧化酶激活,使得肝X受体的表达水平下降,大大影响了ATP三磷酸腺苷结合盒(AB-CA1)的表达,抑制THP-1泡沫细胞胆固醇的排出,导致动脉粥样硬化的发病[4]。目前医药领域与之相关的研究多集中于癌症、炎症和心血管疾病,其中炎症性疾病主要包括溃疡性结肠炎,类风湿性关节炎及克罗恩病等。
JAK蛋白作为人体中重要的一种蛋白,靶点JAK蛋白设计的小分子抑制剂有许多,然而大多数由于口服生物利用率低、选择性差等缺点都处于临床的不同研究阶段,获得监管部门批准的上市JAK抑制剂迄今为止仅有两个[5]。托法替尼(tofacitinib)是美国辉瑞公司研发的一种新型的JAK1/3抑制剂,于2012年11月6日获得美国FDA批准上市,之后于2013年3月25日获得日本PMDA批准上市。托法替尼作为第一代JAK抑制剂,通过抑制细胞质受体的下游信号来阻断细胞因子的信号转导[6],达到干扰JAK-STAT信号通路从而影响DNA转录的目的,在抗增殖和抗炎症方面发挥了明显的作用。虽然该药物已经在临床上得到广泛应用,疗效较好,但是在对疾病有效的同时,也产生了不良反应,包括但不限于肠胃不适、恶心、呕吐、贫血、发热、上呼吸道感染、肝酶和血脂升高,严重的还可能导致呼吸困难。不仅如此,托法替尼与强效免疫抑制剂例如他克莫司,环孢素合用还有增加免疫抑制作用的风险,导致药物副作用加剧。
JAK3是JAK家族中唯一与细胞因子受体γc链相关联的家族成员[7]。由于JAK3在细胞因子信号传递中具有极其重要的作用,且其仅在特定的组织中进行表达,因而抑制JAK3活性后导致免疫抑制但不会引发更多的非正常生理变化,这使得JAK3成为研究免疫抑制剂的重要靶标[8]。因此,开发疗效确切、毒副作用轻微的JAK3抑制剂类药物的需求仍十分迫切。通过分子对接虚拟筛选与托法替尼具有相似结合位点的中草药成分小分子,有望获得JAK3特异性抑制剂。
1 材料和方法
1.1 材料
1.1.1 JAK蛋白
JAK家族中的四种蛋白的三维结构数据来自RCSB PDB数据库(https://www.rcsb.org/),JAK1、JAK2、JAK3和TYK2蛋白的PDB ID分别为6SM8、3FUP、3LXK和3LXN。所有结构都是具有药物结合的复合体,其中3FUP、3LXK和3LXN结合的是药物托法替尼。
PDB ID为6SM8和3FUP的蛋白是同源多聚体,只保留结构最完整的A链。
1.1.2 中草药成分小分子
中草药成分小分子结构文件从TCMSP数据库(https://tcmspw.com/)下载,一共有13 445种小分子,下载格式为MOL2。
1.2 研究方法
1.2.1 分子对接
分子对接是结构生物学和计算机辅助药物设计的关键工具,通过预测出受体和配体的结合构象和亲和力来进行小分子改造和设计分子对接[9]。常见的分子对接工具有AutoDock、LeDock、MOE Dock、FlexX等。
本研究利用LeDock软件(http://www.lephar.com/)对中草药成分小分子与JAK3进行模拟对接。LeDock是由赵洪桃博士开发的分子对接软件,其优点是小分子与蛋白质对接既快速又准确[10]。
对接盒子由GetBox-PyMol-Plugin插件(http://bioms.org/thread-1234-1-1.html)自动识别含配体的蛋白活性空腔确定。
1.2.2 图表绘制
本研究中的表格以Excel软件绘制,图片由PyMOL2.3.0和Molecular Operating Environment (MOE) 2019.0102导出。
2 结果与分析
利用LeDock软件进行分子对接,得到13 445种小分子与JAK3蛋白的对接结果。
2.1 对接结果的初步处理
考虑分子对接计算算法的近似性处理和配体结合蛋白时候复杂的热力学、动力学性质导致很多预测结果并没有显示出生物活性,为控制筛选结果的假阳性,使用配体结合效率(ligand efficiency,LE)和结合能打分值来进行筛选[10]。对接结果以结合能打分值小于-6.0且配体结合效率大于0.4或结合能打分值小于-7.5且配体结合效率大于0.3作为范围进行过滤,初步筛选出118种小分子。
2.2 对接结果的进一步处理
2.2.1 结构筛选
由于硫酸根、磷酸根、酚羟基与蛋白质的结合特异性差,作为药物的副作用大,含有这些基团的小分子不适合作为JAK3特异性抑制剂。通过查找并分析结构,排除含有以上基团的小分子,得到40种符合条件的分子。
2.2.2 研究相关性筛选
根据分子的编号、名称、结构在TCMSP数据库(https://tcmspw.com/)、药源网(https://www.yaopinnet.com/)等进行查找,选择对相关疾病有潜在治疗效果,且已经作为药物、保健品成分或已有制备工艺的分子,得到18种小分子进行后续研究。
2.2.3 氢键数目筛选
用PyMOL保存18种小分子与3LXK蛋白结合的最佳构象,再用MOE软件展现小分子与活性位点氨基酸残基的相互作用,得到氢键数量等数据。分析对接结果,并与托法替尼进行对比,18种小分子以及托法替尼与3LXK的对接结合能、氢键数量及配体效率见表1。
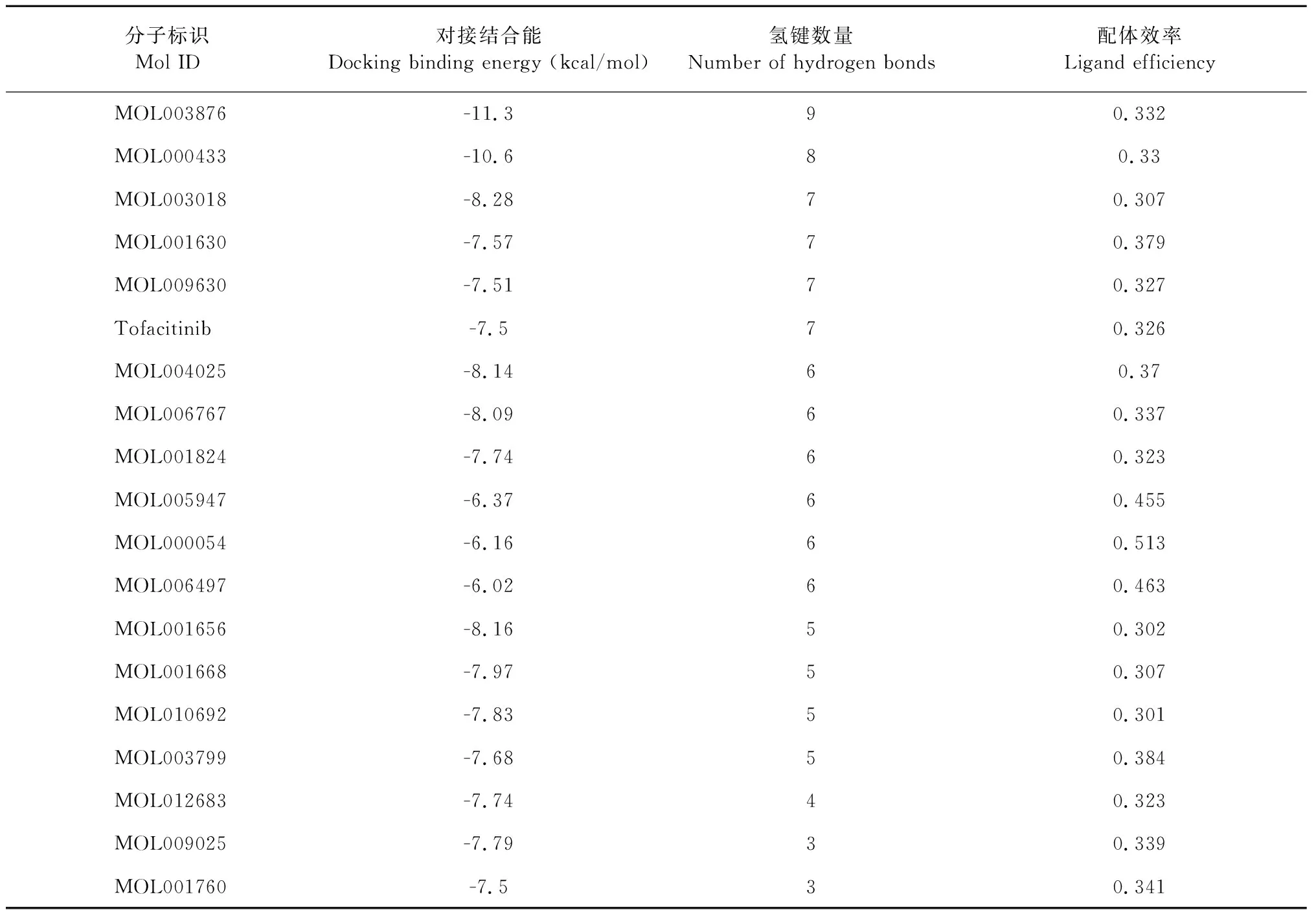
表1 18种小分子与3LXK的对接结合能、氢键数量及配体效率Table 1 Docking binding energy,number of hydrogen bonds,and ligand efficiency of 18 small molecules and tofacitinib with 3LXK
氢键是维系蛋白质与配体分子结合稳定性的重要作用力[11]。小分子在靶蛋白活性空腔内与氨基酸残基形成的氢键数作为反映结合能力的另一指标,并比较采用托法替尼分子进行对接的打分值和配体结合效率,形成氢键数目越多,对接打分值越低,配体效率越高,则小分子与靶蛋白的结合能力越强。根据数值排名得出与JAK3的结合具有优势的7种小分子,相关信息见表2。利用MOE软件可视化配体小分子在靶蛋白活性空腔中与相关氨基酸残基的相互作用,得到分子对接结果见图1。
M1(戊二酸)与JAK3之间通过9个氢键相连,是所有配体分子中氢键数最多的。其中Leu905、Ala966、Lys830、Asn832、Asn954作为氢供体;Leu905、Asn832、Arg953、Asn954作为氢接受体。此外Leu828更是与配体分子形成pi-H键,使二者之间的结合更加紧密。二者之间的对接结合能更是只有-11.3 kcal/mol远远低于托法替尼的-7.5 kcal/mol。
M2(叶酸)与JAK3之间共有8个氢键相连,其对接结合能也低于托法替尼,仅有-10.6 kcal/mol。其中Arg953、Ala966、Pro906、Lys830、Glu903、Lys830、Asp967作为氢供体;Leu905作为氢受体。
M3(断马钱子苷)与JAK3之间的对接结合能为-8.28 kcal/mol,其中Asp967、Ala966、Leu905、Lys830、Leu905 作为氢供体分别形成一个氢键,Glu 903在结合时提供了两个氢,此外,Lys830与Leu905为氢受体,一共形成7个氢键。
M4(巴豆苷)与JAK3的对接结合能为-7.57 kcal/mol稍高于托法替尼与JAK3结合的结合能,其中Met902、Ala966、Arg953、Leu828作为氢供体分别形成一个氢键,Glu 903则在结合时提供了两个氢,Leu905作为氢受体,一共形成7个氢键。
M5(2-O-(β-D-吡喃葡萄糖基)-抗坏血酸)与JAK3的对接结合能稍高于托法替尼的结合能,为-7.51 kcal/mol,其中Arg953、Asp967、Asp949、Leu828作为氢供体分别形成一个氢键,Asn954则在结合时提供了两个氢,Arg953作为氢受体,一共形成7个氢键。
M6(色胺)与JAK3的对接结合能为-8.14 kcal/mol,其中Ala966、Glu 903、Asn954作为氢供体分别形成1个氢键,Arg953在结合时提供了两个氢,此外,Asn954、Asp967为氢受体,一共形成6个氢键。
M7(仙人掌黄质-1)与JAK3的对接结合能为-8.09 kcal/mol,Ala966、Leu828、Glu903、Lys830作为氢供体分别形成一个氢键,Asp967则在结合时提供了个氢,一共形成6个氢键。
分析小分子与JAK3蛋白的结合效果,反映其被筛选作为苗头化合物对JAK3的抑制作用,并且发现JAK3蛋白活性位点处氨基酸残基中,Arg953、Asp967、Lys830、Ala966和Asn954最容易与小分子配体的H、O原子形成氢键作用。这些氨基酸残基在与小分子结合时发挥较为重要的作用,尤其以Arg953和Ala966与小分子配体形成氢键的机会最大,此外范得华力和静电相互作用等非键相互作用在酶活性中心与小分子配体形成稳定的结合构象中也起了非常重要的作用[13]。
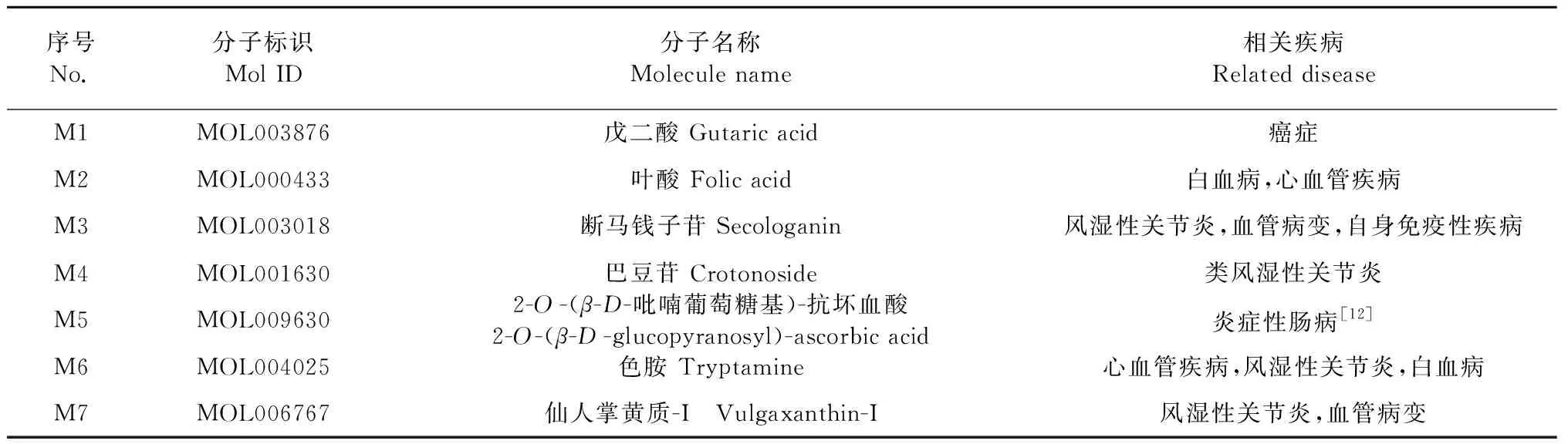
表2 7种优势小分子的相关信息Table 2 Related information of 7 best small molecules
2.3 高选择性筛选
为使小分子能与JAK3蛋白较好结合的同时,减小对其他JAK家族蛋白的影响,进行相应的高选择性筛选。以JAK1、JAK2、TYK2为靶蛋白,将M1~M7这7种小分子分别与这三个蛋白对接,结果见表3,筛选出仅与JAK3对接效果好,与其他JAK3家族蛋白对接效果差的小分子,从而获得JAK3激酶的高选择性抑制剂。
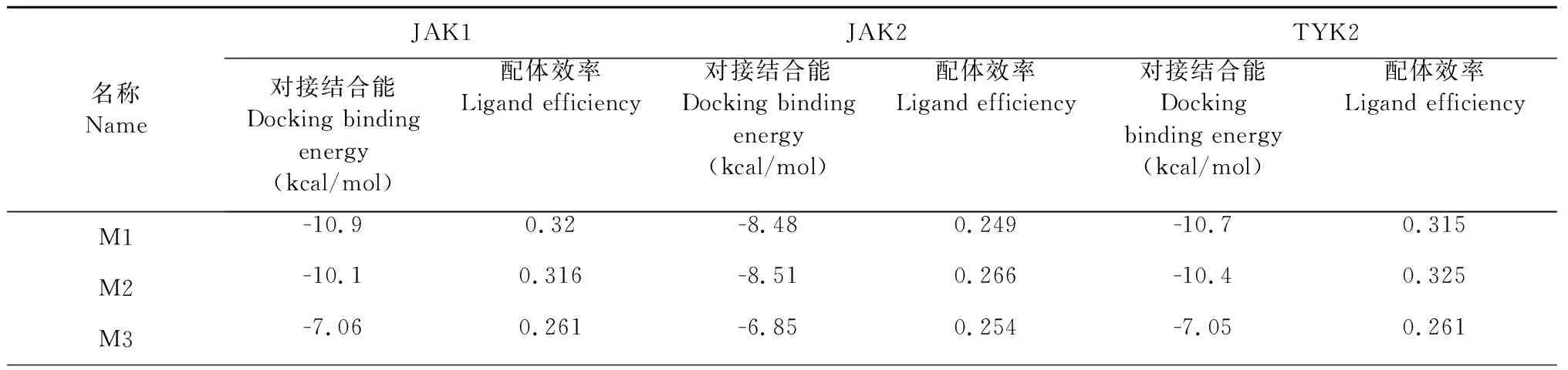
表3 7种小分子与JAK1、JAK2、TYK2的对接结合能及配体效率Table 3 Docking binding energy and ligand efficiency of 7 small molecules with JAK1,JAK2 and Tyk2

续表3(Continued Tab.3)
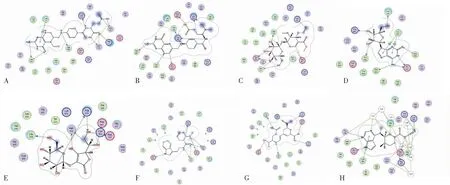
图1 小分子与JAK3蛋白的分子对接图Fig.1 Molecular docking diagram of small molecules and JAK3 protein注:A~H分别为戊二酸、叶酸、断马钱子苷、巴豆苷、2-O-(β-D-吡喃葡萄糖基)-抗坏血酸、仙人掌黄质-I和托法替尼与JAK3蛋白的分子对接图。Note: A~H are the molecular docking respectively picture of glutaric acid,folic acid,secologanin,crotonoside,2-O-(β-D-glucopyranosyl)-ascorbic acid,tryptamine,vulgaxanthin-I,tofacitinib and JAK3 protein.
以对接打分值小于-7.5且配体结合率大于0.3作为小分子与靶蛋白对接效果好的大致标准,发现M6与三个靶蛋白对接效果好;M1、M2、M7与两个靶蛋白对接效果好(其中M1、M2与JAK1和TYK2对接效果好,M7与JAK1和JAK2对接效果好);M4、M5只与其中一个靶蛋白对接效果好,对应分别是JAK2、TYK2蛋白。最终,只有M3(断马钱子苷,secologanin)与三个靶蛋白对接效果差,展现其与JAK3蛋白的高选择性结合(见图2)。
为进一步验证断马钱子苷的高选择性,在参考软件算法辅助打分的基础上,利用MOE软件,展现活性空腔内小分子与周围氨基酸残基的相互作用,并借助其report功能,得到各氢键的作用力大小,验证可得:相比于其他JAK家族蛋白,断马钱子苷在JAK3蛋白活性空腔内,与周围氨基酸残基产生更多更强的氢键作用力,更稳定地结合在其中,证实了它对JAK3蛋白高选择性的抑制作用。
3 讨论与结论
以上对接结果显示,中草药成分小分子戊二酸(glutaric acid)、叶酸(folic acid)、断马钱子苷(secologanin)、巴豆苷(crotonoside)、2-O-(β-D-吡喃葡萄糖基)-抗坏血酸(2-O-(β-D-glucopyranosyl)-ascorbic acid)、色胺(tryptamine)、仙人掌黄质- I(vulgaxanthin- I)与JAK3激酶的结合能力强于托法替尼(Tofacitinib),可以作为候选的JAK3激酶抑制剂。对结合位点进行汇总分析发现,JAK3激酶活性空腔中的Arg953、Asp967、Lys830、Ala966和Asn954氨基酸残基容易与小分子抑制剂的H、O原子形成氢键作用,是JAK3抑制剂的开发设计的关键。
在7种小分子中,断马钱子苷(secologanin)与其他JAK家族蛋白对接结合效果差,表现出与JAK3蛋白结合的高选择性,有进一步研究设计成为JAK3激酶特异性抑制剂的价值。断马钱子苷存在于金银花[15]和马钱子等植物中。金银花(LoniceraeJaponicaeFlos)是我国的传统中药,具有增强免疫力、抗肿瘤、降血糖血脂、消炎、解热等功效[15],药用历史悠久,临床用途十分广泛;马钱子(Strychnosnux-vomicaL.)被研究发现能够影响与类风湿关节炎发病有关的JAK-STAT通路[16]。根据本研究的结果,断马钱子苷可能具备与托法替尼类似的药理机制,通过与JAK3蛋白结合,抑制JAK磷酸化,进而抑制STAT磷酸化,从而阻断JAK-STAT信号转导通路,抑制多种炎症细胞因子的合成与分泌,达到抗炎、调节免疫的作用[17]。托法替尼对JAK1和JAK3激酶都能发挥抑制作用,而断马钱子苷与JAK3的结合作用具有高度选择性,作为JAK3激酶抑制剂的特异性更强。此外,断马钱子苷还是金银花等常用中药的成分,具有绿色性、易获取、毒副作用小等特点,值得作为JAK3特异性抑制剂进行深入研究。
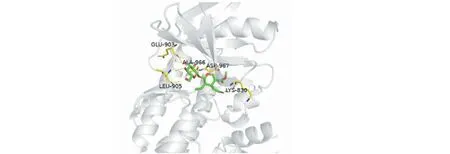
图2 断马钱子苷与JAK3的相互作用Fig.2 The interaction between secologanin and JAK3

