川芎茎叶中苯酞类化学成分研究
唐 飞,闫洪玲,杨 丽,孙家宜,胡昌江,,彭 成,敖 慧*,谭玉柱*
1成都中医药大学药学院 西南特色中药资源国家重点实验室;2成都中医药大学药学院 中医药创新研究院,成都 611137;3四川新绿色药业科技发展有限公司 国家中医药管理局“中药配方颗粒质量与疗效评”重点研究室,彭州 611930
川芎为伞形科植物川芎LigusticumchuanxiongHort.的干燥根茎,为著名的川产道地药材,具有活血祛瘀、行气解郁、祛风止痛的功效,临床用于治疗头痛、肝郁气滞证以及多种淤血证[1]。然其传统药用部位为干燥根茎,而占全株鲜重的75%的地上部位(茎叶)多废弃,不仅造成资源浪费和环境污染,且不利于中药资源的可持续利用。川芎茎叶古称蘼芜,《神农本草经》记载“主咳逆、定惊气、辟邪恶、除蛊毒、鬼痊、去三虫、久服通神”,在川芎主产区四川都江堰、彭州一带都有民间食用川芎嫩叶的习惯,以预防心脑血管疾病。其中,苯酞类化合物作为川芎的主要活性成分,对心脑血管和神经系统等具有明显调节作用,有研究推测其为川芎治疗瘀血证或是心脑血管疾病的主要物质基础[2]。而血管扩张是目前用于冠心病、心绞痛以及心肌梗死等心血管疾病的主要治疗方式,已有研究表明藁本内酯,洋川芎内酯A具有舒张血管活性[2]。因此,考察苯酞类成分的血管舒张活性对明确川芎及其地上部位的功效应用都具有重要意义。
课题组前期从川芎茎叶中首次发现了能舒张血管的苯酞类成分[2],本文在前期研究基础上,进一步挖掘其中的苯酞类成分,研究其血管舒张作用及其初步机制,并探讨了构效关系。本文进一步丰富了川芎茎叶苯酞类成分库,初步探讨了苯酞类成分血管舒张作用的构效关系,为川芎及其地上部位的开发利用提供参考。
1 材料与方法
1.1 仪器与材料
Avance 400 MHz超导核磁共振仪,Avance 600 MHz超导核磁共振仪(德国Bruker公司);Synapt G2 HDMS质谱仪(Waters公司);X-ray(APEX-IICCD,Bruker SMART公司);Perkin-Elmer 341 plus旋光测定仪(美国Perkin Elmer公司);LC50型中高压制备液相(赛谱锐思北京科技有限公司);色谱柱(COSMOS,Choiester,10ID×250 nm,5 μm;CHIRALPAKIC(LotNO.IC00CE-XC014)column(250 mm×4.6 mm,5 μm));FA2004B电子天平(上海越平科学仪器有限公司);离体组织器官恒温灌流系统(PL3508B6/C-V Panlab 8 Chamber Organ Bath System);净化工作台(SW-CJ-2FD,苏州安泰空气技术有限公司);细胞培养箱(15AC,SANYO公司);高速低温离心机(Biofuge 28RS,Heraeus Sepa Tech公司);显微镜(IX71/AE31EF INV,Olympus(Japan)/Motic(China));优普UPT系列超纯水(成都优普电子产品有限公司);可调式移液器(Thermo Fisher Scinentific)。
Sephadex LH-20色谱填料(瑞士Pharmacia公司);MCI树脂(日本三菱化学公司);硅胶GF254薄层板、200~300目柱色谱硅胶(青岛海洋化工厂);色谱纯甲醇、正己烷、异丙醇(美国TEDIA公司);氘代试剂(美国CIL公司)。其他试剂为分析纯(成都市科隆化学品有限公司);硝苯地平(Nifedipine,NF,美国SIGMA公司)。Fluo-3AM(10μg,索莱宝);激光共聚焦显微成像系统(Olympus,Tokyo,Japan);胎牛血清(10099-141500ml,GIBCO公司)。
SD大鼠,SPF级,雌雄均可,体质量200~240 g,由四川成都达硕生物科技有限公司提供,许可证号SCXK(川)2015-030。饲养温度20~25 ℃,昼夜光照及通风环境自然调节。A10大鼠平滑肌细胞购自北京爱思益普生物科技股份有限公司。
川芎茎叶于2018年4月采自四川省眉山市东坡区,经成都中医药大学胡昌江教授鉴定为川芎L.chuanxiong的茎叶,标本CX20180402现存于成都中医药大学中药化学1001研究室。
1.2 方法
1.2.1 提取与分离
取自然阴干的川芎茎叶(20 kg)粉碎成粗粉,用95%乙醇渗漉提取,减压浓缩成浸膏。采用系统溶剂法萃取得到石油醚、乙酸乙酯和正丁醇部位。取石油醚部位(0.5 kg)过MCI色谱柱(90%甲醇/水,V/V)脱色素处理,浓缩液过硅胶柱(200~300目),石油醚/乙酸乙酯(99∶1→1∶99,V/V)梯度洗脱,分别得到组分A~F。C组分用硅胶柱(正己烷/丙酮99∶1→1∶99,V/V)梯度洗脱,得C1~C6。C3经HPLC(75%甲醇/水,2 mL/min,V/V)制备得到化合物3(5 mg,tR=17.5 min)。C1经HPLC(60%甲醇/水,2 mL/min,V/V)制备得到化合物12(6 mg,tR=6.78 min)、13(6 mg,tR=8.28 min)。D组分用正己烷/丙酮(80∶1→1∶99,V/V)梯度洗脱,得D1~D4。D3经HPLC(甲醇/水70%→99%,2 mL/min,V/V)粗化段得D3.1~D3.4。D3.2经HPLC(65%甲醇/水,2 mL/min,V/V)制备得到化合物4(6 mg,tR=8.26 min)、6(5 mg,tR=11.18 min),D3.3经HPLC(70%甲醇/水,2 mL/min,V/V),制备薄层板(石油醚/乙酸乙酯2∶1)制备得到化合物8(4 mg)。D4经HPLC(甲醇/水70%→99%,3 mL/min,V/V)得化合物1(5 mg,tR=28.22 min),15(3.2 mg,tR=32.24 min)。E经凝胶色谱柱(二氯甲烷/甲醇4∶6),得E1~E5。E4经HPLC(70%甲醇水,3 mL/min)制备得到化合物5(4 mg,tR=10.02)、9(4 mg,tR=18.46)。E5经HPLC(70%甲醇/水,3 mL/min)制备得到化合物7(9 mg,tR=14.28 min)。F组分用正己烷/丙酮(99∶1→1∶99,V/V)梯度洗脱,得F1~F8,F3经中压C18柱(甲醇/水70%→99%,8 mL/min,V/V)梯度洗脱,得F3.1~F3.3。F3.2~F3.3经HPLC(70%甲醇/水,2 mL/min,V/V)分别制备得到化合物10(6 mg,tR=28.64 min)、11(5 mg,tR=32.48 min);F7、F8经HPLC(65%甲醇/水,2 mL/min,V/V)制备得到化合物14(4 mg,tR=13.26 min),2(4 mg,tR=18.66 min)。化合物1采用手性柱(Lot NO.IC00CE-XC014;4.6 μm,250 mm×4.6 mm)进一步分离(208 nm,正己烷/异丙醇(90∶10),0.8 mL/min,V/V),得到1a和1b。
1.2.2 血管舒张实验
大鼠颈椎脱臼处死打开胸腔取出胸主动脉,剪成约4 mm长的血管环置于O2饱和的4 ℃K-H液(NaCl 6.92,KCl 0.35,CaCl20.28,KH2PO40.16,MgSO40.14,NaHCO32.00,Glucose 1.82,EDTA 0.009 g/L),37 ℃恒温。连接离体组织灌流模型和Power Lab数据分析系统,调节静息张力为1 g,持续通入94.6%O2+5.4%CO2的混合气体,每隔15 min更换K-H液,重复2次,平衡60 min后,用KCl(60 mM)刺激血管环,张力达坪值用K-H液冲洗3次,每次间隔5 min,恢复到基础状态后,稳定30 min,重复刺激2次。待第3次预收缩血管环达坪值并稳定后,浴槽内累积加入2.4~12 μM样品,体积共2 μL,空白组加入等体积DMSO[2]。以硝苯地平(NF)作为阳性药对照,记录受试化合物对血管的舒张效应曲线。
1.2.3 化合物15对A10血管平滑肌细胞内钙离子浓度的影响
使用 Fluo-3 AM(5 μM)荧光探针为Ca2+指示剂,激光共聚焦显微镜测量[Ca2+]c的变化。将A10大鼠血管平滑肌细胞以1×105/mL的密度接种到直径为20 mm的共聚焦小皿中,接种体积为1 mL,细胞摇匀后置于细胞培养箱中培养24 h后,用无钙HBSS液清洗3次,每次在培养箱中孵育5 min,吸走上清液之前轻轻摇晃共聚焦小皿,以确保皿中残留的胎牛血清被完全洗掉。清洗结束后向小皿中加入1 mL含钙HBSS液,加入100 mM KCl造模,同时给与化合物15(20 μM),孵育30 min。孵育结束后,弃去皿中液体,用无钙HBSS液清洗3次,每次在培养箱中孵育5 min,吸走上清液之前轻轻摇晃共聚焦小皿,以确保皿中残留的含钙HBSS液被洗去。向小皿中加入0.5 mL含有5 μM fluo-3/AM荧光探针的无钙HBSS孵育细胞,孵育条件为恒温37 ℃,避光孵育20 min,取出加入2.5 mL的无钙HBSS液(含1%血清),再孵育40 min。孵育结束后,弃去皿中液体,用无钙HBSS液清洗3次,每次在培养箱中孵育5 min,吸走上清液之前轻轻摇晃共聚焦小皿,以确保皿中残留的染料被洗去。上机检测,记录初始荧光浓度,对于每个细胞,[Ca2+]c从细胞区域内的像素平均。在分析之前进行背景扣除,计算给药组和对照组的平均细胞荧光值[3,4]。
1.2.4 统计方法
以KCl(60 mM)所致的最大收缩张力为100%,按照公式计算各浓度化合物对血管收缩幅度的影响。实验数据采用血管张力值变化反映药物作用,单位为g。采用SPSS21.0统计软件分析处理,以P<0.05为有统计学意义。
血管舒张率=[(最大收缩张力-
当前收缩张力)/最大收缩张力]×100%
2 结果
2.1 结构鉴定

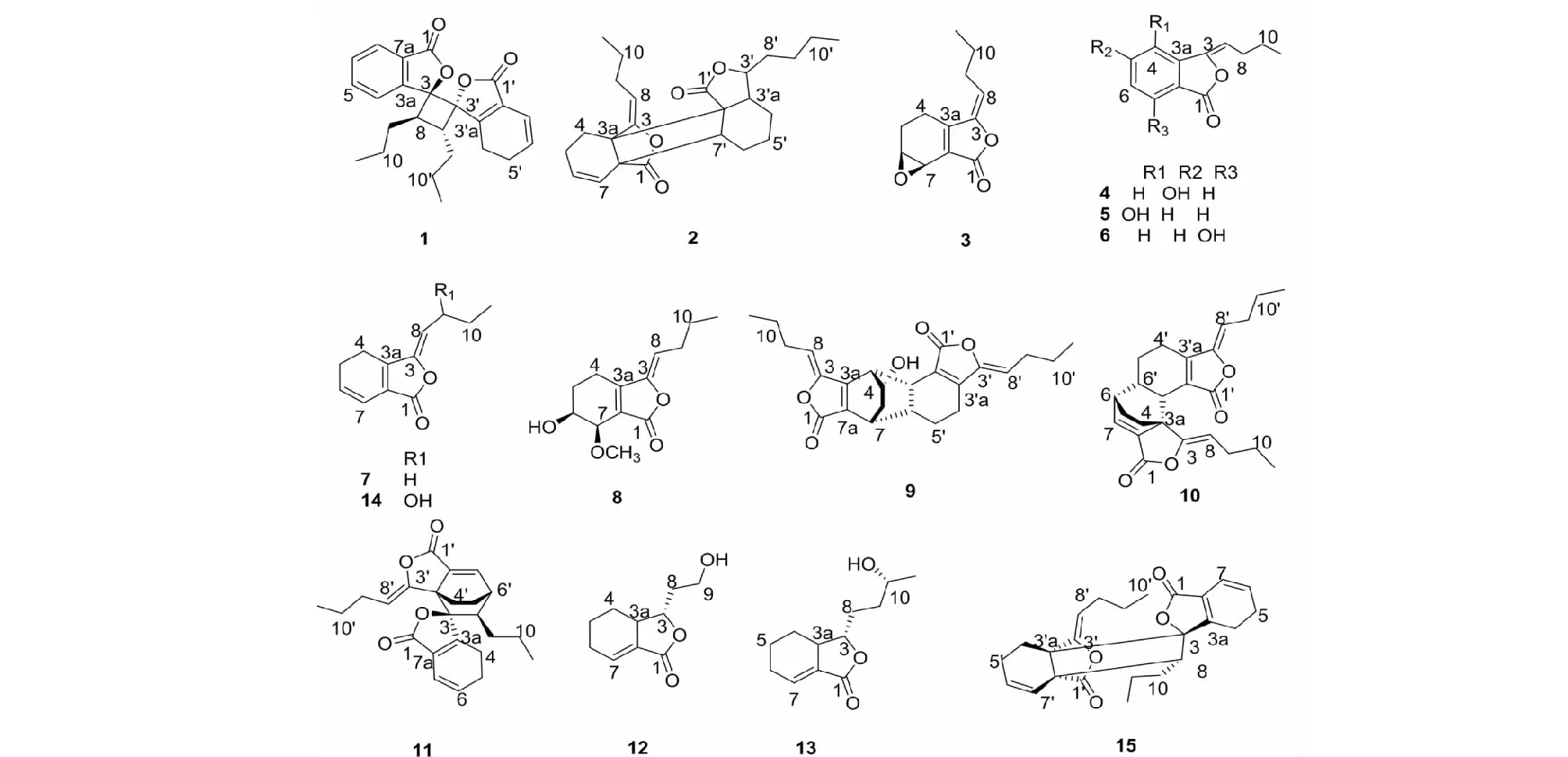
图1 化合物1~15结构Fig.1 The structures of compounds 1-15
分子式:C24H26O4,M = 378.45,晶胞参数为a= 9.008 4(5)Å,b= 9.628 4(6)Å,c= 13.206 4(7)Å,α= 94.233(5)°,β= 109.374(5)°,γ= 100.971(5)°,V= 1 049.20(11)Å3,T= 293K,空间群为P1,Z= 2,μ(MoKα) = 0.710 73 mm-1,收集衍射点数为8 610,独立衍射点数为4 276(Rin t= 0.015 9),R1= 0.062 5(I>2σ(I)),wR(F2) = 0.150 4(I>2σ(I)),R1= 0.108 3(all data),wR(F2)= 0.180 4(all data),F2= 1.023。其晶体数据已上传于剑桥晶体数据中心,编号为CCDC2011219(立体结构见图2)。

分子式:C24H32O4,M =384.49,晶胞参数为a=19.710(5)Å,b=10.730(3)Å,c=10.284(3)Å,α= 90°,β= 90°,γ= 90°,V= 2 174.8(10)Å3,T= 293 K,空间群为P212121,Z= 4,μ(MoKα) = 0.710 73 mm-1,收集衍射点数为6 758,独立衍射点数为4 009(Rint= 0.081 2),R1= 0.280 1(I>2σ(I)),wR(F2)=0.285 0(I>2σ(I)),R1=0.280 1(all data),wR(F2)= 0.399 1(all data),F2= 0.991,Flack参数为-4.2(10),其晶体数据已上传于剑桥晶体数据中心,编号为CCDC2011222。

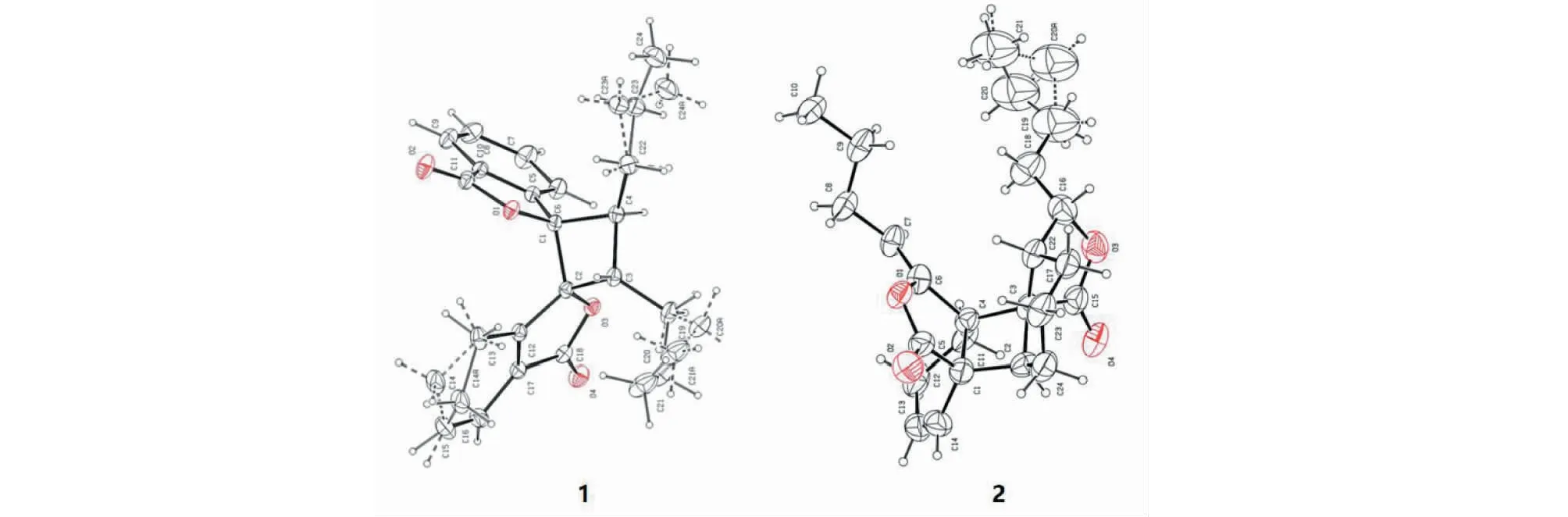
图2 化合物1、2单晶X射线衍射分析的分子立体结构Fig.2 Molecular 3D structure of compound 1 and 2 established by single crystal X-ray diffraction analysis
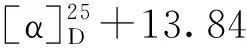

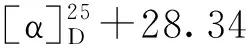
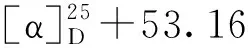
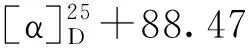
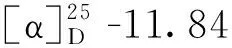
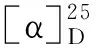
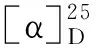
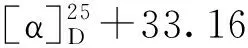
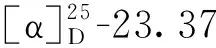
2.2 舒张血管活性及构效分析
空白组对氯化钾(KCl)诱导的大鼠胸主动脉环收缩无明显影响(P>0.05),硝苯地平(NF)各浓度均能显著舒张血管环(P<0.001),最高浓度舒张率为118%(4 μM)。单苯酞化合物3、5、4、7、8、12、13最高浓度(12 μM)舒张率分别为42%、18%、51%、43%、44%、16%、33%(P<0.01),苯酞二聚体化合物1、2、9、10、15最高浓度舒张率分别为65.6%、25%、17%、73%、93%(P<0.01),化合物1、10、15的EC50分别为8.81、8.23、6.2 μM,结果见图3a。此外,化合物1拆分后,1a、1b最高浓度舒张率分别为52.2%、46.5%;1a的EC50为11.83 μM,见图3b。
构效分析表明,苯酞二聚体活性显著优于单苯酞(如化合物1、10、15);羟基的取代位置不同对Z-丁烯基苯酞的活性影响显著(如化合物4、5、6);而C-6/C-7位取代与否对藁本内酯活性影响较小(如化合物3、7、8);但当羟基取代于侧链,尤其位于端基时对活性影响最大(如化合物12、13);化合物1活性消旋体>左旋体>右旋体。
2.3 化合物15降低A10血管平滑肌细胞内钙离子浓度
为了进一步探究其机制,选取血管舒张活性最优的化合物15,探究其对大鼠血管平滑肌细胞钙离子浓度影响。结果表明,化合物15在测试浓度下(20 μM)能显著降低A10血管平滑肌细胞的荧光值(P<0.001)(见图4)。其中,对照组荧光值为148,给药组的荧光值为18。
3 讨论与结论
据不完全统计,我国心血管疾病患者已达到2.9亿人,居全球首位。目前治疗心血管疾病的主要手段是药物治疗,比如血管扩张剂。通过促使血管扩张,改善血流动力效应,不仅可用于高血压的治疗,同时也是治疗心脑血管疾病的重要手段。血脑屏障是影响脑血管疾病治疗的主要因素,有研究表明苯酞类药物可透过血脑屏障[17,18],这可能是川芎“上行头目”尤善于治疗头痛的药效物质基础。已有研究表明,洋川芎内酯A,藁本内酯能够舒张KCl引起的血管收缩(pD24.42、4.43)[19,20],且无内皮依赖性。藁本内酯作为其主要苯酞类成分,由于其不稳定限制了其进一步应用。因此,其衍生物也应受到更多的关注[21,22]。

图3 受试化合物的血管舒张率Fig.3 Vasodilation rate of test
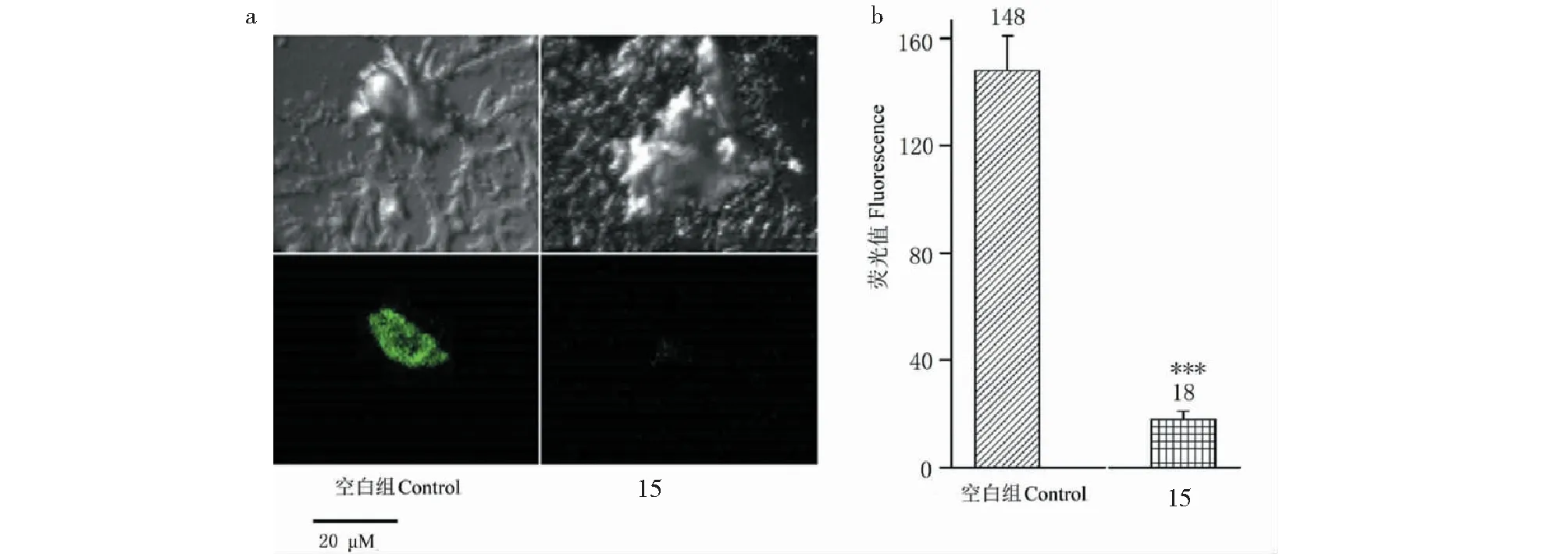
图4 A10平滑肌细胞荧光值Fig.4 The fluorescence of A10 smooth muscle 注:与对照组相比,***P<0.001。Note:Compared with control group,***P<0.001.
本实验从川芎茎叶石油醚部位分离出15个苯酞类化合物,包括9个单苯酞,6个苯酞二聚体。其中,当归内酯A(1)、新二聚藁本内酯(15)、茶芎内酯D(2)、Z-6-羟基-7-甲氧基-藁本内酯(8)、(3S,3aR)-3-羟乙基-3a,4,5,6-四氢苯酞(12)、(3S,3aR,10R)-(-)-10-羟基苯酞(13)为首次从川芎中分离;并首次对化合物1、2进行了单晶衍射,进一步确定其结构。本文简要分析了羟基取代、旋光异构对苯酞血管舒张作用的影响,为下一步继续丰富苯酞结构类型,深入研究构效关系提供参考,也为寻找新颖血管舒张剂先导化合物提供了方向。前期机制研究发现,藁本内酯的活性与抑制电压依赖性钙通道(VDCC)和受体操作钙通道(ROCC)介导的Ca2+内流和释放有关,并推测其可能与L型电压门控钙通道Cav1.2靶点有关[19,20]。本文通过激光共聚焦实验,初步验证了苯酞类成分血管舒张作用可能是通过影响离子通道开放抑制钙离子内流引起,但是具体机制还有待进一步研究。通过对川芎地上生物资源的化学成分研究,进一步丰富了川芎茎叶的化学成分库,为扩血管苗头化合物发现奠定基础,为民间食用川芎嫩叶预防心脑血管疾病提供科学依据。
致谢:感谢四川新绿色药业科技发展有限公司的冯健、庞家鹅、贾丽娟、张莎莎等人在样品采收前处理及耗材采购中提供的帮助,在此致谢!

