桉属挥发油化学成分及其生物活性研究进展
黄丽平,伍影瑶,赖俊杰,周中流*
1岭南师范学院;2粤西特色生物医药工程技术研究中心,湛江 524048
桉树为桃金娘科(Myrtaceae)桉属(EucalyptusL.Herit)的常绿性乔木,原产于澳大利亚、印度尼西亚岛屿和马布亚新几里亚,共有945个种和变种,具有挥发性物质排放量大特性,尤其是枝叶富含挥发油,但不同种类不同地区的挥发油含量差异较大[1-4]。现全球桉属约有600多种,我国引进桉树已有百年历史,目前我国的桉树主要分布于华南地区,广东和广西为桉树主要种植区域,主要用于造纸、生产人造板和抽取桉油,目前我国也是最大的桉树油出口国之一。迄今为止,从桉属植物中发现了大量挥发性化学成分,主要为萜类(包括单萜、倍半萜等)、脂肪族化合物、芳香族化合物及其他化合物。现代药理研究已证实桉属挥发油化学成分具有抗菌消炎、改善呼吸道功能、杀虫、抗氧化、抗炎镇痛等功效,国内外学者已对其挥发油化学成分和生物活性进行了广泛研究[1-4]。据笔者统计,国内外学者已从桉属植物中分离鉴定了948个挥发性化学成分,其中萜类化合物共685个、脂肪族化合物共29个、芳香族化合物共39个、其他化合物共195个。本文对近三十年来桉属植物挥发油化学成分和生物活性的研究进展进行了系统综述,为更好地利用桉叶资源的药用价值及进一步深入研究开发提供依据。
1 化学成分
1.1 萜类
萜类广泛存在于植物中,是分子式为异戊二烯的整数倍的烯烃类化合物,具有较强的挥发性香气及生物活性。桉属挥发油中已知最主要的化学成分是萜类化合物,主要分为单萜、含氧单萜、倍半萜和含氧倍半萜。
1.1.1 单萜
单萜化合物是桉属挥发油中重要的活性成分,桉属挥发油中的单萜化合物主要有萜品油烯(terpinolene)、对伞花烃(p-cymene)、松油烯(terpinene)、柠檬烯(limonene)、蒎烯(pinene)和罗勒烯(ocimene)等,本文综述了桉属挥发油中单萜化合物共85种,化合物名称详见表1,代表性化合物结构详见图1。

表1 桉属单萜化合物Table 1 Monoterpenes of Eucalyptus

续表1(Continued Tab.1)

续表1(Continued Tab.1)
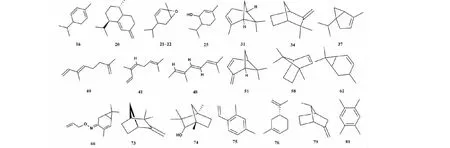
图1 桉属中单萜代表性化合物的结构Fig.1 Structures of representative monoterpenes from Eucalyptus
1.1.2 含氧单萜
含氧单萜化合物是桉树挥发油中最主要的活性成分,是医药、食品和日用化妆品工业的重要原料。桉属挥发油中含氧单萜化合物主要有桉叶油素(cineole)、芳樟醇(linalool)、香茅醛(citronellal)、异胡薄荷醇(isopulegol)、松油醇(terpinol)、香茅醇(citronellol)等,本文综述了桉属挥发油中含氧单萜化合物共309种,化合物名称详见表2,代表性化合物结构详见图2。

表2 桉属含氧单萜化合物Table 2 Oxygen-contain monoterpenes of Eucalyptus

续表2(Continued Tab.2)

续表2(Continued Tab.2)

续表2(Continued Tab.2)

续表2(Continued Tab.2)

续表2(Continued Tab.2)

续表2(Continued Tab.2)

续表2(Continued Tab.2)
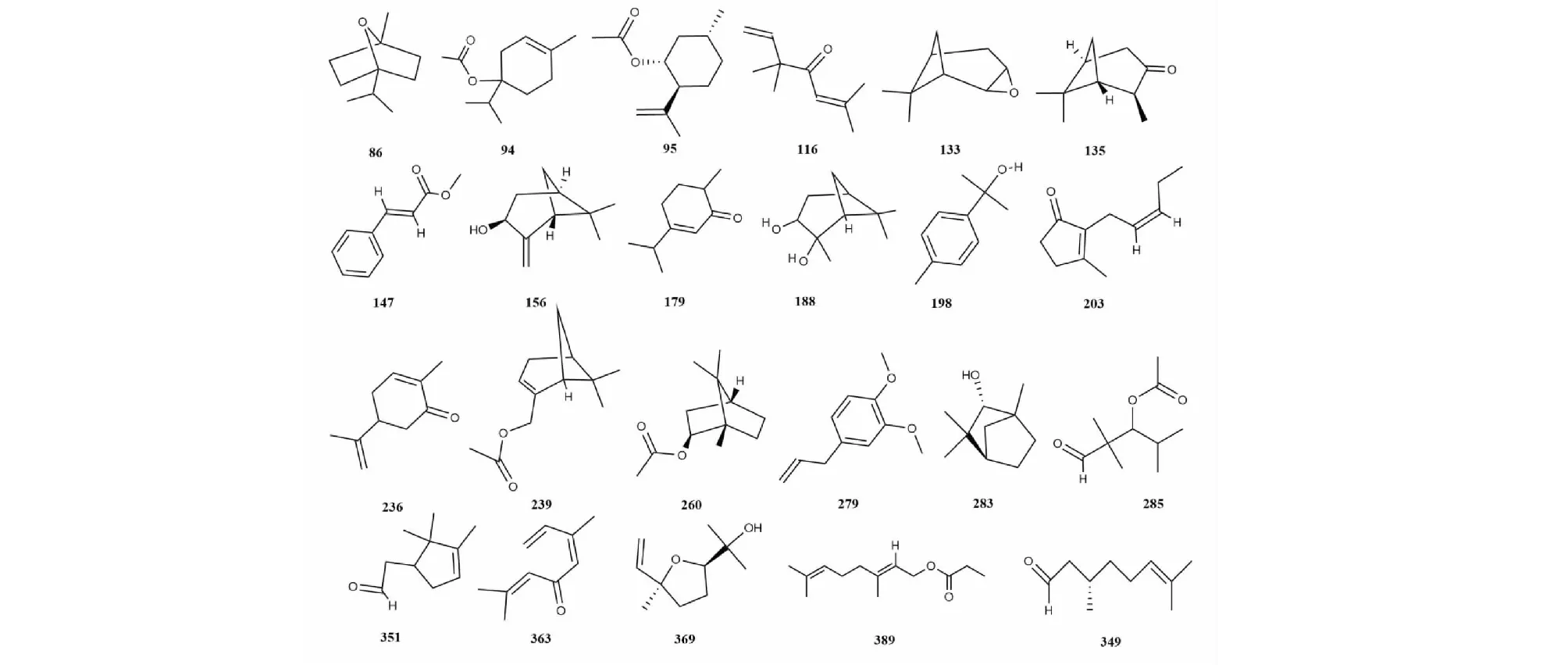
图2 桉属中含氧单萜代表性化合物的结构Fig.2 Structures of representative oxygen-containing monoterpenes from Eucalyptus
1.1.3 倍半萜
倍半萜是萜类化合物中最大的一个分支,大多具有较高沸点。桉属挥发油中倍半萜化合物主要有荜澄茄烯(cubebene)、石竹烯(caryophyllene)、香橙烯(aromadendrene)、葎草烯(humulene)、蛇床烯(selinene)、古芸烯(gurjunene)、杜松烯(cadinene)、愈创木烯(guaiene)等。本文综述了桉属挥发油中倍半萜化合物共146种,化合物名称详见表3,代表性化合物结构详见图3。
表3 桉属倍半萜化合物Table 3 Sesquiterpenes of Eucalyptus

续表3(Continued Tab.3)

续表3(Continued Tab.3)

续表3(Continued Tab.3)

续表3(Continued Tab.3)
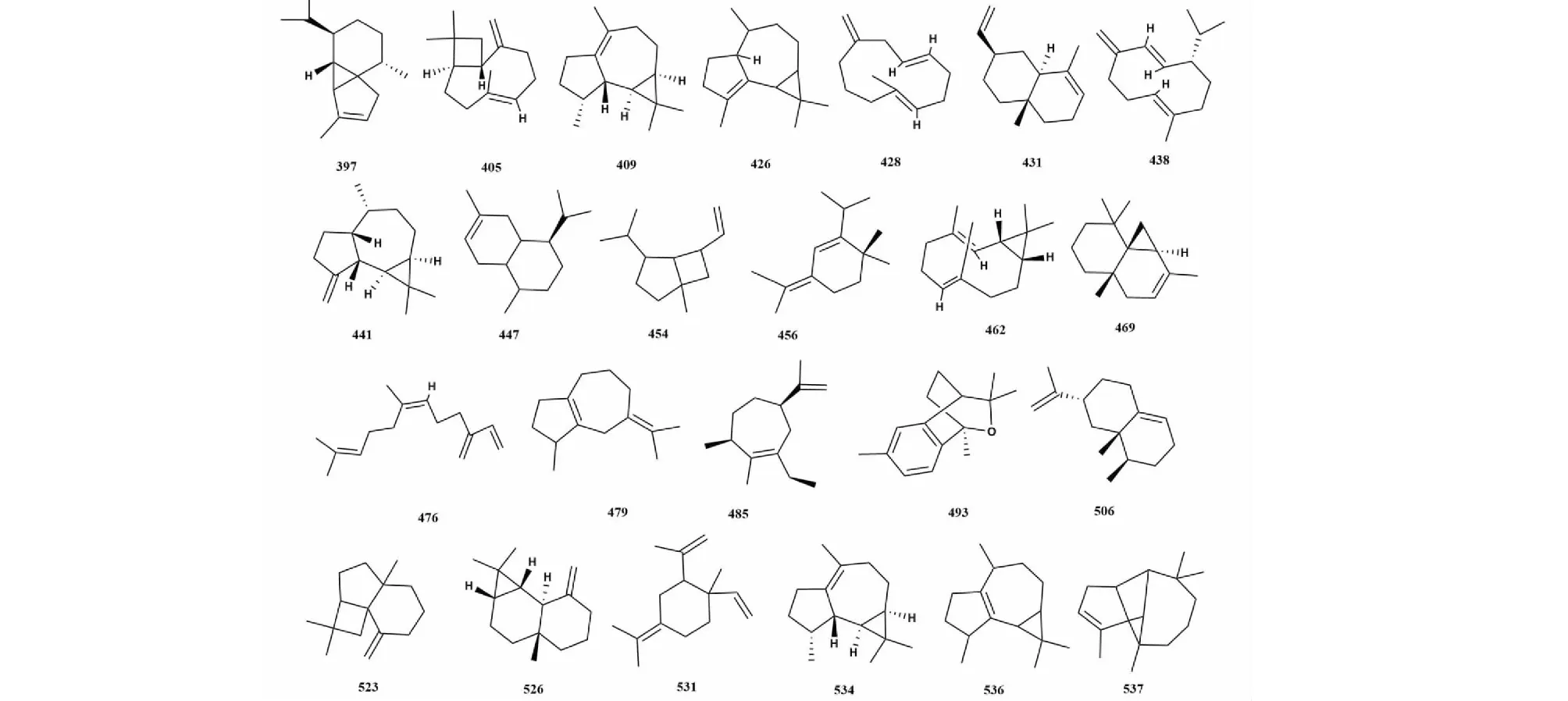
图3 桉属中倍半萜代表性化合物的结构Fig.3 Structures of representative sesquiterpenes from Eucalyptus
1.1.4 含氧倍半萜
桉属挥发油中含氧倍半萜化合物主要有环氧石竹烯(caryophyllene oxide)、蓝桉醇(clobulol)、绿花白千层醇(viridiflorol)、斯巴醇(spathulenol)、桉油醇(eudesmol)、喇叭茶醇(ledol)、毕橙茄醇(cadinol)等。本文综述了桉属挥发油中含氧倍半萜化合物共145种,化合物名称详见表4,代表性化合物结构详见图4。

表4 桉属含氧倍半萜化合物Table 4 Oxygen-containing sesquiterpenes of Eucalyptus

续表4(Continued Tab.4)

续表4(Continued Tab.4)

续表4(Continued Tab.4)
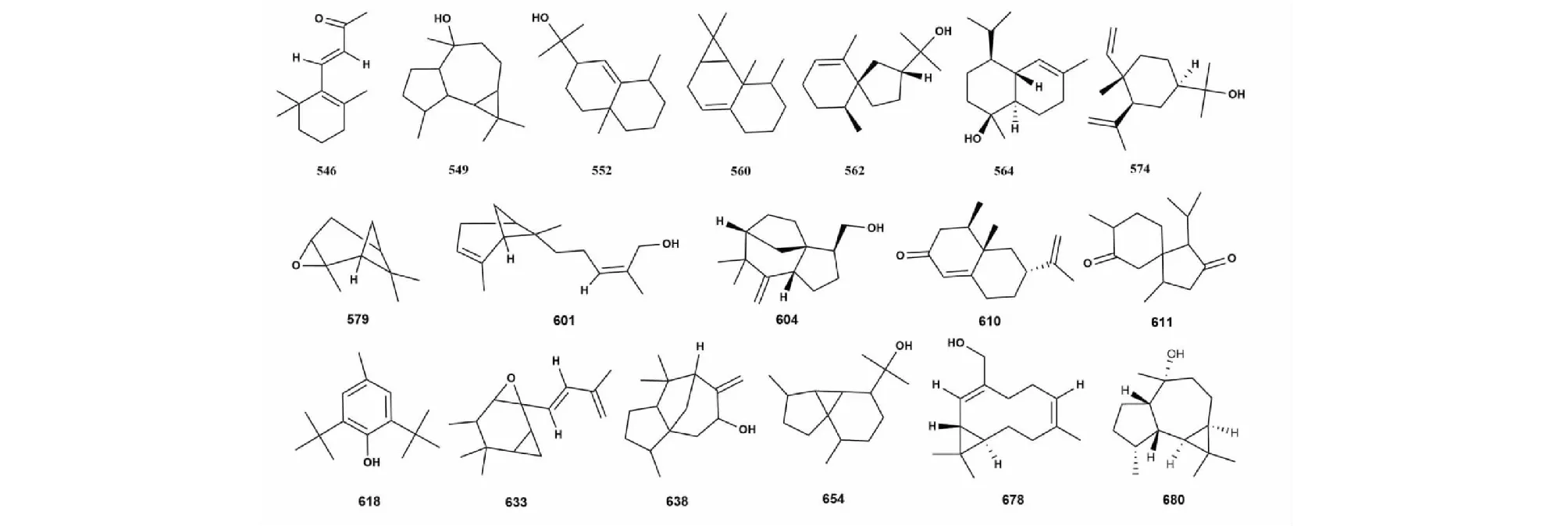
图4 桉属中含氧倍半萜代表性化合物的结构Fig.4 Structures of representative oxygen-containing sesquiterpenes from Eucalyptus
1.2 脂肪族化合物
桉属挥发油中的脂肪族化合物主要为小分子脂肪酸和脂肪醇,本文综述了桉属挥发油中小分子脂肪酸化合物共7种,化合物名称详见表5;脂肪醇化合物共22种,详见表6,其化合物结构详见图5与图6。

表5 桉属小分子脂肪酸化合物Table 5 Small molecule aliphatic acid of Eucalyptus

图5 桉属中小分子脂肪酸代表性化合物的结构Fig.5 Structures of representative small molecule aliphatic acid from Eucalyptus
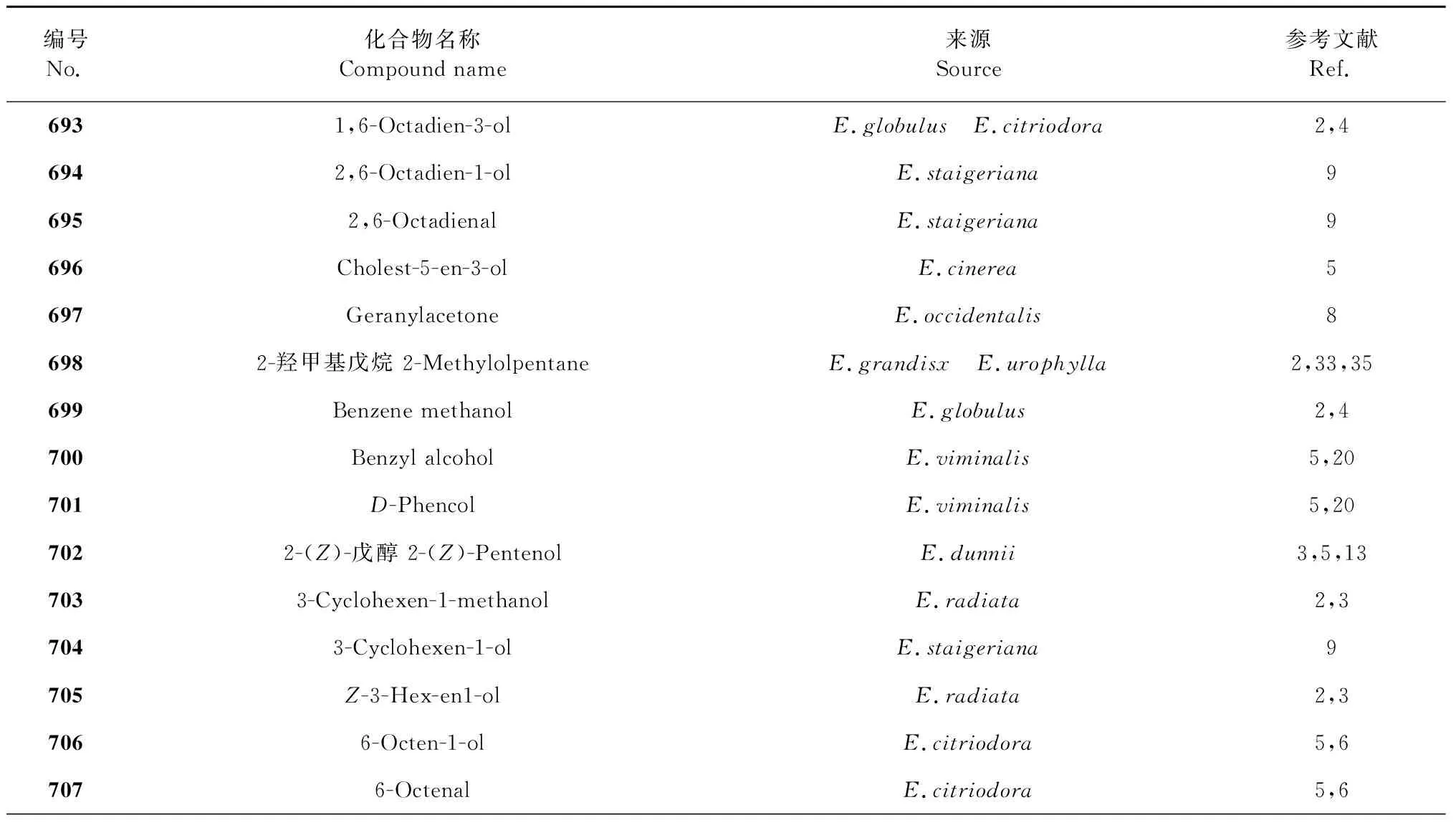
表6 桉属脂肪醇化合物
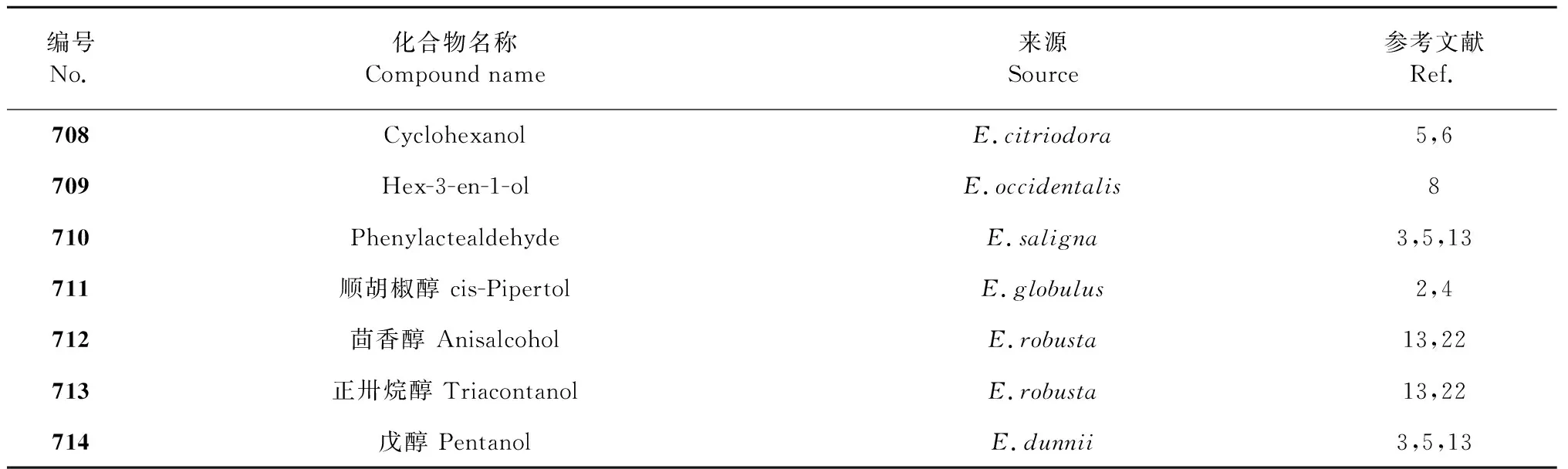
续表6(Continued Tab.6)

图6 桉属中脂肪醇代表性化合物的结构Fig.6 Structures of representative aliphatic alcohol from Eucalyptus
1.3 芳香族化合物
芳香族化合物包括芳香烃及其衍生物,本文综述了桉属挥发油中39种芳香族化合物,包括vanillin、p-coumaric acid和ferulicacid等,化合物名称详见表7,代表性化合物结构详见图7。
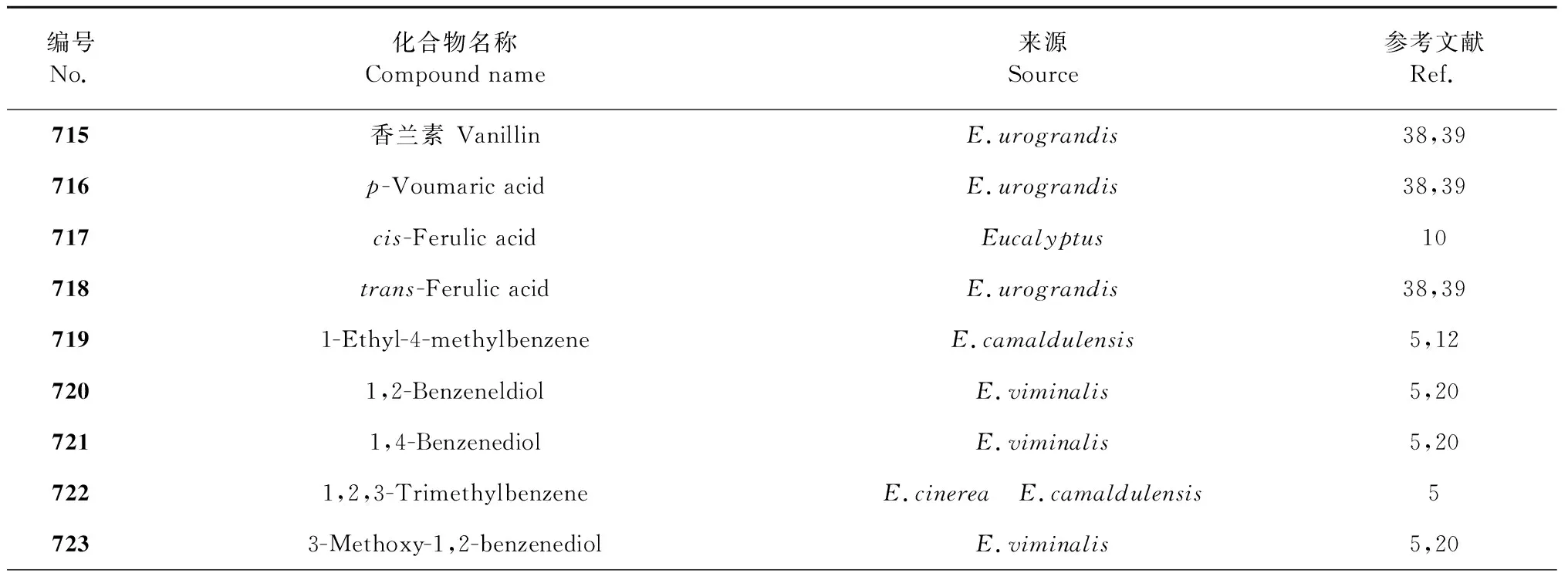
表7 桉属挥发油芳香族化合物Table 7 Essential oil aromatic of Eucalyptus

续表7(Continued Tab.7)
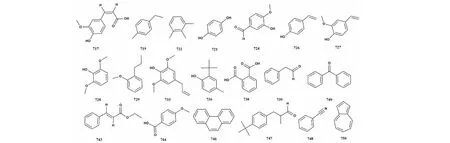
图7 桉属中挥发油芳香族代表性化合物的结构Fig.7 Structures of representative essential oil aromatic from Eucalyptus
1.4 其他化合物
本文综述桉属挥发油中其他化合物共195种,包括酯类、醛类、酮类和醌类等,化合物名称详见表8,代表性化合物结构详见图8。

表8 桉属其他化合物Table 8 Other compounds of Eucalyptus

续表8(Continued Tab.8)

续表8(Continued Tab.8)

续表8(Continued Tab.8)

续表8(Continued Tab.8)

续表8(Continued Tab.8)
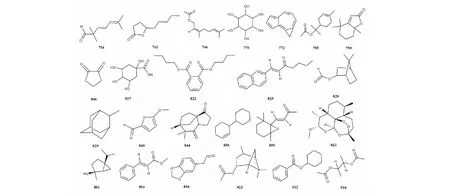
图8 桉属中其他代表性化合物的结构Fig.8 Structures of other representative compounds in Eucalyptus
2 生物活性
2.1 杀虫驱虫作用
2.1.1 抗农作物害虫作用
为减少使用合成农药,并寻求替代或创新的害虫防治方法,国内外学者为此开展了很多研究。Byung-Ho等[49]表明E.blakelyi挥发油(5、121)对水稻害虫米象(Sitophilusoryzae)、谷蠹(Rhyzoperthadominica)和赤拟谷盗(Triboriumcastaneum)具有强力的熏蒸毒性,半数致死量(LD50)分别为31.2、9.7和15.5 μL/L。Sefidkon等[39]报道了E.microtheca、E.sargentii、E.viminalis、E.grandis、E.camaldulensis和E.occidentalis等6种桉树挥发油均对米象具有很强的熏蒸活性,半数致死量浓度(LC50)分别为11.11、11.94、14.73、15.65、17.49和28.9 μL/L,E.microtheca挥发油对米象的熏蒸毒性最强。Sefidkon等[39]还报道了E.microtheca和E.saligna挥发油对玉米象(S.zeamais)和杂拟谷盗(T.confusum)具有很强的熏蒸毒性,E.microtheca挥发油对玉米象和杂拟谷盗的半数致死量分别为0.82 和0.99 μL/cm2,E.saligna挥发油对玉米象和杂拟谷盗的半数致死量分别为0.36和0.48 μL/cm2。从半数致死量结果可知,E.saligna挥发油对玉米象和杂拟谷盗的毒性更强,可作为抗玉米象和杂拟谷盗虫农药的替代品。Toudert-Taleb等[50]研究表明含有α-pinene(31)、β-pinene(32)、limonene(15)、p-cymene(5)、camphene(34)和 terpinolene(2)的E.globulus挥发油(5、121)能够防治四纹豆象(Callosobruchusmaculatus)。E.globulus挥发油蒸气通过卵膜扩散,通过影响与胚胎发育相关的生理和生化过程,从而达到杀虫和驱虫的目的。
2.1.2 驱杀蚊虫作用
Lucia等[51]报道了E.globulus(31、121、174、423)、E.dunnii(5、103、121、174、549)、E.gunnii(5、16、31、121、556)、E.tereticornis(5、16、19、121、174)、E.camaldulensis(5、19、121、174、556)和E.saligna(5、17、31、121、174)等6种桉树挥发油对埃及伊蚊幼虫杀虫作用,6种桉树对埃及伊蚊幼虫的半数致死浓度分别为32.4、25.2、21.1、22.1、26.8和22.2 p.p.m.,E.gunnii挥发油对埃及伊蚊幼虫毒性最强。Lucia等[51]还报道了桉树挥发油单体化合物α-pinene(31)、β-pinene(32)、1,8-cineole(99%)(121)和p-cymene(5)具有抗埃及伊蚊幼虫作用,α-pinene、β-pinene和1,8-cineole(99%)半数致死浓度分别为15.4、12.1和57.2 p.p.m.。1,8- cineole(99%)杀虫作用较低,幼虫死亡率为(36±8.5)%,p-cymene的幼虫死亡率可高达100%,在对照溶液或阳性对照中未观察到幼虫死亡率。Daizy等[33]报道了含p-menthane-3,8-diol的E.citriodora挥发油可防蚊虫叮咬。Gao等[52]通过药理研究实验发现β-caryophyllene具有驱赶蚊虫作用。Park等[53]研究表明α-terpinene(13)、p-cymene(5)、limonene(15)和γ-terpinene(17)的幼虫杀虫率可高达95%。Zhou等[71]报道了巨尾桉叶油中α-pinene(31)、α-terpineol(174)和limonene(15)等对昆虫具有引诱活性,这些物质可以参与昆虫诱杀剂的合成或建立引诱区进而开发成生物杀虫剂。因此,桉树挥发油可开发为天然驱蚊虫剂。
2.1.3 抗人头虱作用
Daizy[33]和Lucia[54]分别报道了E.cinerea(121)、E.viminalis(121)、E.saligna(31)、E.camaldulensis(5、31、121、387)、E.grandis(31、121)和E.tereticornis(5、31)等6种桉树挥发油对耐氯菊酯人头虱的熏蒸毒性或驱避活性,其半数击倒时间(KT50)分别为12.0、14.9、17.4、35.01、25.57和31.3 min。E.cinerea挥发油对耐氯菊酯人头虱半数击倒时间最短,具有最强的抗耐氯菊酯人头虱毒性。Daizy等[33]研究表明含1,8-cineole的挥发油对人头虱具有毒性,1,8-cineole(半数致死温度LT50=0.125 mg/cm2)与阳性药δ-吩噻菌灵或除虫菊(LT50=0.25 mg/cm2)相比具有更高的杀虫活性。Tian等[55]认为1,8-cineole对试虫较强的抑制作用是1,8-cineole抑制了乙酰胆碱酯酶的活性,从而阻碍细胞的发育和成熟。Lucia等[54]报道了carvacrol(246)、citronellol(162)、geraniol(268)、eugenol(278)、thymol(210)、α-terpineol(174)、1,8-cineole(121)和linalool(139)等8种化合物对耐氯菊酯的人头虱具有毒性,其杀虫率分别为28%、39%、51%、3%、51%、8%、53%、55%、56%和61%,linalool具有较强的杀虫作用。桉树挥发油各种成分协同作用,可达到整体杀虫活性,故桉树挥发油可开发为控制人头虱的新产品。
2.1.4 杀螨作用
Han等[56]报道了menthol(376)、citronellyl acetate(104)、geranyl acetate(211)、citral(96)、eugenol(278)、β-citronellol(164)、geraniol(268)、isopulegol(145)、citronellal(128)、terpinen-4-ol(151)、α-terpineol(174)、β-caryophyllene(416)和linalool(139)具有较强杀二斑叶螨毒性,半数致死浓度分别为12.9、16.7、25.3、25.5、25.9、26.1、32.0、30.7、34.8、36.7、39.3、49.1和58.9 μg/cm3。Menthol为最有效的杀二斑叶螨化合物,可作为天然的杀螨剂。
2.1.5 抗细粒棘球蚴原头节作用
Zhao[57]报道了大叶桉叶和巨桉叶石油醚和二氯甲烷提取物对细粒棘球蚴原头节的杀虫作用。大叶桉叶和巨桉叶石油醚提取物对细粒棘球蚴原头节的半数致死浓度分别为2.577和3.110 261 4 μg/mL。大叶桉叶和巨桉叶二氯甲烷提取物对细粒棘球蚴原头节的半数致死浓度分别为21.84和2.678 μg/mL。大叶桉叶石油醚提取物和巨桉叶二氯甲烷提取物对细粒棘球蚴原头节具有很强的杀虫作用,可考虑将其作为抗细粒棘球蚴原头节新产品的来源。
2.2 抗炎作用
Bai等[58]报道了大叶桉叶挥发油具有抗炎作用,能够显著抑制炎症部位PGE2的渗出、明显减少肉芽组织增生,可用于奶牛急慢性乳房炎的治疗。Eucalyptol是桉树挥发油中的主要活性成分,Caceres等[59]表明eucalyptol能够对抗哮喘,eucalyptol对哮喘的作用可能是通过干扰血液中单核细胞花生四烯酸的代谢,抑制由脂多糖(LPS)诱导的人类单核细胞中IL-1β的产生,从而抑制LPS诱导巨噬细胞系中一氧化氮(NO)的产生,并减少LPS诱导的表达,转运和转录人细胞系中早期生长反应因子1、Egr1和NF-kappaB的活性。Caceres等[59]还报道了eucalyptol具有抗炎作用,能减轻鼻窦炎的症状和防止慢性阻塞性肺疾病(COPD)恶化、消除由角叉菜胶引起的水肿、缓解结肠炎、胃损伤、过敏原引起的支气管收缩和炎症、吸入烟气刺激物和内毒素引起的呼吸道刺激、肝衰竭和肺部炎症。Eucalyptol是伤害感受器中表达的刺激性受体(TRPA1)抑制剂,可抑制TRPA1引起的炎性反应。
2.3 抗菌作用
Tan等[60]报道了含α-pinene (31)、1,8-cineole (121)和caryophyllene(405)等化合物的桃金娘科挥发油对革兰氏阴性、阳性细菌和真菌均有较强的抑制活性。Mervat等[61]表明E.camaldulensis挥发油(31、121、262、376)对青枯菌(Ralstoniasolanacearum)、果胶杆菌(Pectobacteriumcarotovorum)、根癌农杆菌(Agrobacteriumtumefaciens)和马铃薯黑胫病菌(Dickeyaspp.)具有较强的抗菌作用。Ma等[62]认为cineole、ocimene(44)、camphene(34)、α-terpineol(174)、caryophyllene(405)、α-pinene(31)和β-pinene(32)等化合物是抑菌、抗菌的活性成分,其中cineole、ocimene、camphene、α-pinene和β-pinene对葡萄球菌及绿脓杆菌均具有较强抑制活性。Nameghi等[63]研究表明薄荷和E.globules挥发油(5、31、121)混合物可通过改变细菌细胞壁的通透性,使致病菌孔形成和渗透压休克、细胞质及其活性成分泄漏到细胞外,导致细菌死亡从而发挥抗菌作用。Bhuyan等[64]认为E.camaldulensis、E.tereticornis、E.alba、E.citriodora、E.globulus、E.saligna、E.robusta和E.staigeriana等8种桉树粗提物具有对抗耐甲氧西林的金黄色葡萄球菌、铜绿假单胞菌、松鼠葡萄球菌(Staphylococcussciuri)、产色葡萄球菌(Staphylococcuschromogenes)、木糖葡萄球菌(Staphylococcusxylosus)、华纳葡萄球菌(Staphylococcuswarneri)、寄生曲霉和黄曲霉的作用。Casey等[65]发现桉树挥发油(主要含1,8-cineole)可以增强洗必泰(CHG)在皮肤中的传递,从而减少皮肤深层微生物的数量,达到降低手术部位感染风险的目的。
2.4 麻醉镇痛作用
2.4.1 麻醉作用
Bodur等[66]研究表明桉树挥发油能够引起受试鱼类血浆皮质醇浓度升高、肝组织中糖皮质激素受体(gr)表达增加头、肾组织中与类固醇生成相关的基因star和cyb11b1表达增加,从而发挥麻醉作用。桉树挥发油可作为新型鱼类天然麻醉剂。
2.4.2 镇痛作用
Gouveia等[67]报道了α-terpineol能显著降低机械性痛觉过敏和自发、触诊引起的痛觉,且不改变肿瘤的生长、无明显的生化和血液学毒性,可认为α-terpineol具有开发为有效控制癌症疼痛的新型安全止痛药的潜力。Caceres等[59]报道了eucalyptol具有较强的镇痛作用,能减轻酸、福尔马林和热诱发的疼痛感。Eucalyptol是TRPM8(外周感觉神经元中的冷/Menthol受体)的强效激动剂,半最大效应浓度(EC50)为120.4 μM,比小鼠TRPM8(EC50=924.5 μM)和大鼠TRPM8(EC50=1.21 μM)强,eucalyptol的镇痛作用可能是通过表达TRPM8周围神经元的输入,从而激活中央抑制电路。Eucalyptol还可减轻因应用TRPA1激动剂而引起的人体皮肤疼痛。另外,eucalyptol代谢产物2-hydroxyl-1,8-cineol也能激活TRPM8通道,可能会延长eucalyptol的镇痛作用。Eucalyptol有望开发为新型天然长效镇痛剂。
2.5 抗氧化作用
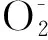
2.6 其他活性
Nameghi等[63]分析E.globules、百里香和薄荷的混合挥发油中主要成分为α-pinene(3.10%)(31)、γ-terpinene(4.49%)(17)、menthone(4.84%)(330)、1,8-cineol(5.70%)(121)、p-cymene(9.25%)(5),thymol(9.40%)(210)、menthol(16.62%)(376)和carvacrol(28.20%)(246),将混合挥发油添加到受试鸡的饮用水中,观察到可明显改善肉鸡的体液免疫力、生长性能、微生物区系和回肠形态,因此,三种植物挥发油可以替代抗生素生长促进剂。Zhou等[69]研究表明经E.globules挥发油(最佳浓度=0.75%)处理砂糖橘后,可有效减少其腐烂损失、降低生理生化反应速率、延缓砂糖橘果实品质的劣变进程,且在贮藏35天后,好果率高达99%,因此E.globules挥发油可作为天然的食品保鲜剂。Qu等[70]报道了α-pinene(31)、γ-terpineol(176)、caryophyllene(405)和jasmone(203)可作为合成香料的原料。其中右旋α-pinene可作为合成terpineol、camphor、dihydromyrcenol等香料的原料,γ-terpineol可作为香料及食用香精增香剂,caryophyllene可以用于合成具有高香料价值的acetyl-caryophyllene、jasmone可作为高级茉莉系列化妆品香精中的原料。
3 结语
桉属植物资源种类丰富,但其化学成分及生物活性的研究还有待更深入的研究。近年来,研究人员对桉属挥发油的化学成分和药理活性等进行了较为广泛的研究,主要含有萜类化合物、脂肪族化合物、芳香族化合物以及其他化合物等,且这些化合物表现出良好的杀虫驱虫、抗菌、消炎镇痛、局部麻醉、抗氧化等广泛的生物活性,另外其还可作为抗生素生长促进剂的替代品,用于砂糖橘的保鲜、以及作为重要的香料等。已发现有一些新颖的萜类活性显著,但更深入的活性机制研究尚未见报道,故展望未来有更多关于桉属发挥油生理作用机制的研究,使桉属能更好地应用于医药、食品、日用化学工业等领域。本课题组致力于桉属植物资源开发与利用,已经取得部分成果,后续将进行更系统的化学成分和生物活性的研究,为桉属的药用资源开发与药效物质基础研究提供更多参考。
——青蒿素

