超声波辅助液-液萃取结合GC检测单萜化合物工艺优化
刘 琦 祝 霞 赵丹丹 王璐璐 韩舜愈 杨学山
(1甘肃农业大学生命科学技术学院,甘肃 兰州 730070;2甘肃农业大学食品科学与工程学院,甘肃 兰州 730070;3 甘肃省葡萄与葡萄酒工程学重点实验室,甘肃 兰州 730070)
品种香气决定了葡萄酒的特点和典型性[1],构成品种香气的物质主要包括萜烯类化合物、降异戊二烯等。其中,单萜化合物感官阈值较低,具有浓郁的花香、果香味[2-3],如芳樟醇具有轻微的柑橘味和淡淡的玫瑰花香,α-萜品醇具有类似紫丁香花香、百合花香,香茅醇具有柠檬和柑橘香,香叶醇具有玫瑰花香,且它们的感官阈值在18~400 μg·L-1,远低于葡萄酒中其他香气物质,是葡萄酒品种香气最主要的贡献者[4-5]。早期研究认为,葡萄酒中的单萜化合物主要来自酿酒葡萄原料本身,而主导葡萄酒发酵的酿酒酵母(Saccharomyces cerevisiae)细胞内不存在单萜合成酶,不能合成单萜化合物[6-7]。但Camesasca 等[8]研究发现酿酒酵母BY4743 菌株可在不含单萜前体物质的模拟葡萄汁中从头合成单萜化合物。此外,Carrau 等[9]将酿酒酵母菌株M522 接种到化学合成的模拟葡萄汁中,发酵结束后在其发酵液中检出了葡萄酒中常见的芳樟醇、α-萜品醇、香叶醇、香茅醇等4种单萜化合物,且适当增加模拟汁中可同化氮含量以及减少发酵过程中通氧量均有利于单萜物质的积累。但酿酒酵母产生的单萜化合物含量较少[8-9],因此,建立准确、高效、重复性高的单萜物质检测方法将有助于进一步深入研究其代谢机制。
气相色谱(gas chromatography,GC)具有操作简单、仪器价格和样品检测费用较低以及易于实现等优点,现已被广泛应用于葡萄酒香气分析领域[10]。通常在气相色谱分析之前需对样品中的香气物质进行富集处理,以满足分析检测,目前主要使用的香气富集方法有顶空固相微萃取 (headspace solid-phase microextraction,HS-SPME)[11]、低沸点有机溶剂的液-液萃取(liquid-liquid extraction,LLE)[12]、固相微萃取[13]等。LLE 主要利用“相似相溶”原理对香气物质进行富集浓缩,由于单萜化合物在有机相中的分配系数较高,因而可用于单萜化合物的萃取研究。Andujar-Ortiz 等[14]结合气相色谱- 质谱联用仪(gas chromatography-mass spectrometer,GC-MS)技术,比较了LLE、固相萃取(solid-phase extraction,SPE)以及HS-SPME 3种前处理方法在葡萄酒香气物质检测中的效果,结果表明,LLE 显现出良好的线性与重复性,萃取效果较好。然而,LLE 也存在一些弊端,如使用有机溶剂量大、操作步骤繁琐且耗时长等[15]。目前,超声波在分离提取研究中应用较多,主要是利用超声波产生的“空化效应、热效应、强化扩散”等多种效应增强萃取过程中的传质作用,增大待分离物质分子运动频率和速度,使目标成分更容易进入溶剂,从而提高萃取效率[16-17]。罗静等[18]利用超声辅助处理提取鲜桃果实中挥发性物质,Porto 等[19]比较单纯浸渍与超声辅助法提取大麻中挥发性萜类化合物,Li 等[20]利用超声辅助法提取葡萄果皮中花青素,上述研究均表明,超声辅助提取能明显提高目标成分的提取含量,大大缩短提取时间。但目前超声波辅助提取技术在葡萄酒香气富集前处理中应用较少。
在葡萄酒发酵过程中,葡萄果实中的单萜化合物前体物质会被酿酒酵母菌株产生的β-糖苷酶水解释放,会对酿酒酵母菌株合成单萜化合物的检测产生影响。故本试验拟采用无糖苷前体的模拟葡萄汁体系,通过单因素及响应面试验优化超声辅助LLE的香气检测前处理工艺,并结合GC 外标定量法,建立一种相对准确、高效、可同时检测多种单萜化合物的方法,探讨酿酒酵母菌株从头合成单萜化合物的能力,旨在为深入研究酿酒酵母菌株单萜化合物合成机制提供理论基础。
1 材料与方法
1.1 试验材料
酿酒酵母菌株LA-FR,购自上海鼎唐国际贸易有限公司。
1.2 试剂与仪器
主要试剂:芳樟醇、α-萜品醇、香叶醇、香茅醇标准品,均购自美国Sigma公司;二氯甲烷,国产色谱纯;NaCl为国产分析纯。
主要仪器:PHS-3C pH 计,上海雷磁有限责任公司;PAL-2数显手持糖度计,日本爱宕ATAGO公司;L550 台式低速离心机,长沙湘仪离心机仪器有限公司;JY96-IIN 超声波细胞粉碎机,宁波新芝生物科技股份有限公司;RE600A型旋转蒸发仪,上海亚荣生化仪器厂;Clarus500 GC-FID,美国PerkinElmer公司。
1.3 试验方法
1.3.1 模拟葡萄汁的配制 参考刘琦等[21]的方法。碳源:葡萄糖200 g·L-1、纤维二糖0.2 g·L-1;氮源:磷酸氢二铵1.5 g·L-1;酸:酒石酸氢钾2.5 g·L-1、L-苹果酸3.0 g·L-1、柠檬酸0.2 g·L-1;矿物质:磷酸氢二钾1.14 g·L-1、硫酸镁1.23 g·L-1,SO2添加量为40 mg·L-1。
1.3.2 酿酒酵母菌株活化与模拟汁发酵 参考王媛等[22]的方法并略做修改。将酿酒酵母干粉溶于10倍体积无菌水中,37℃静置溶解20 min,再加入等体积的模拟葡萄汁于28℃活化25 min,按推荐用量(0.2 g·L-1)将活化好的酿酒酵母菌株接种到模拟葡萄汁中,置于28℃恒温培养箱发酵5 d,待发酵结束后取模拟酒样离心(4 000 r·min-1、15 min),取上清液用于后续试验。
1.3.3 气相色谱- 氢火焰离子化检测器(gas chromatography-hydrogen flame ionization detector,GCFID)分析条件 参考李艳等[10]的方法并略作修改。色谱柱为DB-WAX(60 m×0.25 mm×0.25 μm);载气:氮气,流速2 mL·min-1;升温程序:初始温度为40℃,保持5 min,以15℃·min-1升温至180℃,保持1 min,以15℃·min-1升温至230℃,保持1 min;1 μL 样品分流进样,分流比为5 ∶1;进样口温度:250℃;检测温度:280℃;尾吹:25 mL·min-1;氢气流量:45 mL·min-1,空气流量:450 mL·min-1。
1.3.4 单萜化合物标准曲线的建立 以二氯甲烷为溶剂配制不同种类单萜化合物的标准品溶液,先配制浓度为5 μL·mL-1的母液,再将其用二氯甲烷分别稀释2、10、20、100、200和1 000倍,利用GC-FID 测定相应的峰面积,以标准品质量浓度为横坐标、峰面积为纵坐标绘制标准曲线,试验重复3次。
1.3.5 单萜化合物含量计算 根据GC-FID所测模拟酒样品中芳樟醇、α-萜品醇、香茅醇、香叶醇4种单萜物质的峰面积,结合标准曲线计算得到测定样品中各单萜化合物的含量,并以样品中检出的单萜化合物的总量作为考查指标进行LLE 工艺条件优化。
1.3.6 单因素试验设计
1.3.6.1 超声功率对单萜化合物萃取的影响 取1.3.2 获得的模拟酒样上清液15 mL 于50 mL 锥形瓶中,加入等体积的二氯甲烷和4.5 g NaCl,涡旋震荡5 min,超声萃取15 min,超声功率分别为300、400、500、600 W。然后将萃取体系4 000 r·min-1离心10 min,抽提得到上层水相并重复上述操作进行第二次萃取,合并2次萃取后的有机相,旋蒸(20℃)浓缩至约1 mL,再用二氯甲烷复溶至3 mL,吸取复溶液1 μL进行气相色谱分析。试验重复3次,比较单萜含量,确定较佳超声功率值。
1.3.6.2 超声时间对单萜萃取的影响 取1.3.2 获得的模拟酒样上清液15 mL 于50 mL 锥形瓶中,加入等体积的二氯甲烷和4.5 g NaCl,涡旋震荡5 min,超声萃取,超声功率400 W,超声时间分别为5、10、15、20 min。其余操作同1.3.6.1,比较单萜含量,确定较佳超声时间。
1.3.6.3 NaCl 添加量对单萜萃取的影响 取1.3.2获得的模拟酒样上清液15 mL 于50 mL 锥形瓶中,加入等体积的二氯甲烷,NaCl的添加量分别为3.0、4.5、6.0、7.5 g,涡旋震荡5 min,超声时间15 min,超声功率400 W。其余操作同1.3.6.1,比较单萜含量,确定较佳NaCl 添加量。
1.3.6.4 萃取剂体积对单萜萃取的影响 取1.3.2获得的模拟酒样上清液15 mL 于50 mL 锥形瓶中,分别加入5、10、15、20 mL 二氯甲烷和4.5 g NaCl,涡旋震荡5 min,超声时间15 min,超声功率400 W。其余操作同1.3.6.1,比较单萜含量,确定较佳萃取剂体积。
1.3.7 响应面试验设计 在单因素试验结果的基础上,利用Design-Expert 8.0.6 软件进行响应面试验设计,以单萜含量为响应值,设计4 因素3水平响应面试验进行萃取条件的优化(表1)。

表1 响应面试验因素与水平Table1 Factors and levels of response surface test
1.4 数据处理
利用Microsoft Excel 2010 对试验所得数据进行分析和制图,用IBM SPSS Statistics 20进行显著性分析(Duncan 法,P<0.05),采用Design-Expert 8.0.6 软件进行响应面试验设计及回归分析。
2 结果与分析
2.1 单萜物质的标准曲线
由表2可知,4种单萜化合物标准曲线线性范围满足检测要求,且其决定系数(R2)均在0.996 2~0.999 6 范围内,表明线性关系良好。试验的重复性用相对标准偏差(relative standard deviation,RSD)来表示,4种单萜标准曲线的RSD 在6.35%~10.06%范围内,表明试验重复性较好,可用于这4种单萜物质的定量分析。

表2 单萜物质的GC-FID 分析结果Table2 GC-FID analysis results of monoterpenes
2.2 单因素试验结果与分析
2.2.1 超声功率对单萜化合物萃取的影响 由图1-A可知,随着超声功率从300 W 增大至600 W,单萜含量呈先增加后减小的趋势,且超声功率为400 W时,单萜含量达到最大,为41.003 μg·L-1。超声辅助提取主要是利用超声波产生的机械作用和空化效应促使有效成分进入溶剂,但当超声功率过高时可能会破坏有效成分的结构,同时可能有其他杂质溶入,导致提取效果降低[23-24],因此后续试验的超声功率选择400 W 较适宜。
2.2.2 超声时间对单萜化合物萃取的影响 由图1-B可知,随着超声时间的延长,单萜含量缓慢上升,当超声时间为15 min时,单萜含量最高,但当超声时间超过15 min时,单萜含量降低,这可能是由于超声时间过长,超声过程中产生的热量导致溶液温度升高,增加了单萜物质的挥发,从而造成检出的单萜含量降低,所以后续试验的超声时间选择15 min 较佳。
2.2.3 NaCl 添加量对单萜化合物萃取的影响 在LLE 过程中添加无机盐是常见的提高萃取效率的措施,无机盐在水相中以水合离子的形式存在,促使水相中微量的香气物质进入有机相,从而提高萃取效果[25-26]。由图1-C可知,当NaCl 添加量从3.0 g 增加至4.5 g时,单萜含量增加了91.27%,当继续加大NaCl 添加量,单萜含量变化较小。添加适量的NaCl能明显提高萃取效果,这主要是由于中性盐溶于水相后形成的阴阳离子会破坏香气物质在水相中的溶解平衡,降低其在水相中的溶解度,且NaCl 溶于水会增加溶液的极性,促使水相中极性较低的香气物质聚集和释放[27-28]。当添加4.5 g NaCl时,溶液已接近饱和状态,继续添加NaCl 对萃取效率提升较小,因此萃取过程中添加4.5 g NaCl 较为合适。
2.2.4 萃取剂体积对单萜化合物萃取的影响 由图1-D可知,单萜含量随萃取剂体积的增加而迅速升高,且当二氯甲烷体积为15 mL时单萜含量最高,此时单萜含量为43.15 μg·L-1,当二氯甲烷体积超过15 mL时,单萜含量出现略微下降,这可能是由于LLE的步骤较多,且二氯甲烷沸点低、易挥发,随着萃取剂体积的增加,萃取过程中溶剂损失也随之增加,导致可检测出的单萜含量减少,因此选择二氯甲烷体积为15 mL较为适宜。

图1 单因素试验结果Fig.1 Results of the single factor test
2.3 响应面法优化LLE 工艺
2.3.1 响应面试验结果 以单因素试验结果为基础,通过响应面试验优化模拟酒样中单萜化合物的萃取工艺,响应面的具体因素水平组合及试验结果如表3所示。
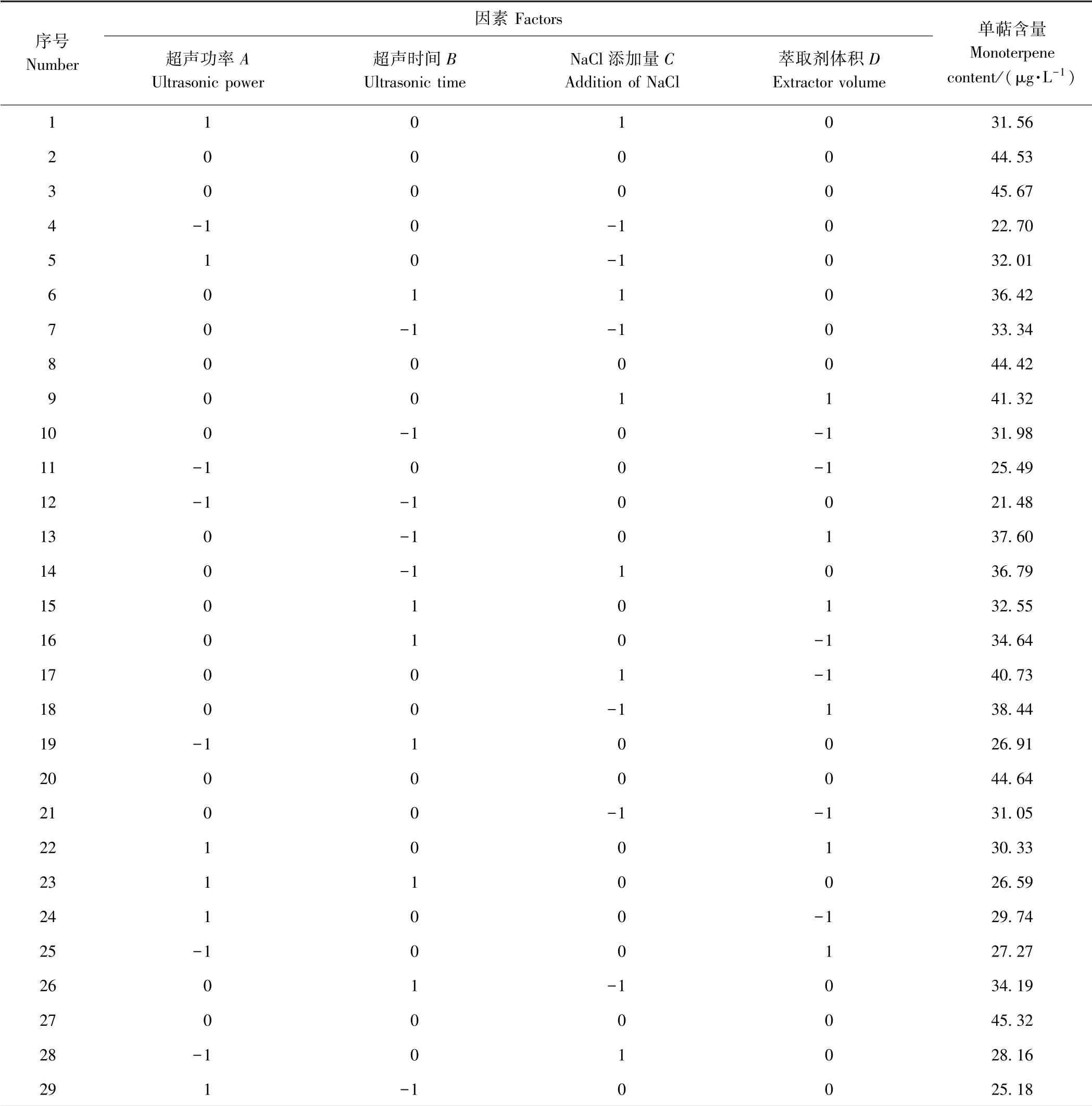
表3 响应面试验设计及结果Table3 Response surface test design and results
2.3.2 响应面回归模型的方差分析及显著性检验 利用Design-Expert 8.0.6 软件对表3所得结果进行回归建模分析,并对所得回归模型做方差分析及显著性检验,结果如表4所示,其中交互项AB、AC、AD、BC的P值均大于0.05,说明它们之间的交互作用不显著,属于模型中的冗余参数,因而需对回归模型进一步优化。回归模型经逐步优化后得到表5,相比优化前的回归模型,其矫正决定系数变大,变异系数变小,表明模型更优,对试验结果的拟合度更高。由表5和表6可知,模型通过检验(P<0.000 1),具有统计学意义。模型失拟项不显著,即试验中的数据可以用模型来解释。决定系数R2=0.970 7,矫正决定系数表明回归方程对该试验数据的拟合度较高,能解释试验中97.07%的全部变异进一步说明该模型具有良好的可信度,因而可利用该模型进行LLE的工艺参数优化。经回归建模分析,最终得到的响应面回归方程为Y= - 356.263 + 1.108A+ 9.361B+21.187C+ 7.010D-0.010AC-0.077BD-0.227CD-0.001A2-0.271B2-1.395C2-0.153D2,由回归分析结果可知,4个因素对萃取效率影响的主次顺序为超声功率>NaCl 添加量>萃取剂体积>超声时间。
2.3.3 响应面交互作用分析结果 响应面分析图中,颜色从蓝色到红色变化表示单萜含量从低到高,响应面为凸面表示试验指标具有最大值,响应面坡度越大,即因素对试验结果的影响越显著;等高线的形状可直观反映因素间交互作用的强弱,椭圆表示因素间交互作用较强,接近圆形则表示因素间交互作用较弱[29-30]。图2-a 沿A 轴方向较陡,沿C 轴方向较为平缓,表明与NaCl 添加量相比,超声功率对单萜含量影响更大,且在不同NaCl 添加量的条件下,超声功率变化对单萜含量影响较小,即超声功率与NaCl 添加量2个因素间的交互作用较弱。由图2-b可知,随着超声时间的延长,单萜含量呈先增大后减小的趋势,并在15 min 附近具有最大值。当萃取剂体积增加到约15 mL时,单萜含量达到最大值,继续增加萃取剂体积,单萜含量变化较小。在不同超声时间下,萃取剂体积对单萜含量影响较大,即超声时间和萃取剂体积间的交互作用较强。由图2-c可知,NaCl 添加量和萃取剂体积对单萜含量影响的趋势相似,均对单萜含量影响较大,等高线为椭圆,说明二者交互作用明显,且响应图中所反映的因素间的交互作用与回归方程的显著性分析结果一致。

表6 回归模型可信度分析Table6 Confidence analysis of regression model
2.3.4 响应面工艺优化与验证试验 对回归方程进行最大值求解得到最优工艺参数,为了验证回归模型所确定的最优条件的正确性,结合实际操作对最优参数略作调整后进行3次验证试验,验证试验所得单萜含量为44.06 μg·L-1,与理论预测值相近,误差较小(表7)。由此可见,该回归模型所优化的工艺参数具有较高的可行性,可应用于实际萃取。

表7 最优工艺参数及验证试验结果Table7 Optimal process parameters and results of verification tests
3 讨论
定性定量分析依旧是葡萄酒香气研究的热点与难点,尽管现已开发出多种新型香气富集设备和方法,但各有优缺点。LLE 作为一种传统技术在挥发性物质萃取中已有广泛应用。牛云蔚等[31]比较了LLE、搅拌棒吸附萃取HS-SPME3种香气富集方法对樱桃酒香气成分的影响,结果表明,用3种方法萃取后经GC-MS 检出的香气物质差异较大,其中HS-SPEM处理后检出的香气物质总量最高,LLE处理后检出的香气物质种类最多。Ivanova 等[32]通过LLE 结合GC-MS 技术建立了一种分离和检测葡萄酒中挥发性成分的分析方法,利用该方法绘制的标准曲线R2在0.995 1~0.999 2范围内,且样品检测RSD<10%,表明该方法重复性较好。Cabredo-Pinillos 等[33]在进行葡萄酒中挥发性化合物的提取研究中比较己烷、石油醚、戊烷、二氯甲烷和乙醚5种有机溶剂的萃取效果,其中二氯甲烷萃取效果最佳。此外,不同溶剂在萃取过程中基质效应差异较大,对目标物质分析产生的干扰也明显不同,影响分析结果的准确性[34]。二氯甲烷与单萜化合物极性相似,萃取过程中产生的基质效应较弱,当选用乙醇、丙酮、石油醚等溶剂萃取时,基质效应较强,导致萃取效果不佳,因此本研究选择二氯甲烷作为单萜化合物的萃取剂。

图2 各因素间交互作用对单萜含量影响的响应面Fig.2 Response surface of interaction between various factors on monoterpene content
前人研究表明,葡萄酒中的单萜化合物绝大部分来自葡萄果实中以糖苷态形式存在的单萜前体物质,在发酵过程中经酿酒酵母产生的糖苷酶将其水解并释放[1,35]。近年来有文献报道,葡萄酒中的单萜化合物并非只来自葡萄原料本身,酵母细胞也可能合成少量单萜化合物。早前有学者指出,仅有几种非酿酒酵母(non-Saccharomyces cerevisiae)可以合成微量单萜化合物,如乳酸克鲁维酵母(Kluyveromyces lactis)、戴尔有孢圆酵母(Torulaspora delbrueckii)、柠檬形克勒克酵母(Kloeckera apiculata)、美极梅奇酵母(Metschnikowia pulcherrima)等[9]。原苗苗等[36]在模拟葡萄汁中比较了3株非酿酒酵母的产香特性,在其发酵液中共检测出7种单萜化合物,表明非酿酒酵母确实能从头合成单萜化合物,且不同非酿酒酵母合成单萜化合物的能力也有差异,其中浅白隐球酵母产单萜能力最强,在其发酵液中共检测到0.70 mg·L-1的单萜化合物;此研究选用的对照菌株为酿酒酵母DV10,在其发酵液中也检测到单萜化合物,且单萜物质的含量高于3种非酿酒酵母,所以酿酒酵母也可以从头合成单萜物质。在本研究中检测到44.06 μg·L-1的单萜化合物,进一步证实酿酒酵母菌株可以从头合成单萜化合物,但酿酒酵母合成单萜化合物的合成途径与内在机制尚不清楚。Carrau 等[9]在研究酿酒酵母合成单萜化合物时发现,酿酒酵母细胞内存在与甲基巴豆酰-CoA 羧化酶(methyl crotonyl-CoA carboxylase,MCC)具有同源性的几种蛋白序列,该酶是亮氨酸分解代谢以及单萜化合物合成的关键酶,对酿酒酵母蛋白质序列进行Blast 比对发现,酿酒酵母细胞中确实存在与其他物种MCC 同源的蛋白序列,因而推测酿酒酵母合成单萜化合物可能与其细胞内亮氨酸分解代谢有关,但该途径尚未得到进一步证实。此外,酿酒酵母还具有代谢补充单萜的能力,如香叶醇可在发酵过程中转化为香茅醇,香茅醇可转化为芳樟醇,少量香叶醇也可异位成芳樟醇[37-38],还有文献报道,芳樟醇可环化成α-萜品醇,橙花醇可异构成香叶醇和α-萜品醇等[39]。因此本研究在模拟葡萄汁中检出的单萜化合物可能有不同的来源,有些单萜可能是酵母从头合成,有些单萜可能是其他单萜经酿酒酵母生物转化而来,酿酒酵母菌株合成与转化单萜化合物的内在机制尚不清楚,有待后续深入探究。
4 结论
本试验利用气相色谱建立了芳樟醇、α-萜品醇、香叶醇、香茅醇4种单萜化合物的标准曲线,通过单因素和响应面试验对模拟酒中单萜化合物的萃取工艺进行优化,得到的最优萃取工艺参数为:超声功率405 W,超声时间15 min,NaCl 添加量4.9 g,萃取剂体积15.5 mL,在此条件下结合GC检测,建立了一种相对高效且准确性、重复性高的单萜化合物检测方法。利用本试验建立的方法,在模拟葡萄酒中检测到有少量单萜化合物生成,证实了LA-FR 酿酒酵母菌株可以从头合成单萜化合物,进而为深入研究单萜化合物合成机制奠定了一定的理论基础。

