铀污染对土壤酶活性及微生物功能多样性的影响
肖诗琦 陈晓明 戚 鑫 田 甲 董发勤 黄 森 勾家磊
(1西南科技大学生命科学与工程学院,四川 绵阳 621010;2西南科技大学核废物与环境安全国防重点学科实验室,四川 绵阳 621010)
随着核技术的快速发展,铀矿的开采与冶炼活动所产生的废石和尾砂中含有放射性物质和重金属,在雨水或山洪的冲刷及风化作用下很容易转移扩大,给人类健康和生态环境造成不利影响[1]。近年来,有关铀的研究大都集中在铀污染土壤的植物修复,并取得了显著成果,主要集中于富集植物的筛选[2-3],而对土壤生态环境的监测、评价方法方面的研究较少。
酶是土壤的重要组成部分,也是土壤生态系统的核心之一[4],直接参与土壤系统中的多种重要代谢过程。研究表明,土壤酶活性与重金属污染程度存在一定的相关性。因此,土壤酶活性可作为判别重金属污染程度的指标之一[5-7]。土壤微生物是土壤生态系统的重要组成部分,在土壤养分转化、能量循环过程中发挥着重要作用[8]。土壤微生物对重金属污染的响应较同一环境中的动、植物更敏感,能及时准确预测土壤养分及环境质量的变化,反映土壤的污染状况,是评价土壤环境质量最有潜力的指标[9-10]。但目前相关研究多集中在铅、铜、锌、镉[11-13]等重金属对土壤酶活性及微生物的影响,对铀污染的研究较少。
因此,本研究采用室内模拟试验,考察与土壤碳、氮、磷、硫循环相关的关键酶(土壤纤维素酶、亚硝酸还原酶、碱性磷酸酶、芳基硫酸酯酶)活性对铀污染的响应,探讨铀对不同土壤功能酶活性的作用,并采用Biolog-ECO 生态板[14]考察不同浓度铀污染后土壤微生物群落功能的差异及对碳源特异利用的情况,以期为评价土壤铀污染状况和土壤修复提供理论依据。
1 材料与方法
1.1 试验材料
供试土壤为暗棕壤,采自西南科技大学校园,其基本理化性质:pH值6.98、含水量19.87%、有机质14.85 g·kg-1、全氮1.68 g·kg-1、全磷0.67 g·kg-1、全钾12.57 g·kg-1、有效磷13.42 mg·kg-1、铀浓度1.24 mg·kg-1。
1.2 试验设计
土样采样:在1 m2内采用5 点法采样,采样时先铲去地表植物,刮掉5 mm 厚的表层土壤,挖成直径为20 cm的土坑,取样深度为6~10 cm。土壤采集后过40 目筛,去除杂质,备用。
铀浓度设置:选用醋酸双氧铀[UO2(CH3COO2)2·2H2O,分析纯,湖北楚胜威化工有限公司],以纯铀计,配制成1 g·L-1铀溶液并以其为母液,备用。
试验设置:采用培养皿培养样品,每个培养皿中25 g 土样。将外源铀浓度分别设为10、20、50、100、150 mg·kg-1(干土),以原始土壤作为空白对照。25℃下培养,土壤含水量保持在田间持水量的60%,每个处理设3个重复。分别在处理后第7、第15、第30、第60天测定土壤酶活性,在处理后第60天采用Biolog-ECO 板考察土壤微生物功能多样性。
1.3 测定指标与方法
1.3.1 土壤酶活性测定 碱性磷酸酶活性采用磷酸苯二钠比色法测定[15],其活性用24 h后1 g 干土中释放出酚的毫克数表示。亚硝酸还原酶活性采用比色法测定[16],其活性用1 g 干土24 h后剩余NO2--N 毫克数表示。芳基硫酸酯酶活性采用比色法测定[17],其活性用1 g 干土1 h 生成对硝基苯酚(C6H5NO3)微克数表示。纤维素酶活性采用硝基水杨酸比色法测定[15],其活性用1 g 干土1 h 生成葡萄糖微克数表示。每个处理重复测定3次,设无底物、无土壤处理作为空白对照。
1.3.2 土壤微生物群落功能多样性测定 选取铀处理60 d后土壤进行Biolog-ECO 板接种与培养。称取10 g 土壤样品,加入装有90 mL 0.85%无菌生理盐水的三角瓶中,在摇床上以200 r·min-1振荡30 min,即成土壤菌悬原液。将该原液连续2次10倍稀释,最终稀释比例为1 ∶1000。取稀释好的溶液置于无菌Ⅴ型槽,接种于ECO 板的96 孔中,每孔150 μL,每个浓度重复3次。将接种好的ECO 板放到铺有6 层纱布的白瓷盘中,为防止ECO 板孔中菌悬液的挥发,纱布需保持一定湿度。将ECO 板置于30℃培养箱培养,分别于培养0、24、48、72、96、120、144、168 h时,用Gen ⅢMicro Station 自动快速微生物鉴定仪(美国Biolog公司)在590 nm和750 nm 波长处读取吸光度值。
微生物代谢活性用590 nm 波长处的吸光度值减去750 nm 波长处的吸光度值表示,其中数值小于0.06的按0处理[18]。微生物代谢强度用孔的平均颜色变化率(average well color development,AWCD)[19]表示,通过AWCD值分析不同浓度铀处理下微生物对每一类碳源的利用情况:
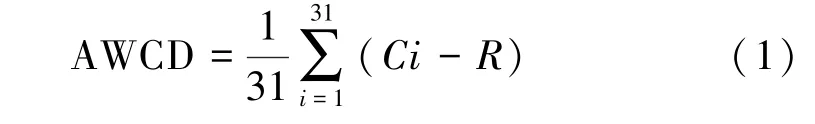
式中,Ci为每个碳源孔的两波段吸光值差;R为对照孔的吸光值;31为培养基碳源种类数。
多样性指数包括Shannon 多样性指数[19](H),Simpson 优势度指数[20](D)和McIntosh 指数[21](U),分别表征微生物群落丰富度、优势度和均匀度,其中,U是基于群落多维空间上的Euclidian 距离的多样性指数,计算公式如下:
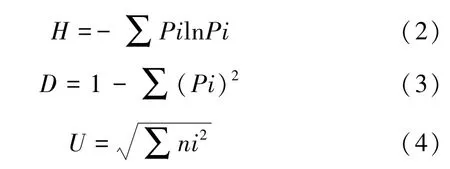
式中,Pi=(Ci-R)/AWCD;ni=Ci-R。
1.4 数据处理
试验数据采用Microsoft Office Excel 2007和DPS 7.5进行处理和分析,多重比较采用Tukey 法进行处理间平均值的差异显著性检验,试验数据采用Origin 8.5 软件作图。
2 结果与分析
2.1 铀污染对土壤酶活性的影响
2.1.1 铀污染对土壤芳基硫酸酯酶活性的影响 芳基硫酸酯酶参与土壤和植物的硫素循环,可将土壤中的有机态硫转化成可供植物吸收的无机态硫。由图1可知,在各处理周期,芳基硫酸酯酶活性均随着铀浓度升高而逐渐下降。当铀浓度高于20 mg·kg-1时,各处理组芳基硫酸酯酶活性均显著低于对照(0 mg·kg-1),同时高浓度(100和150 mg·kg-1)铀处理组酶活性显著低于其余各铀处理组。在不同处理周期中,150 mg·kg-1铀处理组酶活性均最低,分别为对照的44.31%、35.85%、28.13%和39.21%,当铀处理30 d时,铀污染对酶活性影响最大,此时酶活性仅为1.117 μg·g-1·h-1。由此可见,铀对芳基硫酸酯酶活性有显著的抑制作用,其酶活性随着铀浓度升高而逐渐降低。
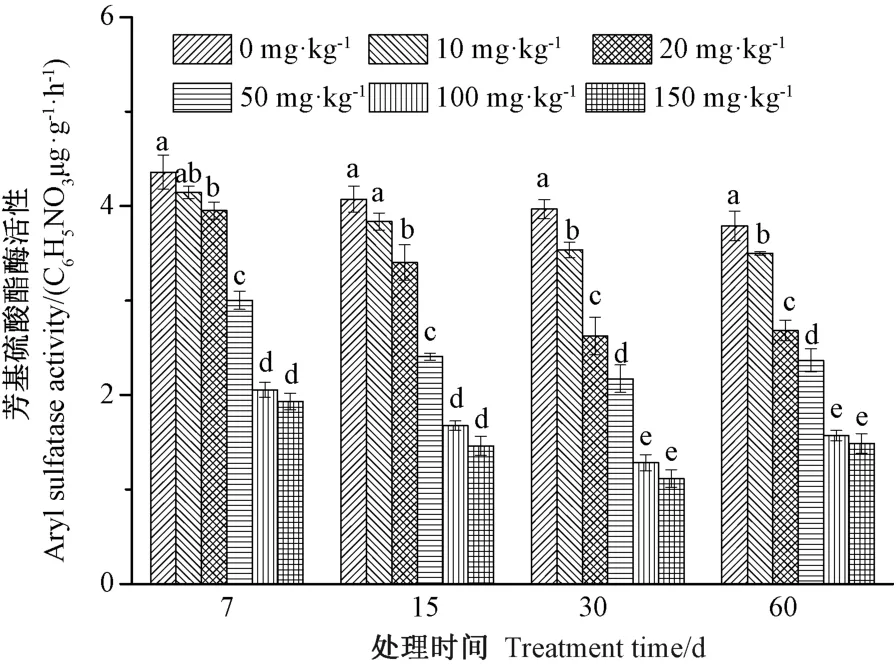
图1 铀污染对土壤芳基硫酸酯酶活性的影响Fig.1 Effect of uranium on soil aryl sulfatase activity
2.1.2 铀污染对土壤碱性磷酸酶活性的影响 土壤磷酸酶是一类催化土壤有机磷化合物矿化的胞内酶,能促进有机磷向无机磷转化,形成有利于植物吸收的无机磷,其活性直接影响土壤有机磷的分解转化及生物有效性。由图2可知,同一处理周期内,不同浓度铀处理组碱性磷酸酶活性与对照(0 mg·kg-1)相比,均呈浓度梯度下降趋势。其中,土壤受到较高浓度(50、100和150 mg·kg-1)的铀污染后,碱性磷酸酶活性显著低于对照。在相同浓度铀处理下,随着处理时间的延长,高浓度铀处理组(100和150 mg·kg-1)碱性磷酸酶活性在60 d时较30 d 高,其余各铀处理组土壤碱性磷酸酶活性均呈下降趋势。综上所述,低浓度铀处理对碱性磷酸酶活性无显著影响,而高浓度铀处理对该酶活性具有显著的抑制作用。同时,随着铀处理时间的延长,高浓度铀处理组土壤碱性磷酸酶活性有所回升。
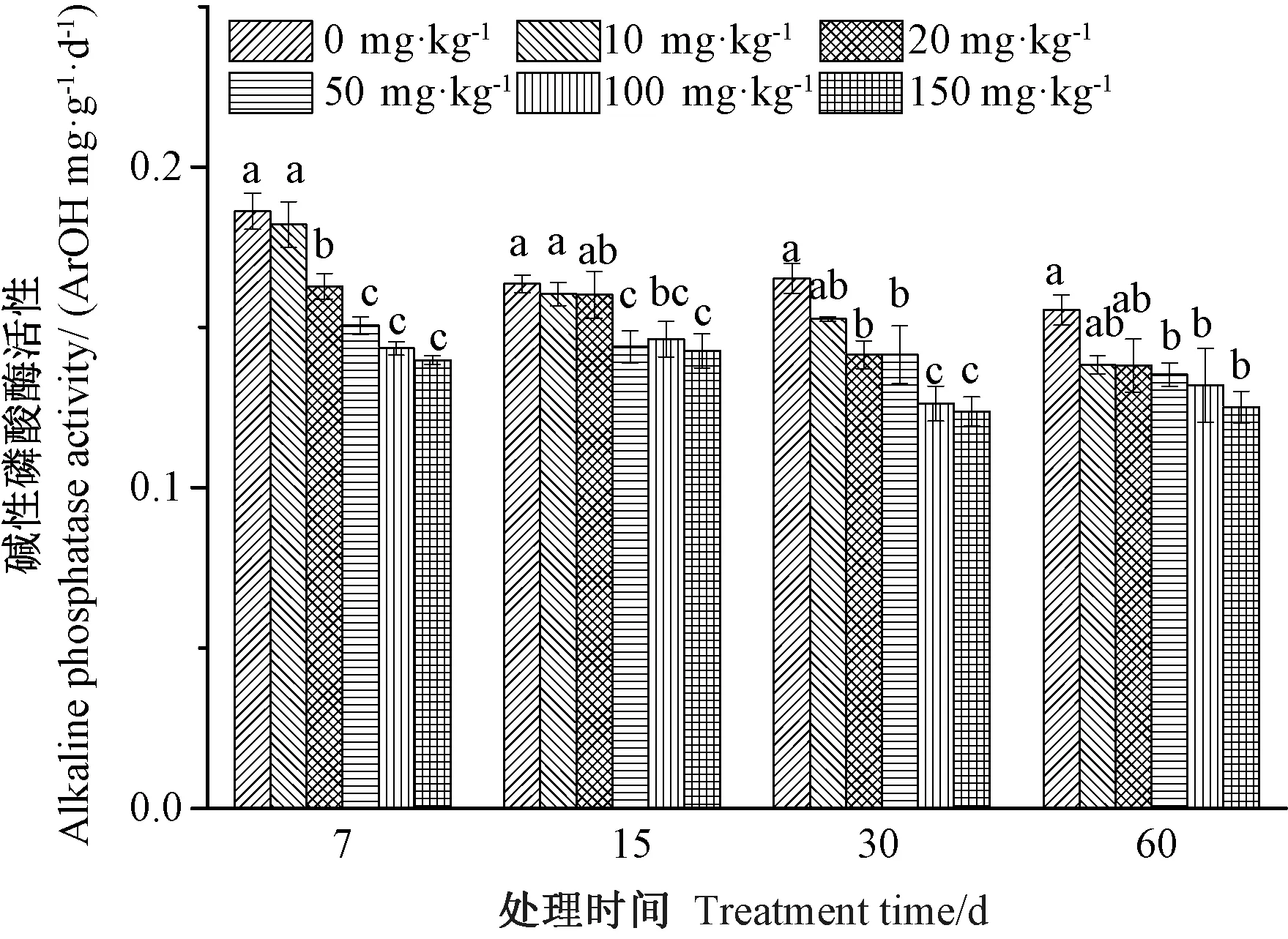
图2 铀污染对土壤碱性磷酸酶活性的影响Fig.2 Effect of uranium on soil alkaline phosphatase activity
2.1.3 铀污染对土壤亚硝酸还原酶活性的影响 土壤亚硝酸还原酶能促进土壤硝态氮还原成氨,其活性可反映土壤氮素转化中脱氮作用的强度。由图3可知,在各处理周期中,亚硝酸还原酶活性均随着铀浓度升高呈先上升后下降的趋势。铀处理第7天,20 mg·kg-1浓度铀处理组酶活性最大,为0.699 2 mg·g-1·d-1。当铀浓度超过50 mg·kg-1,土壤亚硝酸还原酶受到显著抑制,其中铀处理第30天,150 mg·kg-1铀处理组酶活性受到的抑制作用最大,为对照(0 mg·kg-1)的80.7%。此外,随着铀处理时间的延长,亚硝酸还原酶活性呈整体下降趋势,但受到的抑制作用逐渐减弱,如铀处理后第60天,150 mg·kg-1铀处理组酶活性为对照的82.4%。
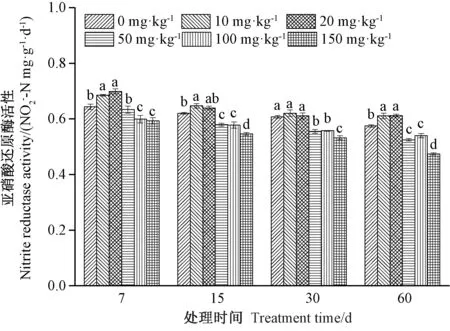
图3 铀污染对土壤亚硝酸还原酶活性的影响Fig.3 Effect of uranium on soil nitrite reductase activity
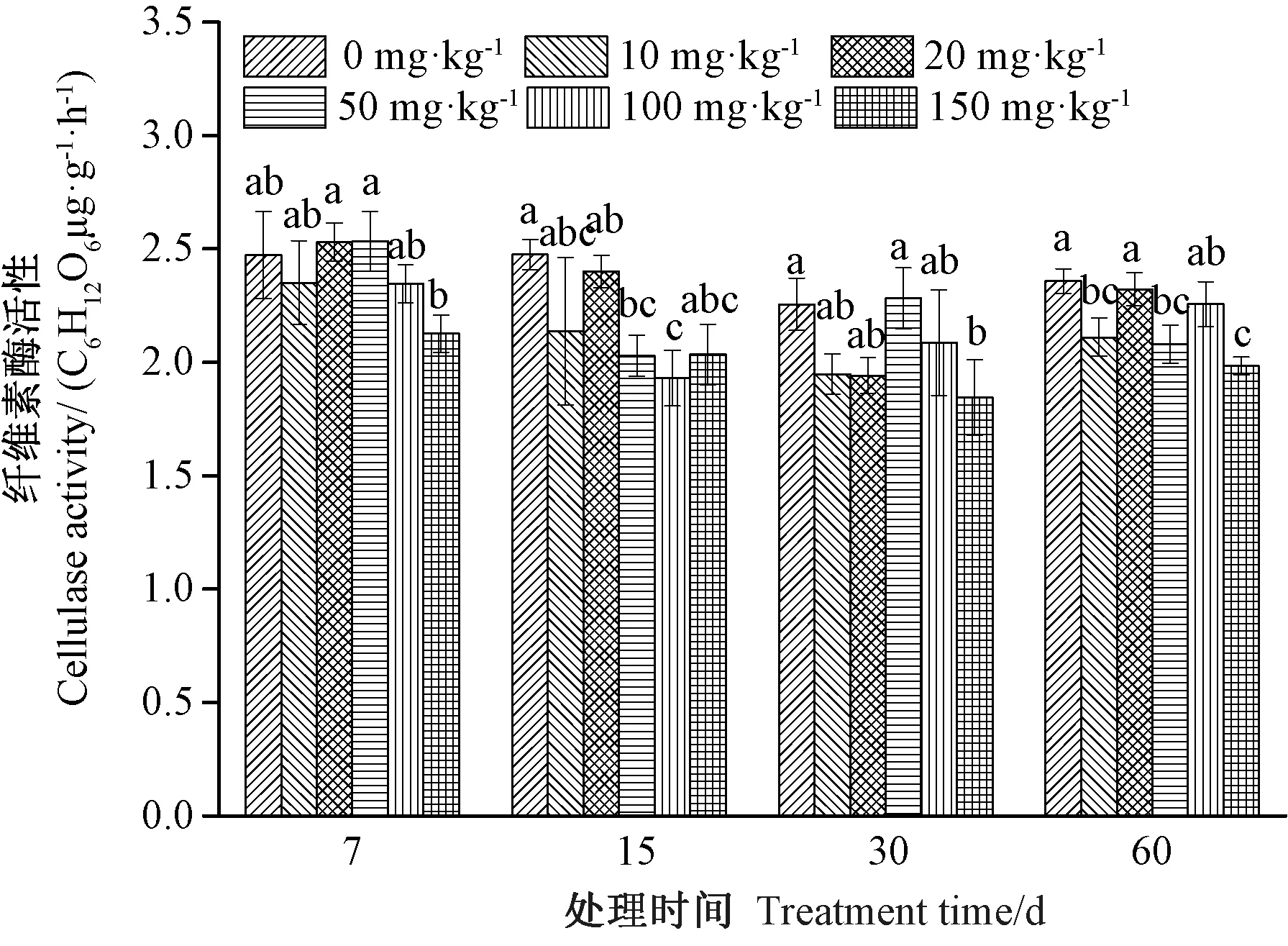
图4 铀污染对土壤纤维素酶活性的影响Fig.4 Effect of uranium on soil cellulase activity
2.1.4 铀污染对土壤纤维素酶活性的影响 土壤纤维素酶是参与纤维素循环的关键酶,对土壤有机质的循环起重要作用。由图4可知,铀处理浓度为10 mg·kg-1时,纤维素酶活性较对照(0 mg·kg-1)低,且在处理后第60天差异显著;而当铀处理浓度为20 mg·kg-1时,纤维素酶活性有所回升,并在处理后第7天较对照酶活性高;当铀污染浓度达到50 mg·kg-1时,纤维素酶活性在处理后第7和30天时较对照高,但在铀处理后的第15和第60天显著低于对照;当铀浓度达到100和150 mg·kg-1时,不同处理周期下的酶活性均低于对照,其中铀处理后第30和第60天,150 mg·kg-1铀处理组与对照差异显著。由此可知,中低浓度铀处理未明显抑制纤维素酶活性,高浓度铀处理对该酶活性有抑制作用。
2.2 铀污染对土壤微生物功能多样性的影响
2.2.1 铀污染对土壤微生物代谢活性的影响 AWCD值用以衡量微生物利用不同碳源的整体能力,一般认为幅度变化较大的样品具有较高的碳源利用能力,也具有较高的微生物丰度[22]。由图5可知,各铀处理浓度的AWCD值在接种培养后24 h 内几乎无增长,而在24~144 h时AWCD值迅速升高,表明此阶段土壤微生物碳源代谢活性最强,之后该值趋于平稳。与对照(0 mg·kg-1)相比,各铀处理组的AWCD值均明显降低,且铀处理浓度越高其AWCD值越低,表明铀污染能明显降低土壤微生物代谢活性。
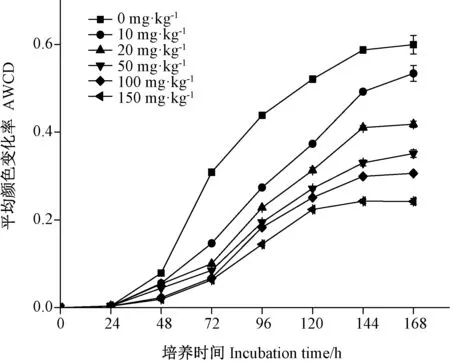
图5 铀污染下土壤微生物的AWCD值的变化Fig.5 AWCD value changes of soil microbes under uranium stress
2.2.2 铀污染对土壤微生物功能多样性的影响 根据ECO 板培养72 h的AWCD值进行微生物多样性分析。由表1可知,不同浓度铀处理组的3种指数均显著低于对照(0 mg·kg-1),表明铀处理显著降低了土壤微生物丰富度和均匀度,且优势物种地位削弱。对不同浓度铀处理组,U的变化呈现浓度梯度效应,即随着铀浓度升高微生物均匀度显著降低。而根据H和D可知,20 mg·kg-1铀处理组微生物群落优势度及丰富度均显著低于50和150 mg·kg-1铀处理组。

表1 不同浓度铀处理下土壤微生物多样性指数Table1 Diversity index of soil microbial community in different uranium concentration treatments
2.2.3 铀污染对土壤微生物碳源利用的影响 ECO板上的31种碳源可分为六大类,分别是碳水化合物类、多聚物类、酚酸类、羧酸类、氨基酸类和胺类。由图6可知,对照(0 mg·kg-1)土壤微生物对各类碳源利用能力不同,对胺类碳源利用能力最高,对羧酸、多聚物、氨基酸、酚酸和碳水化合物类碳源的利用能力逐渐降低。土壤受到不同浓度铀处理后,微生物对六大类碳源的利用能力均较对照显著降低(除10 mg·kg-1铀处理后微生物对氨基酸的利用能力)。对胺类和酚酸类碳源的利用能力随铀浓度升高呈梯度下降趋势,并对酚酸类碳源利用能力影响最大,其最高浓度铀处理的AWCD值仅为对照的19.98%。10 mg·kg-1铀处理组微生物对多聚物类碳源利用能力最高;50、100和150 mg·kg-1铀处理组微生物对羧酸类碳源利用能力均最高。
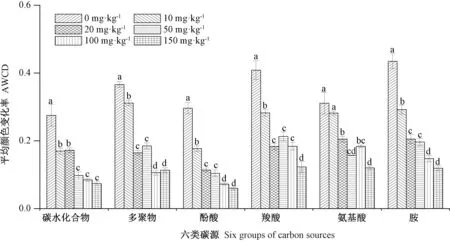
图6 铀污染下土壤微生物对六类碳源的利用情况Fig.6 Utilization of 6 groups of carbon sources by soil microbes under uranium stress
2.2.4 铀污染对土壤微生物碳源利用影响的主成分分析为进一步研究不同浓度铀处理下土壤微生物的碳源利用能力差异,对各处理土壤培养72 h后其31类碳源的AWCD值进行碳源利用主成分分析(principal component analysis,PCA)。由图7可知,第1主成分(PC1)贡献率为41.96%,第2主成分(PC2)的贡献率为24.54%。6种处理在PC 轴上分布有明显差异,U10、U20、U50、U100、U150位于第一象限,U0位于第四象限。主成分分析中样本距离表示样本间相似程度,距离越近相似程度越高。U50、U100和U150 微生物群落较近,碳代谢差异较小,而U0 与各铀处理组距离均较远,表明铀处理明显影响了土壤微生物对碳源利用能力。
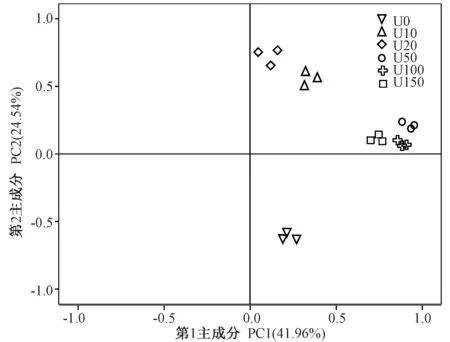
图7 铀污染下土壤微生物碳代谢主成分分析Fig.7 Principal component analysis of carbon metabolism of soil microbial under urnium stress
土壤微生物代谢中31种碳源在PC1和PC2 上的载荷表明,对PC1 贡献较大的碳源(特征向量大于0.6)主要有D-木糖、D-半乳糖醛酸、D-纤维二糖、α-D-葡萄糖-1-磷酸等13种;对PC2 贡献较大的碳源主要有D-半乳糖酸内脂、i-赤藓糖醇、N-乙酰-D-葡萄糖胺等9种(表2)。不同浓度铀处理土壤微生物代谢功能群落结构的差异性主要取决于PC1(13种)和PC2(9种)中载荷较高的碳源。
3 讨论
土壤酶活性是土壤生物学活性的体现,其活性能直接反映土壤综合肥力特征和生物化学过程的强度及方向[23]。土壤中一些酶活能敏感地反映重金属对土壤的污染程度,因此常作为评价土壤污染程度的生化指标[24-25]。本研究中,随着铀浓度的升高,土壤碱性磷酸酶和芳基硫酸酯酶活性均呈下降趋势。铀对磷酸酶和芳基硫酸酯酶活性抑制作用的机理主要是由于六价铀酰离子(UO22+)性质类似于Ca2+和Mg2+,同时形成的复合物更加稳定,因此可以替换磷酸化合物中的Mg2+与磷酸形成沉淀,从而导致磷酸酶活性的降低[26];其次铀污染了土壤微生物的生存环境,从而抑制土壤微生物的生长和繁殖,减少了其体内酶的合成和分泌,最终导致相关酶活性下降。而亚硝酸还原酶和纤维素酶活性仅受到高浓度铀污染的抑制,其中亚硝酸还原酶在中等污染程度以下的土壤中表现为激活效应。这可能是由于铀作为酶的辅基能促进酶活性中心与底物间的配位反应,使酶分子及其活性中心保持一定的专性结构,改变酶催化反应的平衡性质和酶蛋白的表面电荷,从而提高了酶活性,也可能是在铀污染下,某些对铀具有耐性的微生物群落成为优势群落,从而提高其相关酶的合成及分泌[27]。但重金属激活作用具有一定的浓度限值,当铀浓度较高时,会表现出对酶的抑制作用。

表2 土壤微生物代谢中31种碳源主成分分析Table2 Loading factors of PC1 and PC2 indicating utilization of 31 types carbon sources of soil microbes
本研究结果表明,在不同处理周期中,碱性磷酸酶、亚硝酸还原酶和芳基硫酸酯酶活性均受到抑制,但在第30天时抑制作用最强。这可能是由于重金属进入土壤后,对微生物的作用主要在早期阶段,随着处理时间的延长,重金属的生物可利用性降低[28]。本试验中,土壤酶对铀的敏感性表现为芳基硫酸酯酶>碱性磷酸酶>亚硝酸还原酶>纤维素酶,不同的土壤酶对铀敏感性存在明显差异,其中芳基硫酸酯酶活性对铀污染最敏感,表明该酶活性能够灵敏反映铀对土壤的污染程度。
Biolog-ECO 法是通过微生物对多种碳底物的不同利用类型来反映微生物群落的功能多样性,能深入了解微生物群落的结构组成[29]。本研究中,土壤受到铀污染后微生物活性受到一定的抑制,且铀处理浓度越高微生物活性越低。王佳等[30]对美洲商陆根际微生物的研究表明,根际微生物在受到铀污染后微生物群落功能多样性、均匀度及优势度均降低。本研究结果与之相似,铀处理后微生物多样性指数(H)、优势度指数(D)及均匀度指数(U)均较对照显著降低。但20 mg·kg-1铀处理组微生物丰富度较高浓度铀处理组低(50、150 mg·kg-1)。宋收[31]对铀污染后微生物群落结构分析也发现,土壤受到20 mg·kg-1铀处理后,微生物群落多样性和丰富度较对照和高浓度铀处理组明显降低。Frossard 等[32]对汞污染区研究同样发现,中、高汞污染区的微生物多样性和丰富度较低汞污染区高。这可能是因某些重金属在较低浓度时对微生物多样性影响更大,但其作用机理尚不明显确。
本研究对六大类碳源利用情况分析可知,不同浓度铀处理组六大类碳源的AWCD值大体均较对照显著降低,表明铀污染严重影响了土壤微生物对碳源的利用能力。随着铀浓度升高,土壤微生物对酚酸类和胺类碳源利用能力呈梯度下降,这与张倩等[33]对铀矿区土壤微生物研究结果相似。有研究表明,重金属污染会改变土壤微生物种群结构,刺激土壤中产生耐重金属的优势菌群,这些优势菌群对某类碳源具有偏嗜性,导致对这类碳源化合物的利用能力提高[34]。微生物群落对不同类型碳源利用能力的改变可能是铀污染抑制了对铀敏感微生物群落的生长,而某些对铀具有耐性的群落成为优势群落。因此,随着微生物群落组成改变,新优势菌群的出现改变了土壤微生物对碳源利用的偏嗜性。总体而言,铀污染降低了土壤微生物对不同类碳源的利用能力,尤其对以酚酸类碳源为代谢基质的微生物群落的碳源利用能力影响最大,因此微生物对酚酸类碳源的利用能力可用于反映土壤微生物受铀污染的程度。
4 结论
本研究考察了铀污染对土壤酶活性和土壤微生物群落的影响,结果表明,土壤酶活性对铀污染响应不同,其中芳基硫酸酯酶对铀污染最敏感。Biolog 分析结果表明,铀处理后微生物的群落丰富度、均匀度及优势度指数均显著低于对照,铀污染对微生物代谢活性及碳源利用能力均有显著抑制作用。基于Biolog-ECO技术结合数学统计分析方法可以直观、快捷地反映土壤微生物的功能多样性,同时考察与土壤功能相关的关键酶对铀污染的响应,能很好地评估铀污染对土壤生态的影响,为修复铀污染生态环境提供理论依据。

