烟管头草的化学成分及其细胞毒活性
冯树慧,张卫青,孙 茂,郭洪位,孙贵萍,朱成光,王天元*,晏 晨*
1贵州中医药大学,贵阳 550002;2安顺市人民医院,安顺 561000
烟管头草(Carpesiumcernuum)为菊科(Asteraceae)天名精属(CarpesiumL.)多年生草本,主要分布在东北、华北、华中、华东、华南、西南各省及西北陕西、甘肃等地,特别是我国四川、贵州等山区资源丰富,生于路边荒地及山坡、沟边等处。烟管头草在民间用于治疗带状疱疹、流行性腮腺炎、口腔糜烂、三叉神经痛、毛囊炎、扁平疣、流行性急性病毒性结膜炎、毒蛇咬伤等疾病[1]。天名精属植物中主要含有倍半萜、单萜、二萜、三萜、酚类、黄酮类、香豆素、木脂素、甾体等类型的化合物[2,3]。其中以倍半萜类化合物最具代表性,也是该属植物中报道最多且广泛存在的成分[4-6]。现代药理学研究表明,该属植物具有抗肿瘤、抑菌、抗炎、杀虫和细胞毒活性等药理作用[7]。前期本课题组对烟管头草进行了化学成分研究,发现了5个新的倍半萜类化合物[8,9],并对分离得到的化合物进行抗白血病[9]、抗前列腺癌[10-12]等活性研究,结果表明它们可通过抑制相关信号通路进而抑制癌细胞增殖。为了获得生物活性更好的化合物,本课题对烟管头草95%乙醇提取物的乙酸乙酯萃取物继续进行化学成分研究,并对分离得到的化合物进行细胞毒活性测试,为天名精属植物的开发利用提供基础。
1 材料与方法
1.1 仪器与材料
INOVA-400 MHz和INOVA-500 MHz超导核磁共振波谱仪(美国瓦里安公司),TMS为内标;Waters 1525 EF高效液相色谱仪(美国Waters公司),Waters 2998检测器,Waters SunFire色谱柱为C18(10 mm×250 mm,4.6 mm×150 mm);JASCO P-1020旋光仪(日本JASCO公司);Shimadzu UV-2401A紫外光谱仪(日本Shimadzu公司);Bruker Tensor-27红外光谱仪(德国Bruker公司);Bruker HCT/Esquire和Waters Autospec Premier P776质谱仪(德国Bruker公司,美国Waters公司);Sephadex LH-20(日本三菱化学公司);RP-18反相硅胶(日本YMC公司);柱层析硅胶(200~300目和300~400目,青岛海洋化工厂);硅胶GF254薄层板(50 mm×100 mm,0.20~0.25 mm,青岛海洋化工厂);分析纯三氯甲烷、丙酮(重庆川东化工集团有限公司);其余试剂均从工业级蒸馏中获得;5%硫酸乙醇显色剂。
实验所用烟管头草药材于十月份采自贵州省安顺市镇宁县,经贵州中医药大学孙庆文教授鉴定为烟管头草(Carpesiumcernuum),标本(Assrmyy201608)保存于贵州省安顺市人民医院药学实验室。
1.2 实验方法
1.2.1 提取与分离
取干燥烟管头草全草20.0 kg,粉碎,用95%的工业乙醇加热回流提取3次(3 h/次),将提取液合并,浓缩回收乙醇。然后加水使浓缩液呈悬浮状态,乙酸乙酯萃取,得乙酸乙酯萃取液与水层,乙酸乙酯萃取物960.0 g进行硅胶柱层析(300~400目),以石油醚-丙酮(60∶1→1∶1,V/V)梯度洗脱,得到7个馏分(Fr.1~7)。
Fr.1(133.0 g)经正相硅胶柱(300~400目),以石油醚-乙酸乙酯(60∶1→1∶1,V/V)梯度洗脱,得到4个亚馏分(Fr.1a~1d)。亚馏分1b(15.2 g)用Sephadex LH-20(CHCl3∶MeOH,V/V=1∶1)纯化,并用正相硅胶柱(石油醚-乙酸乙酯,15∶1)进一步纯化,得到化合物2(325.6 mg)和3(95.4 mg)。亚馏分1d(2.8 g)经正相硅胶柱(300~400目),以石油醚-乙酸乙酯(30∶1→5∶1,V/V)梯度洗脱,并用制备型高效液相色谱(乙腈∶水,V/V=60∶40)进一步纯化,分离得到化合物1(11.6 mg)和7(8.0 mg)。Fr.2(82.4 g)经硅胶、Sephadex LH-20、反相RP-18柱层析反复分离,并经制备型高效液相色谱(乙腈∶水,V/V=60∶40)进一步纯化得到化合物4(42.6 mg)、5(19.2 mg)和6(8.5 mg)。Fr.3(102.0 g)经反相RP-18柱层析,以甲醇-水系统(40%∶60→100∶0,V/V)梯度洗脱,再经制备型高效液相色谱(乙腈∶水,V/V=60∶40)分离纯化后得到化合物8(5.0 mg)、9(6.3 mg)和10(9.5 mg)。
1.2.2 细胞毒活性
采用MTT法对人乳腺癌细胞MDA-MB-231进行细胞毒活性。化合物分别用DMSO溶解后配成30 mmol/L的储备液,使用之前稀释到适宜浓度。将MDA-MB-231细胞配制成细胞悬液接种于96孔板上(100 μL/孔),实验分为阳性对照组和四个给药组,接种好的细胞培养板放入培养箱中培养24 h后分别加入1.25、2.5、5、10 μmol/L的含药样品溶液各10 μL,在5% CO2,37 ℃孵育72 h后,每孔加入10 μL配制好的MTT溶液(5 mg/mL,即0.5% MTT)继续培养4 h,孵育后使用酶标仪测量在波长为490 nm下的吸光度(A),并计算IC50值。紫杉醇为阳性对照。
2 结果
2.1 结构鉴定
化合物1~10的化学结构如图1所示。
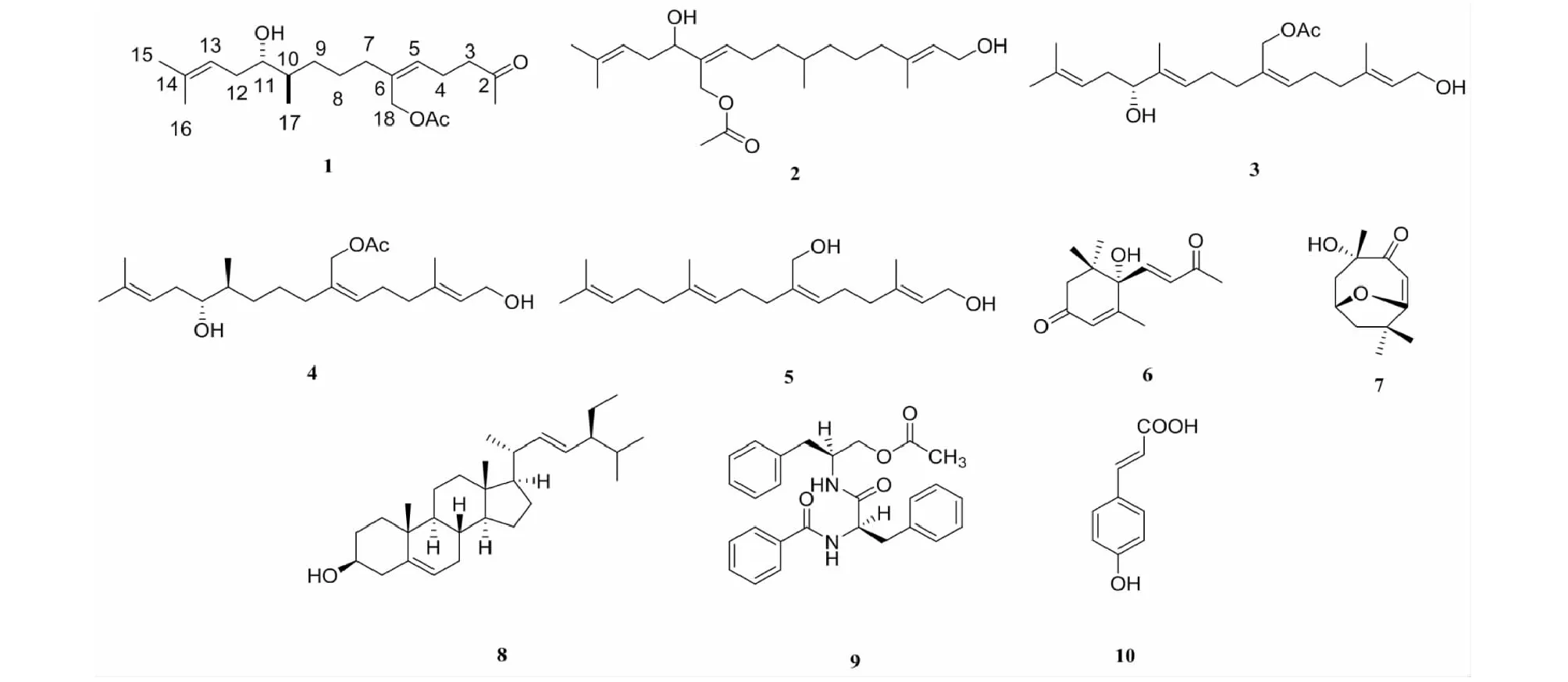
图1 化合物1~10的化学结构Fig.1 The chemical structures of compounds 1-10
通过二维核磁1H-1H COSY、HSQC、HMBC谱对化合物的碳氢信号进行了全归属,其详细数据见表1。化合物1的1H-1H COSY(见图2)表明结构中存在三个连续的片段H-3/H-4/H-5、H-7/H-8/H-9/H-10/H-17、H-17/H-10/H-11/H-12/H-13,基于1H-1H COSY片段H-3/H-4/H-5,HMBC相关H-4到C-2、3、5、6说明C-5与C-6之间为双键,C-2为酮羰基;同时,C-2与H-1、3、4存在相关性,可知C-1为与C-2直接相连的甲基;结合H-7/H-8/H-9/H-10/H-17片段,由HMBC谱中H-7到C-5、6、8、9、18相关,参考DEPT谱,说明C-7/C-8/C-9为三个直接相连的亚甲基片段以及确定了C-5、6、7、18的连接方式;此外,在HMBC谱中,H-18与乙酰氧基中的酯羰基碳原子、甲基碳原子有相关,乙酰氧基中的甲基质子与C-18有相关,可判断乙酰氧基连接在C-18位上;根据H-17/H-10/H-11/H-12/H-13片段,由HMBC谱中H-10到C-9、11、17和H-12到C-10、11、13、14相关,说明了C-9、10、11、12、13、14、17的连接方式;H-15和H-16与C-13、C-14存在相关性,说明两个甲基C-15、C-16与C-14直接相连。ROESY相关峰H-4/H-18及H-5/H-7表明C-5与C-6之间的双键构型为Z。化合物1的绝对构型还有待确认[13]。化合物1与(2E,6Z,10E,12R)-7-[(acetyloxy)methyl]-3,11,15-trimethylhexadeca-2,6,10,14-tetraene-1,12-diol的1H NMR和13C NMR数据[14]相似,表明两个化合物具有相似的分子骨架,两者的区别在于化合物1比已知化合物少了2个双键、1个羟基和2个亚甲基,但化合物1多了1个羰基。因此确定化合物1为(5Z)-6-[(acetyloxy)methyl]-2-oxo-2,10,14-trimethylhexadeca-5,13-diene-11α-ol。化合物1的详细结构鉴定数据原始图谱可从本刊官网免费下载(www.trcw.ac.cn)。

表1 化合物1的1H NMR和13C NMR数据Table 1 1H (400 MHz) and 13C (100 MHz) NMR dataof compound 1 ( in CDCl3,δ in ppm,J in Hz)
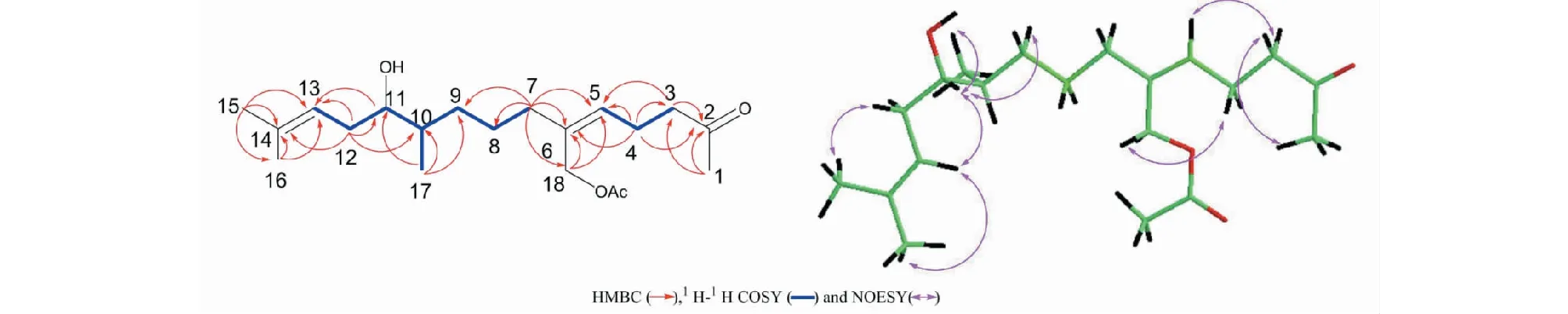
图2 化合物1的1H-1H COSY、HMBC和ROESY主要相关信号Fig.2 Key 1H-1H COSY,HMBC and ROESY correlations signal of compound 1
化合物2黄色油状物;C22H38O4;1H NMR(400 MHz,CDCl3)δ:5.41(1H,m,H-2),5.40(1H,m,H-10),5.17(1H,m,H-14),4.58(2H,s,H-18),4.13(2H,d,J= 6.8 Hz,H-1),3.40(1H,m,H-12),2.06(3H,s,H-2′),1.74(3H,s,H-16),1.66(3H,s,H-20),1.65(3H,s,H-17),0.90(3H,d,J= 6.8 Hz,H-19);13C NMR(100 MHz,CDCl3)δ:59.2(C-1),124.1(C-2),138.4(C-3),39.4(C-4),25.8(C-5),32.5(C-6),38.0(C-7),31.5(C-8),25.8(C-9),130.3(C-10),135.2(C-11),75.5(C-12),35.4(C-13),120.5(C-14),134.1(C-15),25.9(C-16),17.9(C-17),61.8(C-18),15.4(C-19),16.2(C-20),171.2(C-1′),20.9(C-2′)。以上数据与文献[15]报道数据一致,故鉴定化合物为(2E,10E)-1,12-dihydroxy-18-acetoxy-3,7,15-trime-thylhexadeca-2,10,14-triene。
化合物3黄色油状物;C22H36O4;1H NMR(400 MHz,CDCl3)δ:5.42(1H,t,J= 7.2 Hz,H-2),5.40(1H,t,J= 6.8 Hz,H-6),5.38(1H,t,J= 7.2 Hz,H-10),5.08(1H,t,J= 7.2 Hz,H-14),4.59(2H,s,H-19),4.14(2H,d,J= 6.8 Hz,H-1),3.97(1H,t,J= 6.4 Hz,H-12),2.07(3H,s,H-AcO),1.72(3H,s,H-16),1.64(3H,s,H-17),1.63(3H,s,H-20),1.62(3H,s,H-18);13C NMR(100 MHz,CDCl3)δ:59.3(C-1),124.0(C-2),137.2(C-3),39.3(C-4),26.1(C-5),130.4(C-6),133.6(C-7),34.7(C-8),25.9(C-9),125.3(C-10),137.3(C-11),77.0(C-12),34.7(C-13),120.1(C-14),134.7(C-15),25.8(C-16),18.0(C-17),11.8(C-18),61.9(C-19),16.2(C-20),20.0(CH3-AcO),171.2(COO-AcO)。以上数据与文献[14]报道数据一致,故鉴定化合物为(2E,6Z,10E,12R)-7-[(acetyloxy)methyl]-3,11,15-trimethylhexadeca-2,6,10,14-tetraene-1,12-diol。
化合物4无色油状物;C22H38O4;1H NMR(400 MHz,CDCl3)δ:5.40(1H,br t,J= 7.1 Hz,H-2),5.38(1H,br t,J= 6.8 Hz,H-6),5.17(1H,d,J= 6.8 Hz,H-14),4.13(2H,d,J= 7.1 Hz,H-1),3.40(1H,m,H-12),2.22(2H,m,H-5),2.12(2H,m,H-13),2.08(2H,m,H-4),1.99(1H,m,H-9α),1.76(3H,brs,H-16),1.67(3H,br s,H-20),1.65(3H,brs,H-17),1.55(1H,m,H-11),1.49(1H,m,H-10α),1.30(1H,m,H-9β),1.13(1H,m,H-10β),0.89(1H,d,J= 6.8 Hz,H-18);13C NMR(100 MHz,CDCl3)δ:59.2(C-1),124.1(C-2),137.5(C-3),39.3(C-4),25.8(C-5),130.2(C-6),133.9(C-7),35.4(C-8),25.4(C-9),31.5(C-10),38.0(C-11),75.4(C-12),32.4(C-13),120.5(C-14),135.3(C-15),25.9(C-16),17.9(C-17),15.4(C-18),61.8(C-19),16.1(C-20),20.9(CH3-AcO),171.1(COO-AcO)。以上数据与文献[16]报道数据一致,故鉴定化合物为(2E,6Z,11S,12R)-3,7,11,15-tetramethylhexadeca-2,6,14-triene-7-[(acetyloxy)methyl]-1,12,19-triol。
化合物5黄色油状物;C20H34O2;1H NMR(400 MHz,DMSO-d6)δ:5.27(1H,m,H-6),5.14(1H,m,H-14),5.07(1H,m,H-10),3.93(2H,d,J= 7.2 Hz,H-1),3.90(2H,s,H-18),1.63(6H,s,H-16,H-17),1.57(6H,s,H-19,H-20);13C NMR(100 MHz,DMSO-d6)δ:57.9(C-1),125.2(C-2),135.3(C-3),39.4(C-4),25.5(C-5),125.4(C-6),139.2(C-7),34.5(C-8),26.2(C-9),124.2(C-10),130.6(C-11),39.4(C-12),26.2(C-13),124.1(C-14),134.2(C-15),25.3(C-16),16.0(C-17),57.5(C-18),17.6(C-19),15.8(C-20)。以上数据与文献[17]报道数据一致,故鉴定化合物为plaunotol。
化合物6黄色油状物;C13H18O3;1H NMR(400 MHz,CDCl3)δ:6.85(1H,d,J= 15.7 Hz,H-7),6.48(1H,d,J= 15.7 Hz,H-8),5.96(1H,d,J= 1.1 Hz,H-4),2.52(1H,d,J= 17.2 Hz,H-2β),2.33(1H,d,J= 18 Hz,H-2α),2.31(3H,s,H-10),1.88(3H,d,J= 1.4 Hz,H-11),1.11(3H,s,H-13),1.02(3H,m,H-12);13C NMR(100 MHz,CDCl3)δ:41.4(C-1),49.5(C-2),197.4(C-3),127.7(C-4),160.3(C-5),79.2(C-6),144.9(C-7),130.3(C-8),196.9(C-9),29.6(C-10),18.6(C-11),24.3(C-12),22.9(C-13)。以上数据与文献[18,19]报道数据一致,故鉴定化合物为S-(+)-dehydrovomifoliol。
化合物7白色粉末;C11H16O3;1H NMR(400 MHz,CDCl3)δ:5.68(1H,S,H-6),4.32(1H,S,H-s),2.45(1H,dt,J= 14.2,2.6 Hz,H-3β),1.98(1H,dt,J= 14.5,2.6 Hz,H-1β),1.73-1.81(1H,m,H-3α),1.77(3H,s,H-11),1.51(1H,dd,J= 14.6,3.7 Hz,H-1α),1.46(3H,s,H-9),1.25(3H,d,J= 8.8 Hz,H-10);13C NMR(100 MHz,CDCl3)δ:47.2(C-1),66.6(C-2),45.5(C-3),86.8(C-4),182.7(C-5),112.7(C-6),172.0(C-7),35.9(C-8),26.4(C-9),30.61(C-10),26.9(C-11)。以上数据与文献[20,21]报道数据一致,故鉴定化合物为pubinernoid A。
化合物8白色针晶(氯仿);mp.151~152 ℃;C29H48O;1H NMR(400 MHz,CDCl3)δ:5.35(1H,m,H-6),5.15(1H,dd,J= 15.1,8.5 Hz,H-22),5.01(1H,dd,J= 8.8 Hz,H-23),3.52(1H,m,H-3),1.01(3H,s,CH3-10),0.82(3H,s,CH3-29);13C NMR(100 MHz,CDCl3)δ:37.2(C-1),29.1(C-2),71.8(C-3),42.2(C-4),140.7(C-5),121.7(C-6),31.8(C-7),31.9(C-8),50.1(C-9),36.5(C-10),21.1(C-11),39.7(C-12),42.2(C-13),56.8(C-14),24.2(C-15),28.9(C-16),55.9(C-17),12.0(C-18),19.4(C-19),40.5(C-20),21.1(C-21),138.3(C-22),129.2(C-23),51.2(C-24),31.6(C-25),18.9(C-26),21.0(C-27),25.4(C-28),12.0(C-29)。以上数据与文献[22,23]报道数据一致,故鉴定化合物为豆甾醇。
化合物9白色针晶(甲醇);mp.187~188 ℃;C27H28N2O4;1H NMR(400 MHz,CDCl3)δ:7.71(2H,d,J= 7.2 Hz,H-3′,H-7′),7.53(1H,t,J= 7.2 Hz,H-5′),7.44(2H,t,J= 7.6 Hz,H-4′,H-6′),7.25(5H,m,H-5,H-9),7.15(2H,m,H-5′′,H-7′′),7.06(2H,d,J= 7.2 Hz,H-4′′,8′′),6.80(1H,d,J= 7.6 Hz,H-βNH),6.05(1H,d,J= 8.4 Hz,H-αNH),4.78(1H,dd,J= 8.0,14.0 Hz,H-2),4.34(1H,m,H-1′′),3.92(1H,dd,J= 4.8,11.0 Hz,H-9′′β),3.81(1H,dd,J= 4.0,11.2 Hz,H-9′′α),3.21(1H,dd,13.6 Hz,J= 6.0,H-3β),3.06(1H,dd,J= 8.4,13.6 Hz,H-3α),2.75(2H,m,H-2′′),2.02(3H,s,-COCH3);13C NMR(100 MHz,CDCl3)δ:170.2(C-1),54.9(C-2),38.4(C-3),136.7(C-4),128.6(C-5,C-9),129.3(C-6,C-8),127.1(C-7),167.1(C-1′),133.6(C-2′),128.5(C-3′,7′),127.0(C-4′,C-6′),131.9(C-5′),49.4(C-1′′),37.4(C-2′′),136.6(C-3′′),128.7(C-4′′,C-8′′),129.1(C-5′′,C-7′′),126.7(C-6′′),64.6(C-9′′),20.8(CH3-COCH3),170.8(C=O-COCH3)。以上数据与文献[24,25]报道数据一致,故鉴定化合物为aurantiamide acetate。
化合物10白色针晶(甲醇);mp.210~212 ℃;C9H8O3;1H NMR(400 MHz,CD3OD)δ:7.52(1H,d,J=16.0 Hz,H-3),7.49(2H,m,H-2′,H-6′),6.78(2H,m,H-3′,H-5′),6.28(1H,d,J= 16.0 Hz,H-2);13C NMR(100 MHz,CD3OD)δ:167.9(C-1),115.3(C-2),125.2(C-3),144.2(C-1′),130.1(C-2′,C-6′),115.7(C-3′,C-5′),159.6(C-4′)。以上数据与文献[26,27]报道数据一致,故鉴定化合物为反式对羟基肉桂酸。
2.2 细胞毒活性
本实验对从烟管头草中分离得到的化合物1~4进行细胞毒活性测试,结果显示,与阳性对照紫杉醇(taxol,IC50= 0.10 μmol/L)相比,化合物2对人乳腺癌细胞MDA-MB-231表现出较强的细胞毒活性,其IC50值为6.80 μmol/L,化合物1、3、4表现出中等细胞毒活性,IC50值分别为34.89、46.13、30.38 μmol/L。
3 讨论与结论
本文从烟管头草全株95%乙醇提取物的乙酸乙酯萃取部位共分离和鉴定出10个化合物,包括单萜类、二萜类及其他类化合物,其中化合物1为新化合物。化合物5先前被日本学者研发为抗溃疡药普劳诺托,但其具体的有效部位尚未确定,提示在后期天名精属化学成分活性研究中可以对分离得到的二萜类化合物进行抗溃疡药理活性研究。
对化合物1~4进行细胞毒活性测试表明,化合物2对人乳腺癌细胞MDA-MB-231表现出较强的细胞毒活性,其IC50值为6.80 μmol/L,化合物1、3、4表现出中等细胞毒活性。烟管头草提取物对多种癌细胞的增殖均有抑制作用[28],但在人乳腺癌细胞MDA-MB-231中IC50值最小,这为治疗乳腺癌疾病提供了一定的药理依据,提示烟管头草提取物可作为抗乳腺癌药物的潜在成分。综合本课题组前期对烟管头草中化学成分进行抗白血病[9]、抗前列腺癌[10-12]研究发现,其单体化合物可通过抑制相关信号通路进而抑制癌细胞增殖。因此,烟管头草在抗肿瘤方面具有很大的研究前景,但目前药理活性的研究主要集中在单体化合物的体外活性筛选,而体内药效评价、作用机制及构效关系的研究甚少,可将量大的单体化合物进行体内药效评价,这为抗肿瘤新药的研发提供了重要的理论依据。

