无花果酵素自然发酵过程中代谢产物与抗氧化活性的相关性研究
姚沛琳,蒋家璇,武进雨,孔振杨,季小康,徐礼生
宿州学院生物与食品工程学院,宿州234000
食用植物酵素,是由一种或多种新鲜蔬菜、水果、菌菇等为原料,经多种有益菌种长时间发酵而成,含有丰富的酶、有机物、益生菌、次生代谢产物等多种具有极高营养价值的功能性成分。不仅赋予酵素特有的风味和口感,而且可以给人体提供美白养颜、延缓衰老、提高免疫力等多种保健功能[1,2]。水果酵素因其较好的生物活性逐渐成为研究热点,例如发酵后桑葚酵素的SOD酶活(24 122.2 U/mL)可比桑葚果汁(10 818.7 U/mL)提高123%[3];Zhao等[4]通过研究成熟度对诺力果酵素品质的影响证明诺丽果酵素具有潜在的美白和预防肥胖功效;Siroli等[5]证明将植物乳杆菌菌株CIT3和V7B3分别接种于苹果和生菜,可提高产品的安全性和保质期。
无花果属于桑科果属,有“生命之果”之称,含18种以上的氨基酸,其中8种是人体必需氨基酸,还含有人体必需的维生素、糖类等营养成分,具有降低血压、润肠通便等功效[6]。无花果营养丰富,但是表皮极易被微生物污染,采摘后运输贮藏难度极大,因此就地发酵是较好的处理方法。目前无花果在功能性食品领域深入研究较少,主要用于鲜食或加工成果干、果浆、果脯等,存在产品开发价值和附加值相对较低等问题[7]。从营养和保健功效考虑,无花果是开发食用酵素的优良植物资源[8]。近年来,酵素制品已成为国际市场的主流,但国内的酵素还处于研究起步阶段,缺少自主知识产权,无花果酵素更是鲜有报道,将无花果加工成具有高营养价值的无花果酵素,则有利于无花果产业的转型升级和高值化利用。
本文以无花果为研究对象,以自然发酵法制备无花果酵素,探究发酵过程中的理化指标(pH、总酸、有机酸)、活性物质(总黄酮、总酚)、抗氧化活性(DPPP自由基、羟基自由基、超氧自由基清除能力和还原力)的变化规律,以期得到最佳发酵时间,用标准化手段规范传统发酵工艺,为无花果酵素的自然发酵提供科学研究支撑。
1 材料与方法
1.1 材料与试剂
新鲜无花果(产自浙江金华兰溪地区);单晶冰糖(安徽福香源生态农业科技有限公司)。
蒽酮、福林酚、氢氧化钠、三氯乙酸、三氯化铁、过氧化氢、水杨酸钠、硫酸亚铁、铁氰化钾、邻苯三酚,甲醇、甲酸等试剂(国药集团);26种有机酸标准品(美国Sigma公司)。
1.2 仪器与设备
Multiskan Go酶标仪(美国Thermo公司);1-1SPK小型台式冷冻离心机(美国Sigma公司);BBC-SDC-A超净工作台(博科生物公司);AB三重四极杆质谱仪(美国Thermo公司);Waters ACQUITY UPLC(Waters公司)。
1.3 实验方法
1.3.1 无花果酵素的制备
用超纯水在无菌条件下轻揉冲洗无花果,洗去无花果表面沙子和灰尘,在无菌操作台中自然晾干。冰糖用紫外灭菌后,按质量比1∶1与无花果一起加入已灭菌的酵素罐中,一层无花果原料一层冰糖,将无花果压实,排尽空气,装至酵素罐2/3处,采用不控温的方式,放置暗处自然发酵。在发酵过程中,适当进行搅拌,并观察发酵情况,每日17∶00进行5 min的放气,在发酵的第10、20、30、40、50、60、70、80、90、100、110、120、130、140、150天取样,将样品于10 000 rpm下离心10 min,取上清液待测,可于-80 ℃下保存[9]。
1.3.2 pH、总酸含量的测定
利用pH计校准后测定无花果酵素不同时间段的pH值。总酸的检测方法参照国标GB 12456-2021。
1.3.3 总酚含量测定
采用福林酚法进行测定[10],取7只25 mL的比色管,分别加入0、0.2、0.4、0.6、0.8、1.0、1.2 mL的没食子酸标准液,加蒸馏水至10 mL,每管加入5 mL 10% Folin试剂,振荡混匀,静置5 min,再加入4 mL 7.5% NaCO3溶液,混匀,在室温下静置60 min,采用酶标仪在波长为765 nm下测定吸光度,绘制标准曲线为y=0.010 8x+0.098 7,R2=0.998 1。取1 mL酵素液,后续步骤同标准曲线,总酚含量以没食子酸计,按照标准曲线计算总酚含量。
1.3.4 总黄酮含量测定
采用亚硝酸钠法进行测定[11]。取1 mL样液用80%乙醇溶液定容至10 mL,加入0.7 mL 5%的NaNO2溶液,反应6 min,再加入0.7 mL 10%的AlCl3溶液,摇匀,反应6 min,再加入5 mL 10%的NaOH溶液,用80%乙醇定容至25 mL,静置反应15 min,于510 nm波长下测定吸光度。以芦丁标准液作标准曲线,计算总黄酮含量。
1.3.5 有机酸含量的测定
取适量样品于2 mL EP管中,准确加入500 μL 30%甲醇水溶液(含0.1%甲酸),混匀,8 000 rpm离心,取上清液,0.22 μm膜过滤,上机分析。色谱条件:色谱柱:Agilent Eclipse XDB-C18色谱柱(4.6 mm×150 mm,5 μm),进样量5 μL,柱温40 ℃,流动相A-水(含0.1%甲酸),B-甲醇水(含0.1%甲酸),梯度洗脱,流速:0.4 mL/min。质谱条件:电喷雾电离(ESI)源,负离子电离模式。离子源温度500 ℃,离子源电压-4 500 V,碰撞气6 psi,气帘气30 psi,雾化气和辅助气均为50 psi。采用多重反应监测(MRM)进行扫描[12]。
1.3.6 DPPH自由基清除能力的测定
参考Yu等[13]的方法,取1 mL样品,加入3 mL的DPPH乙醇溶液(20 mmol/L),振荡摇匀。室温下避光30 min后,在517 nm下测定其吸光度,使用公式(1)计算DPPH自由基清除率。
DPPH自由基清除率=[(A1-A2)/A1]×100%
(1)
式中:A1为对照组吸光度;A2为样品组吸光度。
1.3.7 羟基自由基清除能力的测定
采用水杨酸钠法进行测定[14],取1 mL样品,依次加入1.4 mL的H2O2溶液(6 mmol/L)、0.6 mL的水杨酸钠溶液(20 mmol/L)和2 mL的FeSO4溶液(1.5 mmol/L),振荡摇匀,放在37 ℃的恒温水浴锅中加热1 h,于562 nm下测定吸光度,使用公式(2)计算羟基自由基清除率。
羟基自由基清除率=[1-(A2-A3)/A1]×100%
(2)
式中:A1为空白组吸光度;A2为样品组吸光度;A3为本底组吸光度
1.3.8 超氧自由基清除能力
采用邻苯三酚法进行测定[15],取1 mL样品,分别加入4.5 mL Tris-HCl缓冲液(pH 8.2)和4.2 mL去离子水,充分混匀,在25 ℃的恒温水浴锅中水浴20 min后,加入0.3 mL的邻苯三酚(7 mmol/L),混匀后在25 ℃水浴中反应5 min,最后加入0.3 mL的HCl(10 mmol/L)终止反应,在325 nm下,每隔5 min测定吸光值,连续测定30 min,绘制线性方程,方程斜率记为V1。以蒸馏水代替样品,同样条件下绘制线性方程,方程斜率记为V0,使用公式(3)计算超氧自由基清除率。
超氧自由基清除率=[(V0-V1)/V0]×100%
(3)
式中:V1为邻苯三酚自动氧化后加入样品检测吸收值;V0邻苯三酚自动氧化后检测吸收值。
1.3.9 还原力的测定
采用铁氰化钾法进行测定[16],取1 mL样品,加入2.5 mL(0.2 mol/L,pH=6.6)的PBS和2.5 mL的1%铁氰化钾溶液,50 ℃反应20 min,加入2.5 mL的10%三氯乙酸溶液,3 000 rpm离心10 min,取2.5 mL的上清液,加入2.5 mL的蒸馏水和0.5 mL的0.1%三氯化铁溶液,静置10 min,在700 nm处测定吸光值。
1.3.10 数据处理及分析
利用SPSS Statistics 23.0软件进行统计分析,Origin 8.5对实验数据进行绘图。
2 结果与分析
2.1 无花果发酵过程中总酸与pH的变化结果
无花果酵素在发酵过程中总酸含量和pH值的变化如图1所示。pH在整个发酵周期,均呈现下降趋势,但是在发酵前30天,下降速度较快,从3.99下降至3.85,可能与乳酸菌等微生物大量繁殖,产生大量酸性次生代谢产物有关。总酸含量在整个发酵周期,呈现先增大后降低的趋势,在发酵前90天,与pH呈现相反的变化趋势,说明在这一段时期,发酵体系的微生物处在正常的生长状态。但是90天以后,总酸含量持续下降,可能是由于pH值的降低阻碍了一些微生物的生长繁殖,也可能是因为在发酵后期,发酵体系的碳源不足,有机酸开始作为碳源被某些微生物利用[17]。
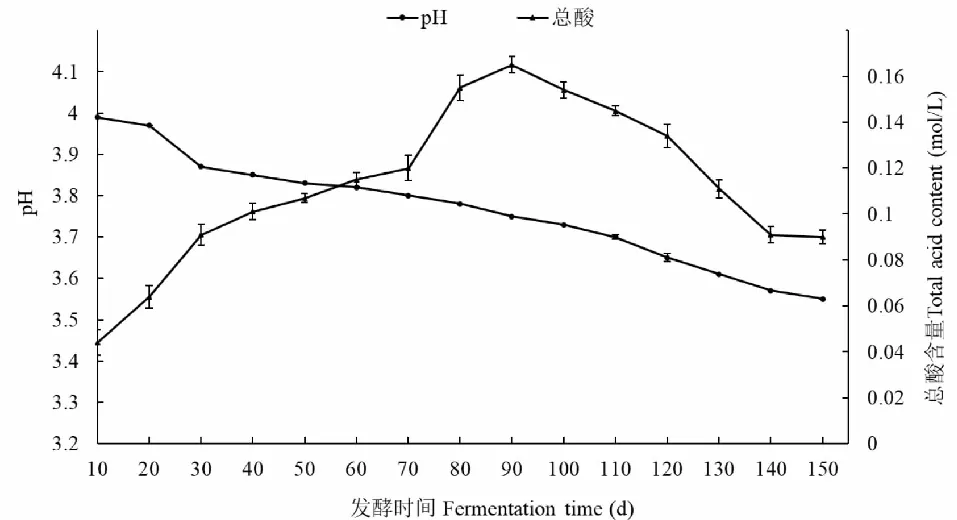
图1 无花果酵素不同发酵时间总酸含量和pH值的变化Fig.1 Variation of total acid content and pH value of fig enzyme at different fermentation time
2.2 无花果发酵过程中总酚含量的变化结果
无花果酵素在发酵过程中总酚含量的变化如图2所示,在整个发酵过程中,总酚含量呈先明显增加后趋于稳定,最后显著下降的变化趋势。发酵至第80天时,总酚积累量达到最大值,为0.228 mg/mL。在发酵前50天呈现增长趋势,其中前20天增长较快,出现这一现象的原因可能是由于在这一时期,无花果里的酚类物质在高渗透压作用下析出,或者无花果酵素中微生物的生产代谢较为迅速,消耗原料中的其他成分生成酚类物质。在发酵的第100~110天,总酚含量出现急速下降的现象,可能是因为酚类化合物与发酵液中蛋白质类物质结合形成沉淀,导致离心后酵素液中总酚含量减少或者是因为与发酵液中的有机酸发生反应,生成其他物质[18]。研究也表明,当发酵液中酚类物质达到一定浓度后会抑制微生物的生长代谢,这些微生物为了维持自身的生长会降解酚类物质,导致其含量减少[17]。总酚含量与抗氧化有着密切的关系[19],因此长时间发酵不利于抗氧化功能的发挥。
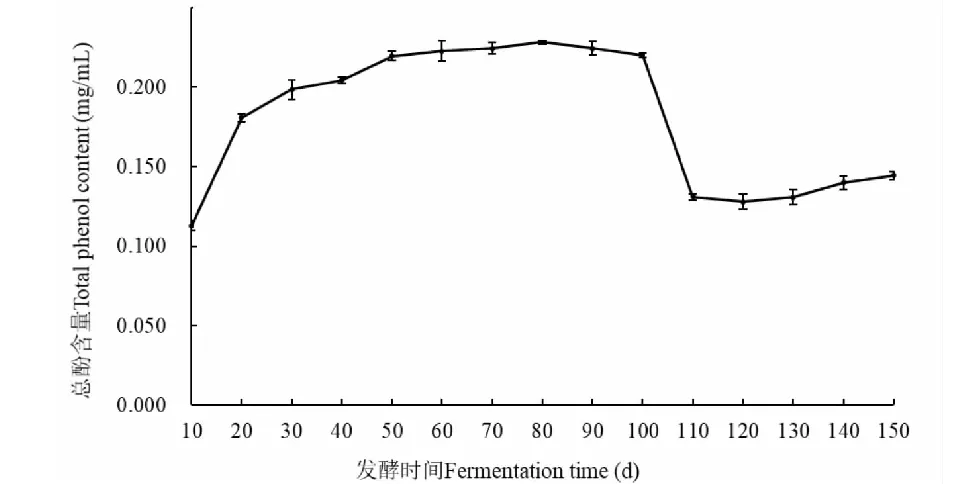
图2 无花果酵素不同发酵时间总酚的变化Fig.2 Variation of total phenols of fig enzymes at different fermentation time
2.3 无花果发酵过程中总黄酮含量的变化结果
无花果酵素在发酵过程中总黄酮含量的变化如图3可知,表现为上升的变化趋势,在发酵第130天时,总黄酮积累量达到最大值,为4.26 mg/mL。但是在发酵的第130~140天,总黄酮的含量出现了骤降的现象。在发酵后期,糖类基本已耗尽,酚类物质被分解利用,可以转化为具有附加生物价值的黄酮类物质,因此导致在发酵的第120~130天,总黄酮的含量出现了骤升的现象,这与酚类物质在发酵的第100~110天出现的骤降现象相吻合。通过文献查阅,桑葚酵素在发酵后期花青素含量出现明显下降的现象,发生了生物转化[20],推测无花果酵素中总黄酮含量的骤降可能也是由于黄酮中的某类物质发生了生物转化或者生物降解,需进一步分析研究。
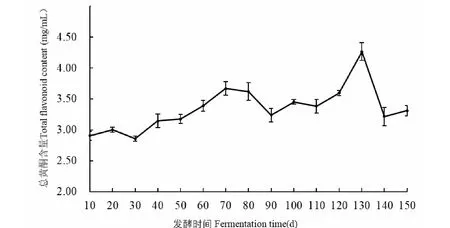
图3 无花果酵素不同发酵时间总黄酮含量的变化Fig.3 Changes in total flavonoid content of fig enzymes at different fermentation time
2.4 有机酸含量的变化
测定不同发酵时间,无花果酵素自然发酵液中26种有机酸含量,结果如表1所示,在26种有机酸中,共检测出13种,其中含量比较大的是乳酸、琥珀酸、苹果酸、柠檬酸、葡萄糖醛酸、泛酸,其次是富马酸、3-羟基-3-甲基谷氨酸和丙二酸。无花果酵素中总有机酸含量随发酵的进行持续上升(P<0.05),至发酵的第80天,达到最大值(2.639 mg/mL),相较于发酵第10天时的1.449 mg/mL,增长了82.13%,80天后稍有下降但趋于稳定。苹果酸和柠檬酸含量在发酵过程中的变化趋势类似,均随着发酵时间的增加而增大,至60~80天达到最高后趋于稳定或稍有下降。乳酸和琥珀酸含量呈现不规则变化,但是总体表现出先增大后稳定的趋势。富马酸、酒石酸和顺丁烯二酸的含量在无花果酵素中的含量极少,而且基本保持不变。葡萄糖醛酸、泛酸、L-焦谷氨酸,DL-3-苯基乳酸、3-羟基-3-甲基谷氨酸和丙二酸一直呈现增大的趋势。发酵各个阶段含量较大的不同有机酸含量平均值排序为:葡萄糖醛酸>苹果酸>泛酸>柠檬酸>琥珀酸>乳酸。
无花果酵素中有机酸含量的积累除了本身原料中有机酸的溶出外,主要由于发酵过程中微生物代谢所生成,而发酵后期有机酸总量有所下降的原因可能是由于糖类已消耗殆尽,微生物利用有机酸作为碳源生长[21]。苹果酸在发酵后期下降,可能是由于参与苹-乳代谢路径,乳酸菌将苹果酸转化为乳酸[22]。柠檬酸参与三羧酸代谢循环,因此在发酵过程中不容易积累[23]。琥珀酸是碳代谢的中心物质,是糖降解途径主要中间产物,由糖降解代谢积累[24]。本研究利用UPLC-MS/MS对26种有机酸物质进行靶向测定,发现葡萄糖醛酸和泛酸的含量较大,葡萄糖醛酸是由葡萄糖被氧化失去羟基所得,并在人体肝脏中与有毒物质结合,可以发挥解毒功效[25]。泛酸作为代谢物质的转运物质,起到人体免疫屏障的作用[26],可见发酵过程可以提高一些功能性有机酸的含量,有助于无花果酵素功能性作用的发挥。
2.5 无花果酵素的体外抗氧化活性研究
2.5.1 无花果酵素对DPPH自由基清除能力
无花果酵素在不同发酵时间对DPPH自由基清除能力如图4所示,随着发酵时间的延长,总体呈现先升高后降低的趋势。在发酵前60天,对DPPH自由基清除能力增加幅度较大,在第60天时,其清除率达到了最大值71.8%。在发酵的70~150天,呈现下降的趋势,与前期研究的酚类物质在发酵过程中的变化趋势基本一致,表明酚类物质在DPPH自由基清除能力中起着重要作用,这与文献资料中的报道相吻合[17]。在发酵的70~90天,对DPPH自由基清除能力下降幅度较大,结合前面对总黄酮的测定结果,推测可能与黄酮类物质的下降有关。DPPH自由基清除能力的降低除了与微生物在生产代谢过程中分解或消耗具有清除能力的物质有关,也可能是由于乳酸菌、酵母菌等微生物在发酵过程中产生了促进DPPH自由基增加的代谢产物[27]。由此可见,发酵时间的延长,对DPPH自由基清除能力是不利的。

表1 无花果酵素自然发酵过程中有机酸含量变化结果Table 1 Results of organic acid content change during natural fermentation of fig enzyme (mg/mL)
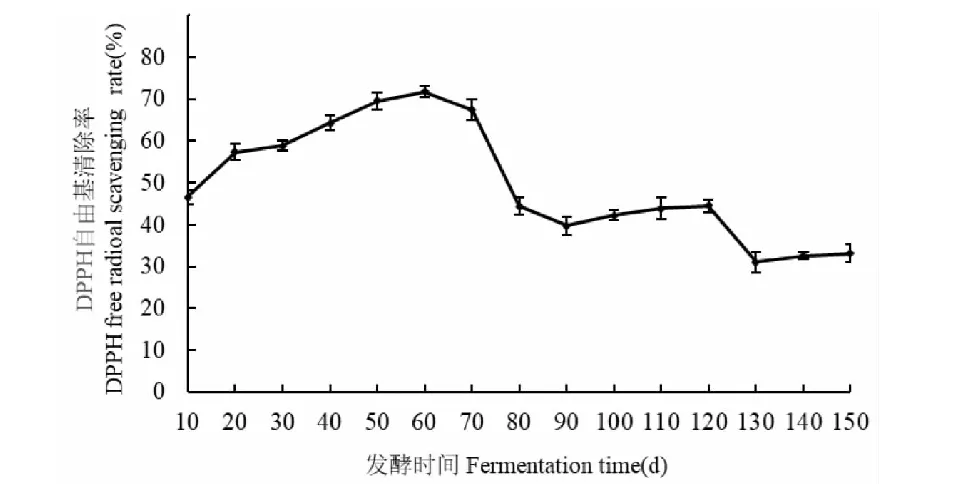
图4 无花果酵素不同发酵时间DPPH自由基清除能力的变化Fig.4 Changes of DPPH free radical scavenging ability of fig enzymes at different fermentation time
2.5.2 无花果酵素对羟基自由基清除能力
无花果酵素在不同发酵时间对DPPH自由基清除能力如图5所示,在发酵的前20天,羟基自由基的清除能力基本保持不变,可能是由于发酵液中的环境不足以支持微生物的大量繁殖,发酵液中的成分变化不显著。在发酵30~50天时,羟基自由基清除率增加幅度较大,从30.0%增加到75.4%,上涨了60.21%。在发酵50天后,羟基自由基清除率基本呈现波动式下降的趋势。Ng等[28]的研究表明,黄酮类化合物对羟基自由基有较好的清除能力,其清除能力的强弱取决于芳香环上羟基的数目和位置。因此在发酵的110~140天,无花果酵素对羟基自由基清除能力变化幅度较大,可能与总黄酮含量在这一时期变化幅度较大有关。
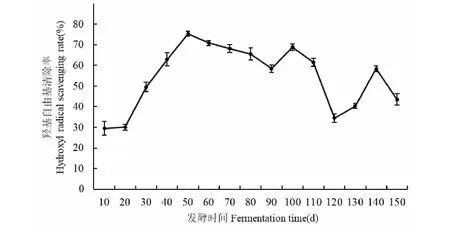
图5 无花果酵素不同发酵时间羟基自由基清除能力的变化Fig.5 Changes of hydroxyl radical scavenging ability of fig enzymes at different fermentation time
2.5.3 无花果酵素对超氧自由基清除能力
无花果酵素在发酵过程中对超氧自由基清除能力的变化如图6所示。在发酵前80天,超氧自由基清除率处于快速增加阶段,从22.3%增长到54.72%,在发酵80天达到最大值。但是在发酵80~90天,超氧自由基清除率快速下降,然后逐渐趋于稳定。研究表明,苯环上羟基数量较多的黄酮类化合物和SOD对清除超氧自由基有着促进作用[29],发酵后期出现快速降低的原因,可能与这两类物质的减少有关,还需通过深度分析进行验证。这一研究结果也说明延长发酵时间不利于超氧自由基清除能力的提高。
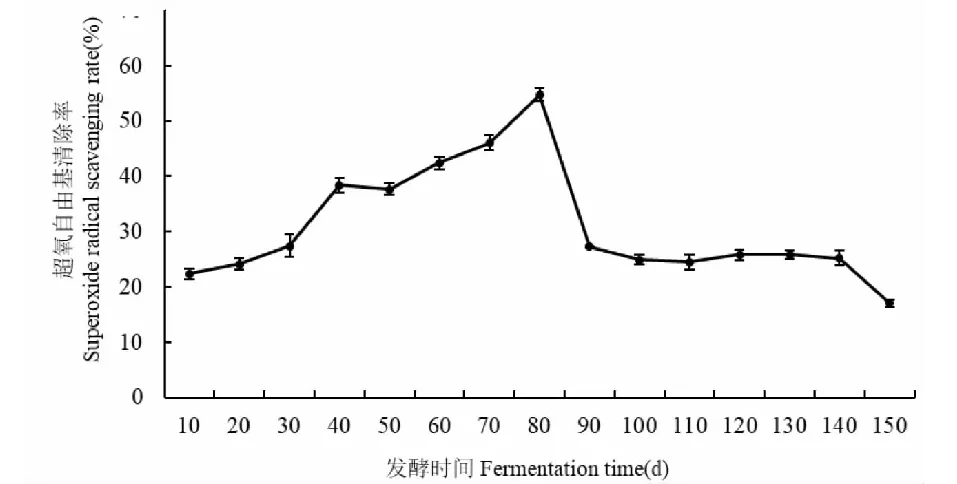
图6 无花果酵素不同发酵时间超氧自由基清除能力的变化Fig.6 Changes in superoxide radical capacity of fig enzymes at different fermentation time
2.5.4 无花果酵素的还原能力
由图7可知,无花果酵素的还原力在发酵前40天变化不大,在发酵40~50天,急剧增大,吸光度从0.07增大到0.261,在发酵60天时,达到最大值0.279,在发酵60~70天急剧降低,然后趋于稳定,结果显示,无花果酵素的还原力水平不高,延长发酵时间对还原力不利,并且在整个发酵过程中,还原力与其余3个抗氧化指标存在一定的差别,可能是因为还原力是评价抗氧化活性的综合指标,与多种因素有关,导致其变化的机理更加复杂。
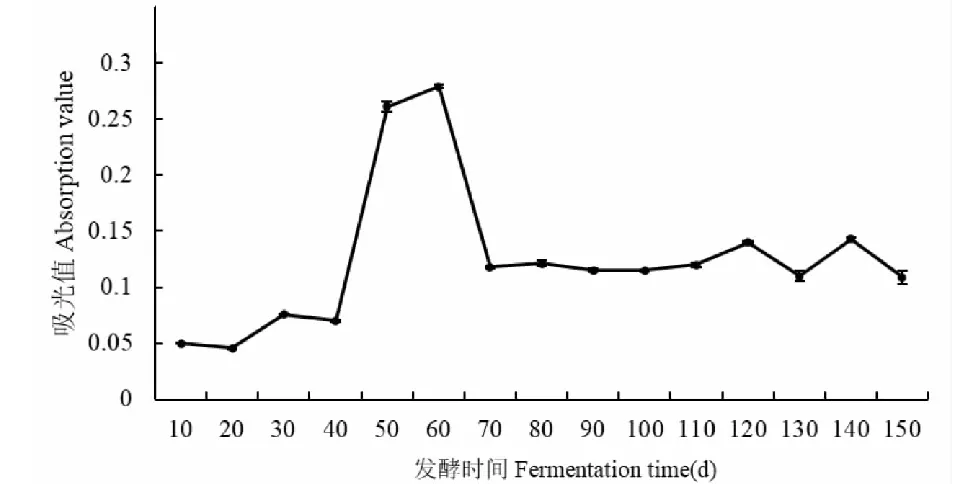
图7 无花果酵素不同发酵时间还原力的变化Fig.7 Variation of reducing power of fig enzyme at different fermentation time
2.6 无花果酵素中代谢产物与抗氧化活性的相关性分析
无花果酵素在发酵过程中,由于代谢产物种类复杂,而且在不同发酵时间,各代谢产物和抗氧化指标对无花果酵素的品质影响是不同的,因此采用主成分分析法(PCA)对不同发酵阶段的无花果酵素进行综合评价。首先对无花果酵素在发酵过程中的总酸、总酚、总黄酮、有机酸、有机酸总量与抗氧化指标之间的相关性进行分析,结果如表2所示。总酸与羟基自由基清除能力之间呈显著正相关(P<0.05),富马酸和苹果酸与DPPH自由基清除能力之间存在极显著正相关(P<0.01),柠檬酸与DPPH自由基清除能力之间呈显著正相关(P<0.05)。泛酸与羟基和超氧自由基清除能力之间呈显著正相关(P<0.05),总酚与超氧自由基清除能力之间呈显著正相关(P<0.05),由此说明无花果酵素中的酚类和有机酸等物质均具有一定的抗氧化能力。泛酸与有机酸总量之间呈显著正相关(P<0.05),说明泛酸含量对有机酸总量影响较大。
2.7 主成分分析
2.7.1 主成分分析的特征值
通过主成分分析对无花果酵素中各变量之间的相互关系进行降维处理。无花果酵素主成分特征值、贡献率和累积贡献率如表3所示。以特征值为依据,提取的第一主成分的贡献率为47.16%,第二主成分的贡献率为24.96%,两者总贡献率为72.12%,即二者能够反映原始变量72.12%的信息,可以用于描述大部分的变量信息。因此,对原先的14个变量进行降维处理后获得两个新变量。
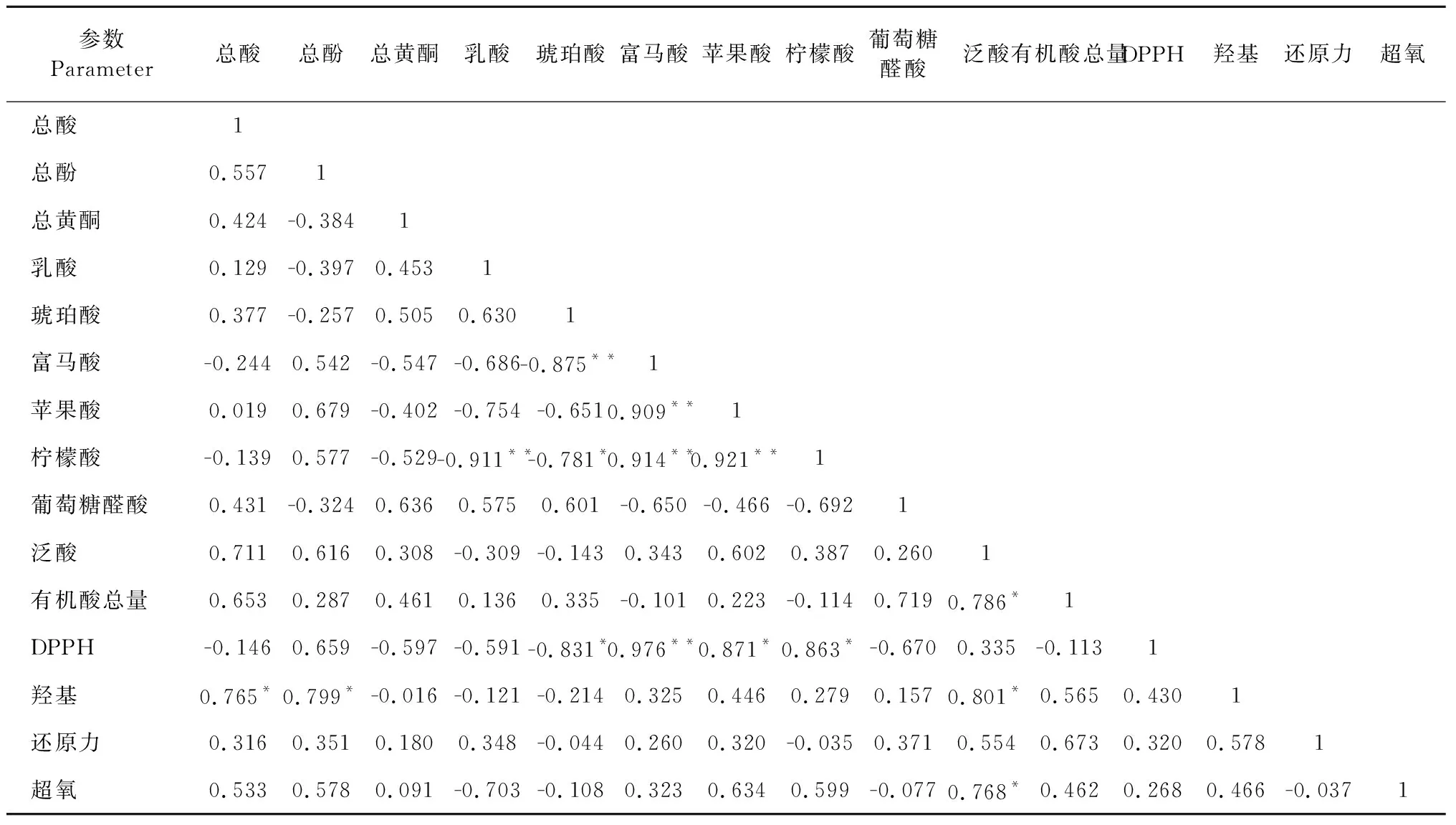
表2 发酵过程中各参数相关性Table 2 Correlation of parameters in the fermentation process

表3 主成分的特征值、贡献率和累积贡献率Table 3 The eigenvalue,contribution rate and the cumulative contribution rate of principal components
2.7.2 主成分法构建无花果酵素的综合评价指标
发酵过程中无花果酵素主成分样品得分图如图8所示,发酵10天和20天在第1、2主成分上位置均较近。发酵20天与发酵40天在第1主成分上位置距离较远,发酵20天与发酵60天在第1、2主成分上位置均较远,发酵40天与发酵60天在第2主成分上位置距离较远,说明发酵10天和20天的无花果酵素样品的性质相近;发酵20、40、60天的无花果酵素样品的性质差异较大;发酵60天和80天的第1、2主成分均距离较近,说明这两个发酵阶段的无花果酵素样品差异不大;发酵80天与第100天、130天和150天,刚开始在第1主成分上的位置距离较远,随着发酵的进行,在第2主成分上的位置距离开始变远,说明无花果酵素样品的性质差异开始变大。
通过主成分分析法构建不同发酵时间样品的综合评价指标(comprehensive evaluation index,CEI),即以每个主成分所对应的特征值占所提取主成分的特征值之和的比例,再进行线性加权求和。
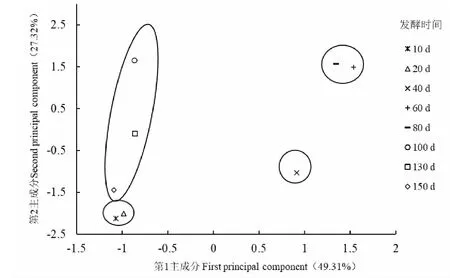
图8 主成分样品得分图Fig.8 Principal component sample score graph
综合评价指标(CEI)=Y1×G1+Y2×G2
(4)
其中Y1代表样品在主成分1中的得分,Y2代表样品在主成分2中的得分;G1指主成分1的贡献率,G2指主成分2的贡献率。
不同发酵时间无花果酵素的综合评价指标如图9所示,发酵的10~20天,CEI值变化缓慢,发酵的20~60天,CEI值呈线性快速上升,在第60天时达到最大值1.17;在发酵的60~80天,CEI值变化不明显,与前面主成分样品得分的结果相吻合,发酵60天与发酵80天的无花果酵素性质差异不大。发酵80天后,综合评价指标值持续降低,说明无花果酵素自然发酵的时间适合在发酵60~80天这一时间段结束,或者在这一时间段可以补充碳源等营养物质,进行后续发酵。
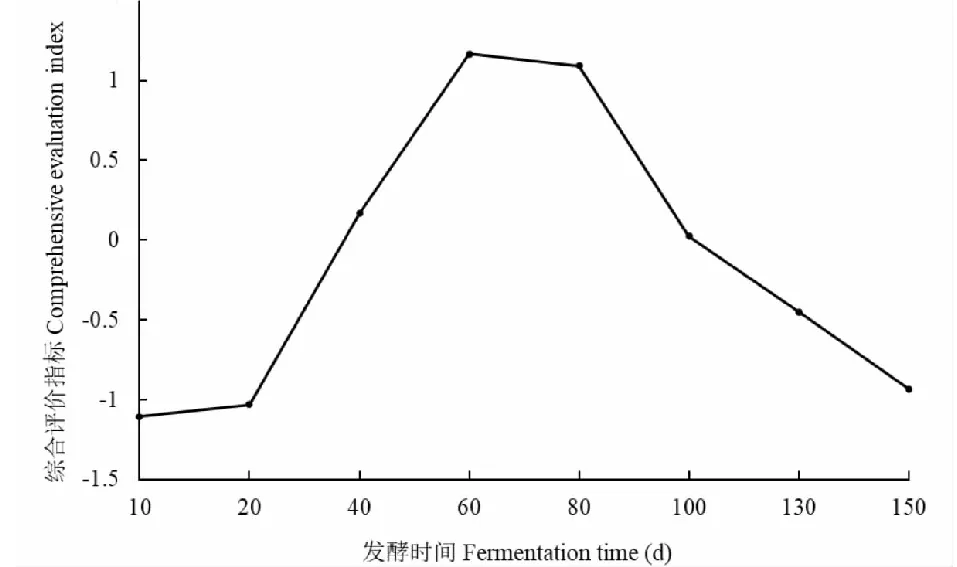
图9 无花果酵素综合评价指标Fig.9 Comprehensive evaluation index of fig enzyme
3 结论
目前关于无花果酵素的研究鲜有报道,本文的研究结果表明,发酵过程中pH值持续降低,总黄酮呈波动式上升趋势,总酸、总酚、DPPH自由基、羟基自由基、超氧自由基清除能力和还原力均呈现先升高后降低的趋势,但是DPPH自由基和羟基自由基清除能力在发酵后期表现出不规则变化,因此延长发酵时间不利于抗氧化能力的提高。无花果酵素中有机酸组成及含量丰富,不仅具有常见的乳酸、柠檬酸、苹果酸、琥珀酸,还含有大量的葡萄糖醛酸和泛酸。相关性分析表明,无花果酵素中的柠檬酸、苹果酸、富马酸、泛酸对其抗氧化活性起着重要的作用。综合评价指标分析结果表明,发酵第60天综合得分最高,发酵80天后出现明显下降的趋势,此可以作为无花果酵素前发酵结束的依据。无花果酵素中代谢产物及抗氧化活性的变化均是微生物消亡和适应的结果,因此有必要对无花果酵素自然发酵过程中微生物菌群变化开展研究,以期对无花果酵素的发酵过程实施更精准的调控,指导实际生产,获得更优质的酵素产品。

