一株具有拮抗作用黄精内生菌HJ-3的鉴定及抗菌活性研究
吕彩云,夏 娟,林永翔,刘小壮,相爱标,郑亚文,柏晓辉
黄山学院生命与环境科学学院,黄山 245041
内生菌是一种栖息于健康植物组织中,在长期进化过程中,与植物宿主之间建立和谐共生关系。研究发现植物内生菌在植物病害生物防治方面[1,2]具有巨大应用潜能。也有研究表明,植物内生菌能够产生与宿主相同或相似的代谢产物,尤其是药用植物内生菌[3,4]产生的一些代谢产物对人类疾病有很好的疗效,已被报道作为治疗如癌症,肿瘤以及细菌和真菌感染治疗剂[5,6]。比如Bos等[7]报道用传统的加拿大药用植物Heracleummaximum分离的内生菌提取物具有抗分枝杆菌活性,可作为抗癌天然产物研究;Seo等[8]研究发现萝卜中的内生菌对病原菌具有抗菌活性,可用作对抗人类和植物病原体的生物防治剂等等。
多花黄精(Polygonatumcyrtonema)为百合科黄精属植物,主要成分为甾体皂苷类和黄精多糖,在增强免疫力、抗肿瘤、降血糖以及抑菌等方面具有非常重要的药理作用[9]。作为药食同源植物,现已广泛应用于药品、食品、化妆品等领域,但大部分产品处于初加工阶段,还需对黄精药效成分进行深入研究,开发更多的黄精精深加工产品。有关黄精内生菌的文献报道并不多,如Li[10]从泰山黄精中分离到具有抑菌活性的内生真菌;Wang[11]从浙江多花黄精中分离到内生真菌进行抗菌代谢产物研究。而植物内生菌因其宿主植物地域不同,生长阶段不同,组织部位不同,内生菌种类也不同。Bai、Zhai等[12,13]从安徽黄精中分别筛选到内生菌株芽孢杆菌和枯草芽孢杆菌进行了抑菌活性研究。本研究从安徽黄精中分离到另外一株具有拮抗作用的内生菌株HJ-3,对其进行分类鉴定、活性研究及代谢产物分析,以期为丰富黄精内生菌资源及开发利用奠定基础。
1 材料与方法
1.1 实验材料
1.1.1 植物样品
样品于2015年8月采集自安徽省牯降自然保护区,经黄山学院方建新老师和潘健博士鉴定为多花黄精,采集后于4 ℃保存备用,并在24 h内完成菌种分离。
1.1.2 供试菌株
供试植物病原真菌:盘长孢状刺盘孢(CollettrichumgloeosporioidesPenz,Cg)、番茄尖镰孢菌(Fusariumoxysporumf.sp.lycopersici,Fl)、尖孢镰刀菌(Fusariumoxysporumf.sp.vasinfectum,Fv)、核盘菌(Sclerotiniasclerotiorumde Bary,S)、禾生腐霉(Pythiumgramineacola,P)、新月弯孢(Curvularialunata,Cl)、禾谷镰刀菌(Fusariumgraminearum,Fg)、立枯丝核菌(RhizoctoniasolaniKühn,R)。
供试细菌:金黄色葡萄球菌(Staphylococcusaureus,S)、大肠杆菌(Escherichiacoli,E)、苏云金杆菌(Bacillusthuringiensis,Bt)、枯草芽孢杆菌(Bacillussubtilis,Bs);以上菌株均购于中国典型培养物保藏中心并保存于黄山学院生命与环境科学学院微生物学实验中心。
1.1.3 主要试剂
细菌基因组抽提试剂盒(Takara(北京)生物有限公司);二甲基亚砜(DMSO)、乙酸乙酯、丙酮和75%酒精等均为分析纯试剂(上海国药集团);葡萄糖、蛋白胨、酵母提取物、琼脂等生化试剂(上海生工生物有限公司);甲醇、甲酸均为色谱纯(美国 Fisher公司):纯水为MliQ系统纯化水(美国Millipore公司)。
1.1.4 主要仪器
DSX280B型高压蒸汽灭菌锅(上海申安医疗器械有限公司);MQD-B2R型振荡培养箱(上海旻泉仪器有限公司);ZGP-2050型恒温培养箱(上海智城分析仪器制造有限公司);OSB-2100型旋转蒸发仪(上海爱朗仪器有限公司);FST-III-30超纯水机(上海富诗特仪器设备有限公司);AERIS-GB096快速型PCR 仪(上海艺思高科技有限公司);BG-gdsAUTO320凝胶成像系统(北京百晶生物技术有限公司);S-3400N型扫描电镜(日本日立公司);UPLC H-CLASS+QTOF G2-XS超高效液相色谱串联四极杆飞行时间质谱仪(美国 Waters公司),配有电喷雾离子源(ESI),MassLynx V4.1软件。
1.1.5 供试培养基
LB液体培养基:酵母提取物5 g/L,蛋白胨10 g/L,氯化钠10 g/L,pH 7.0~7.2,用于内生菌的培养。
葡萄糖马铃薯固体培养基(PDA):马铃薯200 g/L,葡萄糖20 g/L、琼脂20 g/L,自然pH。用于病原真菌的培养。
1.2 实验方法
1.2.1 供试菌株活化培养
挑取保存于斜面培养基上的植物病原菌菌丝体接种于PDA培养基,于28 ℃培养,转接2次,待菌丝长到培养皿2/3时,作为供试病原真菌,4 ℃保存备用。
挑取保存于斜面培养基上的细菌在固体LB培养基平板上划线活化,接种环挑取单菌落转接至液体LB培养基,37 ℃ 180 rpm培养12 h,作为供试细菌,4 ℃保存备用。
1.2.2 内生菌分离纯化
参照文献[14,15]方法,将实验材料经水洗后,用5%(V/V)次氯酸钠溶液处理5 min;ddH2O漂洗4次后用75%(V/V)乙醇溶液处理5 min,ddH2O漂洗4次并吸去残留无菌水;再将其无菌切割成3 mm左右片段后分别种植于PDA和LB培养基;同时以随机选取的根茎片段,将其两端切口灼烧后种植于上述培养基作为对照。于28 ℃培养3~5天,待切口处长出菌落后,挑取菌体转接至培养基进一步分离纯化,直至纯化为单一纯种菌落;将纯种菌转接到斜面培养基上保存备用。
1.2.3 内生菌分类鉴定
依据微生物学常规实验方法对内生菌进行菌落形态特征观察,并用扫描电镜进行菌体观察;同时利用革兰氏染色镜检,结合东秀珠等编写的《常见细菌系统鉴定手册》进行初步鉴定。
采用细菌基因组抽提试剂盒提取内生菌株全基因组DNA,利用细菌16S rRNA通用引物27F:5′-AGAGTTTGATCCTGGCTCAG-3′和1 492R:5′-TACGGCTACCTTGTTACGACTT-3′进行扩增[12],PCR反应条件为:95 ℃ 5 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 40 s,35 个循环;72 ℃ 10 min。将扩增产物利用1.2%琼脂糖凝胶电泳检测,切胶纯化后送至上海生工有限公司测序。将测得的序列经过拼接后,利用NCBI数据库中的BLAST进行比对,检索与其同源序列。选择与待鉴定菌株同源性较高的菌株序列,利用Clustal Χ软件进行比对,再结合MEGA 6.0软件中Neighbor-Joining算法构建系统进化树,确定该内生菌株的系统发育学地位。
1.2.4 内生菌对8种植物病原真菌拮抗活性观察
参考文献采用五点对峙培养法[16],观察内生菌对8种植物病原真菌的拮抗作用。在PDA固体培养基平板正中央接入直径为6 mm的供试病原真菌菌饼,同时在平板4个距供试真菌菌饼2.5 cm处接入相同大小的内生菌菌饼,以只在平板中央接入病原真菌作为空白对照组,于28 ℃恒温培养,每隔24 h观察1次,每组处理做三个平行,试验重复两次。观察病原真菌的生长状态,测量病原真菌菌落直径,计算病原真菌菌株的抑制率,拍照记录。
抑制率=(对照组菌落直径-
处理组菌落直径)/对照组菌落直径×100%
1.2.5 内生菌发酵产物提取
将活化的单菌落接种于PD培养液,于28 ℃ 180 rpm培养12 h获得种子液。按照1/40(V/V)比例将种子液进一步扩大培养,于28 ℃ 180 r/min培养7天,定时观察培养液情况。
取发酵7天后的培养液,经离心过滤,按照1∶1.5(V/V)比例在发酵液中加入乙酸乙酯萃取,萃取3次;旋转蒸发仪浓缩,再用丙酮溶解转至干净试剂瓶内,自然风干,获得内生菌发酵产物。用灭菌的100%二甲基亚砜(DMSO)将获得的发酵产物配成100 mg/mL贮存浓度,于4 ℃保存备用。
1.2.6 观察内生菌发酵产物对4种供试菌的抑菌活性
用LB液体培养基将供试菌分别培养至OD600为0.2~0.3,取100 μL菌液分别均匀涂布到LB平板上制备菌平板;将平板4等分,在每一部分贴上直径为6 mm的无菌滤纸片。将贮存的100 mg/mL发酵产物用灭菌的DMSO分别稀释至60、40、20、10 mg/mL 4个浓度梯度,选择0.22 μm针头过滤器除菌后,分别取10 μL滴加至上述无菌滤纸片上,同时以滴加DMSO到滤纸片为对照,于37 ℃倒置培养12 h左右,重复3次,观察结果。测定抑菌圈的大小,取均值,拍照并记录。
1.2.7 内生菌发酵产物LC-MS检测
采用色谱条件:色谱柱Waters BEH C18(2.1 mm ×50 mm,1.7 μm);流速0.3 mL/min;柱温30 ℃;进样量1 μL;流动相甲醇(A)和0.1%甲酸水溶液(B);梯度洗脱条件:0~1 min,5% B;1~10 min,5%→90% B;10~15 min,90% B。
质谱条件:电喷雾离子源(ESI),正负离子扫描模式;扫描范围m/z50~1 500;毛细管电压3 kV;锥孔电压40 V;离子源温度120 ℃;干燥气温度550 ℃;干燥气流量900 L/h。
将按照“1.2.5”所制备的内生菌发酵产物过0.22 μm微孔滤膜,待LC-MS。
2 结果与分析
2.1 内生菌鉴定结果
2.1.1 形态学鉴定
经分离纯化所获得内生菌菌株在LB培养基上生长情况(见图1)。可见,该菌株在LB培养基上形成的单菌落,均为圆形,菌落较大,表面粗糙隆起,不透明,中间有凹槽,边缘不光滑,呈辐射状。经革兰氏染色呈紫色,疑似革兰氏阳性菌,在油镜下可见部分细菌具有明显芽孢结构。经扫描电镜观察(见图2),可见该菌体呈杆状、圆端,菌体大小为1.5~1.9 μm ×0.5~0.6 μm。
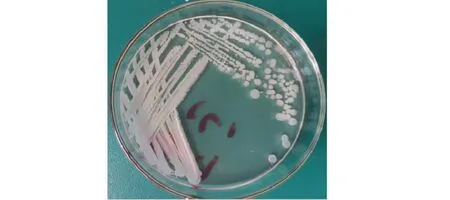
图1 菌株HJ-3 纯化培养情况Fig.1 Purification and culture of strain HJ-3

图2 内生菌株HJ-3扫描电镜图Fig.2 Scanning electron microscopy of endophytic strain HJ-3
2.1.2 分子鉴定
用16S rRNA通用引物对所获得的内生菌基因组DNA进行PCR扩增,经1.2%琼脂糖凝胶电泳结果(见图3),可见获得与预期相符的约1 500 bp目的片段,将PCR扩增产物经纯化后送至生物公司测序后,所获得序列进入NCBI 数据库进行 BLAST同源性比对,利用ClustalΧ和MEGA软件分析并绘制进化树(见图4),结果表明:该内生菌菌株与贝莱斯芽孢杆菌16S rDNA 序列相似度最高,在发育进化树上与贝莱斯芽孢杆菌聚为一簇。因此将该内生菌菌株鉴定为贝莱斯芽孢杆菌(Bacillusvelezensis),该菌株命名为HJ-3。
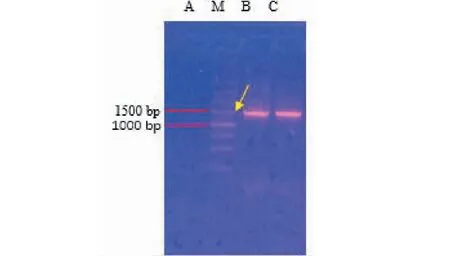
图3 16S rRNA通用引物PCR扩增产物电泳结果图Fig.3 Electrophoresis results of PCR amplification products with 16S rRNA universal primers注:M:DNA Mark;A:阴性对照;B:菌株HJ-3;C:阳性对照。Note:M:DNA Mark;A:Negative control;B:Strain of HJ-3;C:Positive control.
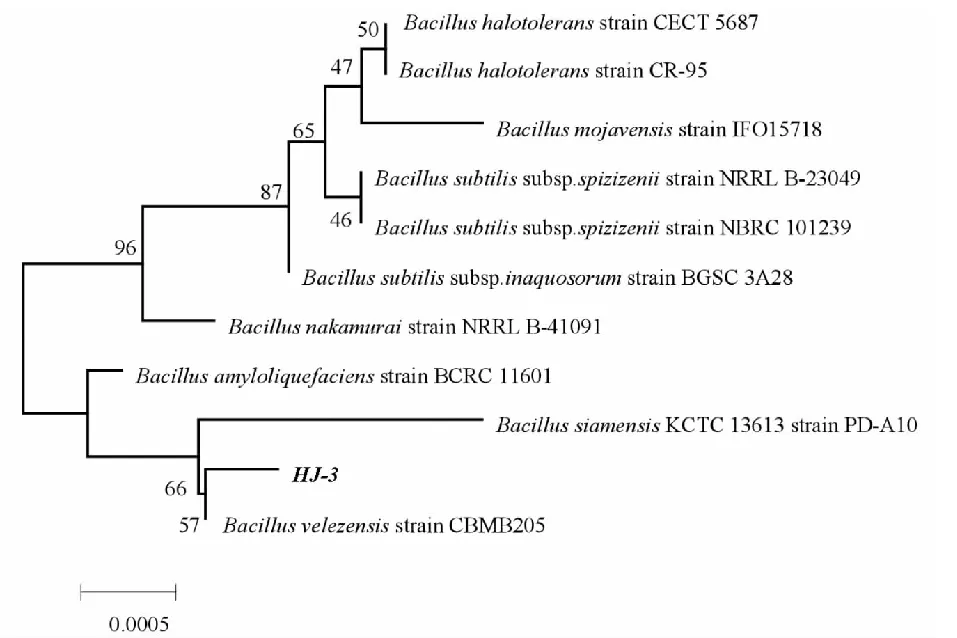
图4 菌株HJ-3的16S rRNA系统发育树Fig.4 Phylogenetic tree of 16S rRNA of strain HJ-3
2.2 内生菌株HJ-3对病原真菌的拮抗活性
采用五点对峙培养法,测定内生菌株HJ-3对8种常见的植物病原真菌的对峙作用(见图5),结果表明,菌株HJ-3对盘长孢状刺盘孢、番茄尖镰孢菌、尖孢镰刀菌、核盘菌、禾生腐霉、新月弯孢、禾谷镰刀菌及立枯丝核菌8种病原真菌均表现出较为明显的抑制作用,通过计算抑制率分析绘图(见图6),可见在这8种病原真菌中,菌株HJ-3对立枯丝核菌的对峙作用非常明显,抑制率高达81.90%;新月弯孢、禾生腐霉、尖孢镰刀菌、禾谷镰刀菌、核盘菌和番茄尖镰孢菌这六种病原真菌抑制率分别为78.74%、73.87%、73.87%、72.16%、71.37%和70.37%,抑制率均超过70%,对峙作用明显;而盘长孢状刺盘孢抑菌制率为64.02%,在这8种病原真菌中抑制率最低。
2.3 内生菌发酵产物对供试细菌的抑菌活性
采用滤纸片扩散法检测内生菌HJ-3不同浓度的发酵产物对4种供试细菌的抑菌活性。从图7可见,内生菌发酵产物对金黄色葡萄球菌、大肠杆菌、苏云金芽孢杆菌以及枯草芽孢杆菌4种供试菌均有抑菌作用。从图8结果可知,不同浓度发酵产物作用于金黄色葡萄球时,发酵产物浓度为40 mg/mL时抑菌效果最明显,抑菌圈直径达16 mm左右;当浓度为10 mg/mL,抑菌圈直径11 mm左右,差异最显著。不同浓度发酵产物作用于苏云金芽孢杆菌时,发酵产物浓度为60 mg/mL时抑菌效果最明显,抑菌圈直径达13 mm左右。而不同浓度发酵产物作用于大肠杆菌和枯草芽孢杆菌时,抑菌效果基本相似,随着浓度升高,抑菌作用增强。从图8明显可以看出,发酵产物浓度不同,对各种供试菌的抑菌效果不同。四种供试菌中,内生菌HJ-3的发酵产物对金黄色葡萄球菌的抑菌效果要高于其他的三种供试菌。

图5 内生菌株HJ-3对8种病原真菌的拮抗效果Fig.5 Antagonistic effect of endophytic strain HJ-3 on eight pathogenic fungi
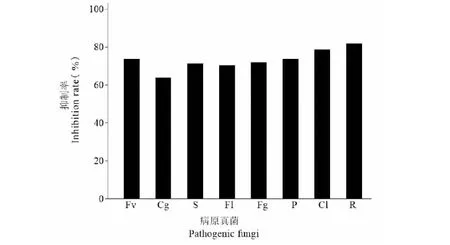
图6 内生菌株HJ-3对8种病原真菌的抑制率Fig.6 Inhibition rate of endophytic strain HJ-3 against eight pathogenic fungi
2.4 内生菌发酵产物LC-MS检测分析
取发酵液进LC-MS分析,正负模式总离子流见图9,同培养液对比,发酵液中检出了多种组分,其中1号信号峰m/z为339.232 6[M-H]-,经仪器软件自带插件Element composition计算其元素组成为C23H32O2,对该物质做二级质谱,采集信号如图10所示,该化合物产生特征碎片m/z163.112 1为[M-H-C12H17O]-,从Chemspider及文献[17]中查阅到该组分的分子式结构。由Chemdraw画出该物质结构式经质谱仪器软件自带插件Massfragment识别出该物质碎裂过程,该物质可能从中间断裂,脱落后形成m/z163.112 1碎片。与吴盼关于桦褐孔菌发酵液研究的文献[14]报道的化合物相吻合,确定化合物为5,5′-methylenebis(2-tert-butyl-4-methylphenol),是一种酚类物质,裂解示意图见图10。经文献[18]可知,桦褐孔菌发酵液在抗菌、抗肿瘤、抗氧化等方面具有生物活性功效。同时经正负模式及其加氢/脱氢和加钠比较分析,发现2号峰m/z1 006.633 7[M-H]-、3号峰m/z1 020.652 3[M-H]-、4号峰m/z1 034.674 1[M-H]-分别相差-CH2,应为同系物,经仪器原件自带插件推算分子式分别为C55H93NO15、C56H95NO15、C57H97NO15。分析这些化合物,发现都具有特征性的离子碎片m/z678.475 3[M-H]-、m/z452.285 2[M-H]-、m/z339.202 3[M-H]-,进一步说明2、3、4号化合物含有共同的基团,可能是同系列化合物,至于何种化合物有待下一步解析。
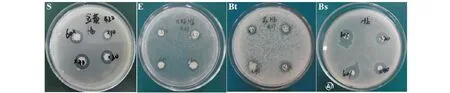
图7 内生菌株HJ-3发酵产物对不同供试菌的抑菌效果Fig.7 Antibacterial effects of fermentation products of endophytic strain HJ-3 on different tested bacteria

图8 内生菌株HJ-3发酵产物对不同供试菌的抑菌圈直径Fig.8 Diameters of inhibitory zone of fermentation products of endophytic strain HJ-3 against different tested bacteria注:*P<0.05,**P<0.01,***P<0.001。

图9 正负离子模式下发酵液总离子流图Fig.9 Total ion flow diagram of zymotic fluid in positive and negative ion mode
3 讨论与结论
内生菌在与宿主共生的过程中会产生许多具有药用价值的生物活性物质,在抗癌、抗菌、抗氧化等人类疾病防治以及农业病虫害防治领域具有潜在的价值。国内外针对内生菌相关的研究报道很多,比如Halim等[19]从水稻田的根叶中分离出BCA 3和BCA 12两种内生菌,研究发现其对细菌性叶枯病(BLB)具有积极的拮抗活性;灰葡萄孢是最重要的收获后真菌病原体之一,Chao等[20]从不同植物中筛选出内生细菌,发现对番茄中的灰葡萄孢具有生防作用;本课题获得的内生菌HJ-3研究发现对植物病原真菌具有拮抗作用,而且表现出广谱的拮抗活性。Zhang等[21]从小麦小穗中分离出一株具有广谱拮抗细菌XS-2,发现对小麦赤霉病(FHB)的病原体禾谷镰刀菌、棉花病原体立枯丝核菌等6种植物病原体具有抑制作用,抑菌圈在10~29.58 mm之间,使其成为宝贵的生物资源,用于开发生物防治剂。本课题所获得的内生菌HJ-3对立枯丝核菌、禾谷镰刀菌等植物病原真菌具有同样抑制效果,所不同的是该内生菌不是从农作物分离,而是从药用植物黄精分离。科学家研究表明,从植物尤其是一些药用植物分离内生菌,可以抑制病原细菌、病原真菌生长,原因可能是内生菌与药用植物共生过程中会产生代谢产物,这些代谢产物对病虫害或病原菌产生抑制作用[22]。Bai等[12,13]从药用植物黄精中分离出内生菌株HJ-1和HJ-2,发现其发酵产物对绿脓杆菌、金黄色葡萄球菌等病原细菌具有很好的抑制作用,本研究从药用植物黄精分离内生菌HJ-3,也表现出对常见病原菌广泛的抑菌作用,但本研究重点探讨了内生菌对植物病原真菌的拮抗作用,进而丰富了黄精内生菌潜在应用价值。已有资料表明,从药用植物筛选内生菌用于生产具有药用价值的生物活性化合物,特别是从濒临灭绝的宿主植物内生菌中生产有用的生物活性化合物,成为新药开发生物活性化合物的重要来源之一。
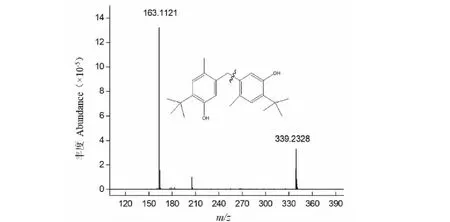
图10 化合物C23H32O2化学结构图和MS图谱Fig.10 Chemical structure and MS spectra of compound C23H32O2
该课题是从安徽道地药材黄精内筛选到一株内生菌株HJ-3,经形态初步鉴定以及16S rRNA分子生物学方法测序,将该菌株鉴定为贝莱斯芽孢杆菌(Bacillusvelezensis)。贝莱斯芽孢杆菌因其具有广谱的抗菌活性、促进植物生长的作用以及具有作为生物表面活性剂的潜力被广泛应用到工农业和环境保护领域,还可以作为饲用微生物菌剂,同时有望在医疗保健方面发挥更重要的作用。但同种不同株B.velezensis在功能上存在着差异,因此还需要进一步发掘自然界中B.velezensis的新菌株资源,以开发利用新功能菌株。Chi等[23]也从多花黄精内分离到贝莱斯芽胞杆菌株ZJU-3,研究了内生菌及其代谢产物对尖孢镰刀菌拮抗活性。本研究所分离的B.velezensis菌株HJ-3对植物病原真菌除了尖孢镰刀菌外,还有盘长孢状刺盘孢、番茄尖镰孢菌、核盘菌、禾生腐霉、新月弯孢、禾谷镰刀菌及立枯丝核菌均有抑制作用,尤其是对立枯丝核菌具有非常明显抑制作用,其次是新月弯孢、禾生腐霉、尖孢镰刀菌、禾谷镰刀菌、核盘菌和番茄尖镰孢菌。由此可见,本研究所获得的黄精内生菌HJ-3对常见植物病原真菌具有广谱的拮抗活性,其研究结果对农业病虫害生物防治具有一定指导意义。此外研究发现,内生菌株HJ-3的发酵产物对常见细菌表现出广泛抑菌效果,尤其是对金黄色葡萄球菌,抑菌作用最为明显,其中金黄色葡萄球菌是临床常见的病原菌,其抗生素耐药现象非常常见。因此,寻找有效的抗菌药物,尤其是从天然产物中寻找新型的抗菌药物对于细菌性疫病的防治具有非常重要的意义,也是解决细菌耐药性问题的方法之一。
经以上研究表明,从中药黄精中筛选到的HJ-3内生菌株对多种植物病原真菌具有明显的拮抗效果,其发酵产物能抑制大肠杆菌等常见细菌的生长。通过UPLC-MS/MS,从内生菌发酵产物中检测到5,5′-methylenebis(2-tert-butyl-4-methylphenol)酚类化合物,同时获得三个同系列化合物。本研究获得数据将为进一步挖掘黄精内生菌发酵产物中的活性成分奠定基础,也为植物内生菌药物广泛应用提供依据。

