舒敏中药提取物制备及其功效评价研究
王 领,董银卯,张守文*
1国家药品监督管理局高级研修学院,北京100073;2北京工商大学化学与材料工程学院,北京100048
常见的皮肤过敏反应在医学上称作超敏反应,又称变态反应,是指机体受到某些抗原刺激时,出现以生理功能紊乱或组织细胞损伤为主的异常特异性免疫应答。其发生取决于两个因素:抗原的刺激和机体的反应性,诱发过敏反应的抗原称为过敏原[1]。皮肤产生过敏时会出现皮肤干燥、疼痛、瘙痒现象,严重时更可能伴有红肿、疱疹等症状,给人们的日常生活带来了很大影响。因此,舒敏类化妆品研发成为该领域研究热点之一[2]。
2020年颁布的《化妆品监督管理条例》中提出:“国家鼓励和支持化妆品生产经营者采用先进技术和先进管理规范,提高化妆品质量安全水平;鼓励和支持运用现代科学技术,结合我国传统优势项目和特色植物资源研究开发化妆品”。这也是政府首次从法律层面提出利用特色植物资源研究开发化妆品,这将大大促进植物资源化妆品的研发和创新。
本文在前期单味中药筛选的研究基础上,将六味中药运用中医“君臣佐使”思想进行组方,具有抗病原微生物、消炎、解热、镇痛、增强免疫等作用[3]的香薷和具有清热解毒功效[4]的山慈菇为“君药”,起到抗敏、消肿止痒之功效;具有抗炎、镇静等药理活性的独活[5]为“臣药”,起到抗炎杀菌之功效;可消肿止痛[6]的三棱和对皮肤无刺激性、抗氧化[7],具有抗病原微生物药理活性[8]的孩儿茶为“佐药”,起到行气止痛、快速修复皮肤之功效;远志为“使药”,起到调和药性,提高皮肤屏障之功效。继续研究组方提取制备工艺,验证组方提取物舒敏功效,并探究其作用机理,以期为其在医药和化妆品领域中的应用提供理论依据和数据支撑,该组方提取物现已授权国家发明专利(专利号ZL202010224890.X)。
1 材料与方法
1.1 材料
所用六味中草药经原山东宏济堂中药研究院副院长、范圣此研究员基源鉴定,分别为香薷(Elsholtziaciliata(Thunb.) Hyland.干燥全株)、山慈菇(独蒜兰Pleionebulbocodioides(Franch.) Rolfe.干燥假鳞茎)、独活(重齿毛当归Angelicabiserrata(Shan et Yuan) Yuan et Shan干燥根)、三棱(黑三棱SparganiumstolonierumBuch.-Ham.干燥块茎)、孩儿茶(Acaciacatechu(L.f.) Willd.干燥去皮枝)、远志(PolygalatenuifoliaWilld.干燥根)。
透明质酸酶(Sigma,货号:H3884);透明汉生胶(Maya,货号:NZJ-132);1,3-丁二醇(Aladdin,货号:B111018);EDTA-2Na(Clariant,批号:12101528);透明质酸钠(华熙生物,批号:20022543);海藻糖(Hayashibara,批号:12091330);合成角鲨烷(西安康诺化工有限公司,批号200312A);棕榈酸乙基己酯(Basf,批号:19040153);辛酸/癸酸甘油三酯(Croda,批号:mct600421);辛酰羟肟酸、1,2-乙二醇、1,3-丙二醇(广州华良化工有限公司,批号:191125-32);硬脂酸甘油酯/PEG-100硬脂酸酯(昆山晟安生物科技有限公司,批号:19060855);甘油葡糖苷(湖北汉达飞生物科技有限公司,批号:1207698);甘草酸二钾(亿利耐雀生物科技有限公司,批号:18020201);六味中药材(北京同仁堂);组方提取物(自制)、去离子水(自制)等。
1.2 仪器
AL104电子天平(梅特勒-托利多仪器(上海)有限公司);HH-S6/ZK6电热恒温水浴锅(巩义市予华仪器有限责任公司);T18 digital剪切分散机、EUROSTAR 200 digital悬臂搅拌机(德国IKA公司);VISIA面部图像分析仪(美国Canfield公司);Cutometer MPA 580(Tewameter TM300、Corneometer CM825、Mexameter MX18、Skin-pH meter pH905)(德国Courage + Khazaka公司);N4S 紫外可见分光光度计(上海仪电分析仪器有限公司);8 mm(20 μL)聚丙烯涂层(PP Coated)斑试器(上海揽宝公司)等。
1.3 实验方法
1.3.1 中药组方提取物制备
按质量比称取中药,香薷∶山慈菇∶独活∶三棱∶孩儿茶∶远志=6∶5∶2∶2∶1∶1,6味中药共100 g,经粉碎机粉碎,取粒度为40~100 目的中药颗粒50 g,加入15倍70%乙醇,60 ℃回流提取150 min;提取完成后将混合物冷却至35 ℃,过滤除去滤渣,滤液称重后,加入0.8%~1%的活性炭脱色,55~60 ℃脱色60~80 min,过滤除去活性炭,取滤液备用;将滤液在0.08 Mpa,40~45 ℃条件下进行减压浓缩,至浸膏状无明显乙醇味,得到中药提取物浸膏;将中药提取物浸膏与1,3-丁二醇(充当溶剂作用)按质量比例为1∶50混合,充分搅拌溶解后过滤,得到组方提取物。
1.3.2 组方舒敏乳的制备
化妆品配方设计见表1。

表1 舒敏乳组方Table 1 The formulation of cosmetic emulsions

续表2(Continued Tab.2)
制备工艺:称取A相各物质,混合并充分分散后,升温至85 ℃,保温30 min,备用;称取B相各物质,混合并加热至75 ℃,完全溶解并搅拌均匀,备用;将B相加入到A相中,乳化3 min,乳化速度为3 000~4 000 rpm;将乳化后的料体缓慢搅拌降温,至45 ℃加入C相各物质,搅拌均匀;料体冷却至室温,出料灌装。
1.4 组方提取物功效评价
1.4.1 透明质酸酶活性抑制实验[9]
实验浓度分别采用1.0%、2.0%、4.0%、6.0%、8.0%(组方提取物在体系中的质量百分比)来测定组方提取物对透明质酸酶活性抑制效果。
1.4.1.1 所需溶液配制
醋酸缓冲溶液:量取1.155 mL冰乙酸稀释至100 mL混匀,取其中4.8 mL为A溶液;称取2.72 g乙酸钠结晶,加水溶解定容至100 mL混匀,取其中45.2 mL为B溶液;混合A、B溶液,以水定容至100 mL,混匀。
透明质酸酶溶液:称取10 mg透明质酸酶于烧杯中,加入4 mL醋酸缓冲溶液,摇匀备用。
透明质酸钠溶液:称取5 mg透明质酸钠于烧杯中,加入10 mL醋酸缓冲溶液,摇匀备用。
埃尔利希试剂(Ehrlich reagent):称取0.8 g对-二甲氨基苯甲醛,溶于15 mL浓盐酸和15 mL无水乙醇中。
乙酰丙酮溶液:取3.5 mL乙酰丙酮,溶于50 mL 1.0 mol/L的碳酸钠溶液中,用前配制。
1.4.1.2 实验方法
取0.25 mmol/L的CaCl2溶液0.1 mL和透明质酸酶溶液0.5 mL,37 ℃保温培养20 min;加入不同浓度的组方提取物0.5 mL,继续37 ℃保温培养20 min;加入0.5 mL透明质酸钠液37 ℃保温30 min,常温放置5 min;加入0.1 mL 0.4 mol/L NaOH溶液和0.5 mL乙酰丙酮溶液,置于沸水浴中加热15 min,立即用冰水冷却5 min;加入埃尔利希试剂1.0 mL,并用3.0 mL无水乙醇进行稀释,放置显色20 min,期间对试样进行450~700 nm范围的波长扫描,确定最大吸收波长,在最大吸收波长处用分光光度计测定其吸光度值。样品对透明质酸酶抑制率的计算公式如下:
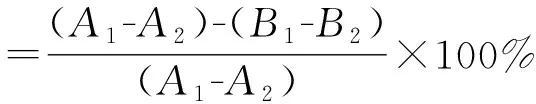
式中:A1为参比溶液吸光值,用去离子水代替所得试样;A2为参比空白溶液吸光值,用去离子水代替所得试样,用醋酸缓冲溶液代替透明质酸酶和透明质酸钠溶液;B1为试样溶液吸光值;B2为试样空白溶液吸光值,用醋酸缓冲溶液代替透明质酸酶和透明质酸钠溶液。
1.4.2 自由基清除实验
1.4.2.1 清除DPPH自由基实验[10]
准确称取20 mg DPPH,用无水乙醇定容至250 mL,得到浓度为20 mmol/L的DPPH·溶液,将组方提取物分别用去离子水稀释成不同浓度的测试液。取2 mL测试液和2 mL 20 mmol/L DPPH·溶液混匀,反应30 min,测定517 nm波长下吸光度的变化,对照溶剂用无水乙醇代替。样品对DPPH自由基清除率的计算公式如下:

式中:A1为2 mL DPPH·溶液与2 mL不同浓度的组方提取物组成的混合液的吸光度;A2为2 mL DPPH·溶液与2 mL无水乙醇组成的混合液的吸光度;A3为2 mL不同浓度的组方提取物与2 mL无水乙醇组成的混合液的吸光度。
1.4.2.2 清除超氧阴离子自由基实验[11]
取0.05 mol/L pH 8.2的Tris-HCl缓冲液4.5 mL,于25 ℃水浴中放置20 min,分别加入1 mL不同浓度组方提取物溶液和25 mmol/L的邻苯三酚溶液0.4 mL,混匀后于25 ℃水浴中反应5 min,加入8 mol/L的HCl溶液1.0 mL终止反应,以Tris-HCl缓冲液作参比,在299 nm处测定吸光值,计算清除率。空白对照组以1 mL试样溶剂代替样品,每个处理均做三个重复。样品对超氧阴离子自由基清除率的计算公式如下:
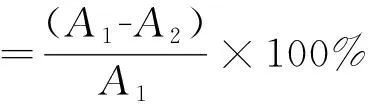
式中:A1为空白的平均吸光度;A2为组方提取物的平均吸光度。
1.4.2.3 清除羟基自由基实验[12]
羟基自由基由Fenton反应产生,·OH氧化水杨酸产生对510 nm有特征吸收的2,3-二羟基苯甲酸,通过测定水杨酸捕获·OH所得到的产物确定·OH的清除率。在25 mL比色管中加入2 mmol/L FeSO4和1 mmol/L H2O2各3 mL,摇匀,再加入6 mmol/L 水杨酸3 mL,摇匀,于37 ℃水浴加热15 min后取出,测其吸光度A1。然后分别加入不同浓度的组方提取物1mL,摇匀,继续水浴加热15 min,取出测其吸光度A2。
样品对羟自由基清除率的计算公式:
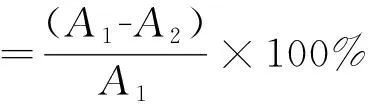
其中:A1为空白的平均吸光度;A2为组方提取物的平均吸光度。
1.4.3 抑制KU812细胞中组胺释放实验[13]
人外周血嗜碱性(KU812)细胞常被用作研究过敏反应的效应细胞,其与人体肥大细胞具有很大的相似性,适合用于建立人类肥大细胞激活和脱颗粒模型。实验采用KU812细胞组胺释放模型,考查组方提取物对KU812细胞组胺释放的影响。
1.4.3.1 样品配制及处理
以DMSO配制组方提取物溶液,母液浓度为50 mg/mL,用时以含10%胎牛血清培养基稀释,高、中、低浓度为1 000、500、250 μg/mL。
1.4.3.2 细胞培养及模型建立
用含10%胎牛血清的IMDM培养基进行稀释细胞,将细胞密度调整为2.2×106个/mL,然后将得到的细胞悬液,接种于96孔板中,每孔接种量为180 μL。分为模型对照组、组方提取物高、中、低剂量组、空白对照组、每组设6个复孔,37 ℃、5%CO2培养箱培养静置10 min,受试样品组分别加入相应浓度剂量的组方提取物溶液20 μL(终浓度分别为200、100、50 μg/mL),空白对照组和模型对照组分别加入20 μL培养液,置培养箱中预温孵,2 h后除细胞空白对照组外,各组细胞加入刺激剂40 nM巴豆醇、12-十四烷酸酯-13-乙酸酯(PMA)、1 μm钙离子载体A23187,PMA和A23187使用DMSO配制。空白对照组加入同体积含等浓度DMSO培养基。
1.4.3.3 指标检测
2 h后离心分离细胞,收集细胞上清液,测定上清液中组胺含量。
1.5 组方舒敏乳功效评价
化妆品的功效宣称应当有充分的科学依据,功效宣称依据包括文献资料、研究数据或者化妆品功效宣称评价试验结果等。
1.5.1 功效评价实验方案
参照GB17149-1997《化妆品皮肤病诊断标准及处理原则总则》,选取无诊断相关者。挑选符合筛选的受试者为试验对象,在鼻唇沟和左侧面颊部局部应用10%乳酸溶液,相应的对照组用去离子水。鼻唇沟处角质层通透性较高,附属器官及神经网络丰富,刺痛感较明显。在2.5 min及5 min时对受试者的瘙痒、刺痛、灼痛感的不适程度进行四分法评定。刺痛程度(无:0;轻微:1;中度:2;重度:3)。如果两次试验之和大于或等于3,则可判定受试者是刺痛敏感个体,属于敏感性皮肤,将其纳入功效评价受试人员名单,预计纳入30人。试者每日早中晚清洁皮肤后凃组方舒敏乳于面部,早晚各1次。使用样品第7天、14天、21天回访,记录数据及使用效果。
1.5.2 数据分析
应用 SPSS软件对各个测量值进行描述性统计,包括数量、均值、标准差等。所有指标数据,进行配对t检验,分析使用产品前后皮肤参数是否具有显著性差异。
1.5.3 皮水分散失量测试
通过经皮水分散失速率测试探头(Tewameter TM300&MPA 580)进行测试,分析皮肤表面水分蒸发的速率(Tewl)。
1.5.4 皮肤角质层含水量测试
通过角质层水分含量测试探头(Corneometer CM825&MPA 580)进行测试。可以分析皮肤表面的含水量(C.U.)。
1.5.5 皮肤舒缓测试
通过皮肤黑色素和血红素测试仪(Mexameter MX18&MPA 580)进行测试,通过测试皮肤与受试物接触后的红斑指数,能够间接反映皮肤的过敏程度,评价护肤品对皮肤炎症的改善情况。
1.5.6 抗敏修复测试
在纳入功效评价名单中,随机选取16名志愿者,前臂内侧皮肤作为受试部位,在每个斑试器内加入质量分数为10%的SDS(十二烷基硫酸钠)溶液,贴于受试者左前臂内侧皮肤,受试5 h,取下斑试器,半小时后观察皮肤变化,并记录;取25 μL舒敏乳加入斑试器中,空白对照为25 μL生理盐水,然后将各斑试器贴敷于受试部位。试验时间为 24 h,在斑试器贴敷24 h后去除,等待30 min 后观察并记录试验结果。48 h时后再观察一次,记录测试结果。
2 结果与分析
2.1 组方提取物功效评价实验结果
2.1.1 抑制透明质酸酶活性实验结果
机体发生过敏性疾病或产生炎症时,肥大细胞中作为化学传递物质的组胺起着重要作用。通过测定组胺的浓度,可评价样品抗过敏效果。研究表明,透明质酸酶活性越高,组胺的释放量就越高,透明质酸酶活性抑制和肥大细胞释放组胺抑制活性之间具有很好的相关性。
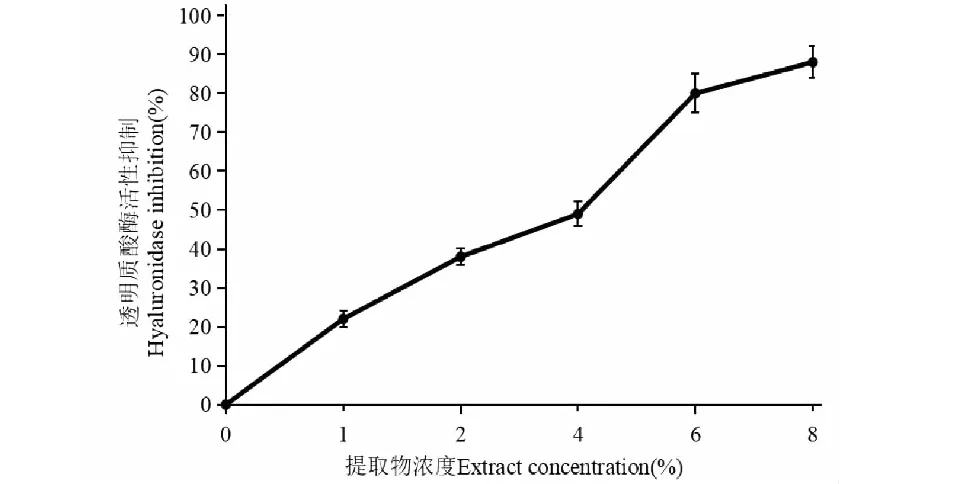
图1 提取物对透明质酸酶活性抑制作用Fig.1 Inhibition effect of extracts on hyaluronidase activity
组方提取物对透明质酸酶活性抑制结果见图1,从图中可以看出,随着组方提取物浓度的增大,透明质酸酶抑制率也在逐渐增大,质量分数为6%的组方提取物对透明质酸酶抑制率达80.06%,当浓度达到8%时,抑制率达到88.92%,并呈一定的量效关系,实验结果表明:组方提取物对透明质酸酶活性有较好的抑制作用。鉴于8%的添加量在实际配方用量太高,综合考虑功效及性价比,故在以下实验中将最高量初步定为6%。
2.1.2 清除自由基实验结果
2.1.2.1 清除DPPH自由基实验结果
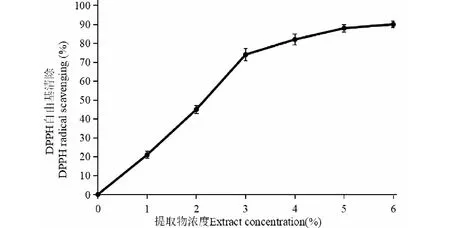
图2 提取物的DPPH自由基清除率Fig.2 DPPH radical scavenging rate of extracts
组方提取物对DPPH自由基清除率结果见图2。从图中可以看出,随着组方提取物浓度的增大,DPPH自由基清除率也在逐渐增大。在组方提取物浓度为3%时,清除率为75.6%,当浓度为6%时,清除率达到90.1%。结果表明:组方提取物对DPPH自由基有较好的清除作用。
2.1.2.2 清除超氧阴离子自由基实验结果
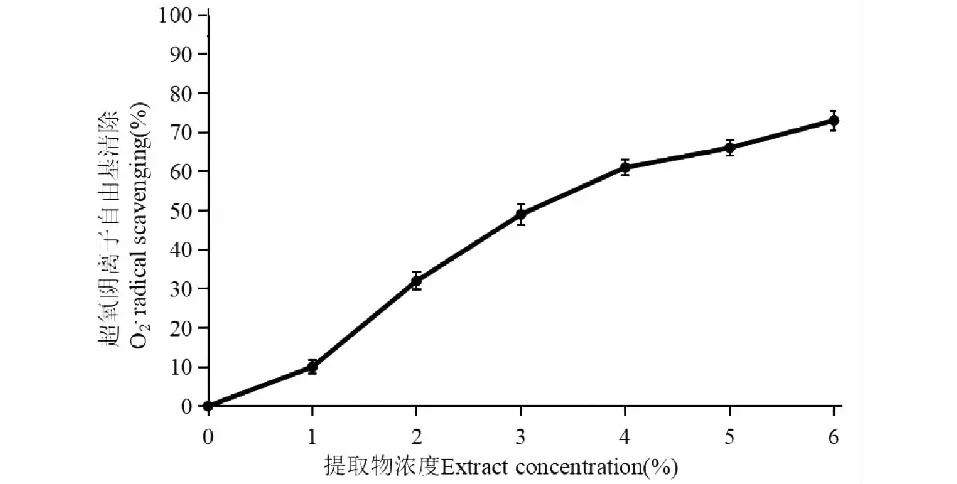
图3 提取物的超氧阴离子自由基清除率 radical scavenging rate of extracts
组方提取物对超氧阴离子自由基清除率结果见图3。可以看出,组方提取物具有一定的清除超氧阴离子自由基的能力,在组方提取物浓度达到6%时,清除率达到72.1%,且对超氧阴离子自由基的清除作用随浓度增加而增强。这表明组方提取物对超氧阴离子自由基同样有较好的清除作用。
2.1.2.3 清除羟基自由基实验结果
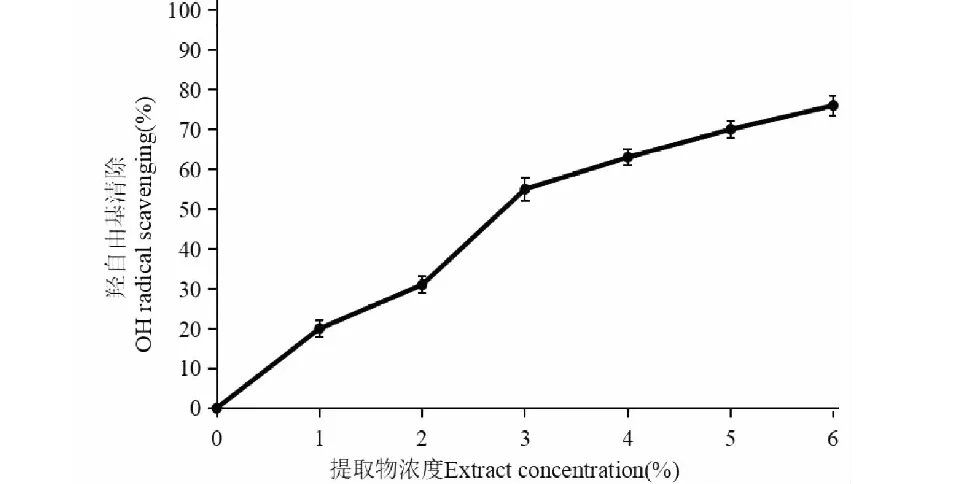
图4 提取物的羟自由基清除率Fig.4 Hydroxyl radical scavenging rate of extracts
利用Fenton反应,检测组方提取物对羟基自由基的清除作用,结果见图4。从图中可以看出,当组方提取物浓度为6%时,清除率达到74.8%,且对羟自由基的清除作用随浓度增加而增强。结果表明:组方提取物对羟自由基也有较好的清除作用。
2.2 抑制KU812细胞中组胺释放结果
在过敏和炎症反应中,肥大细胞脱颗粒后释放的活性介质可以直接参与过敏反应,由于嗜碱性细胞系KU812与肥大细胞具有高度相似性,适合用于建立人类肥大细胞激活和脱颗粒模型。KU812细胞活化导致细胞脱颗粒,化学介质释放如组胺等促炎细胞因子。这些分子作用于血管、平滑肌等,扩大和维持炎症反应,肥大细胞脱颗粒和一些细胞因子合成,完全依赖钙流动,本实验采用PMA和钙离子载体联合刺激KU812细胞,造成细胞内钙升高,诱导肥大细胞脱颗粒。因此,本实验建立PMA和A23187联合诱导KU812细胞组胺释放模型,用来评价提取物对组胺释放的影响。组方提取物抑制KU812细胞中组胺释放量实验结果见表2。

表2 组方提取物对组胺释放的影响Table 2 Effect of group extracts on histamine release
从表中可以看出,经PMA和A23187联合诱导后,模型对照组组胺含量明显升高,与空白对照组相比有极显著性差异(P<0.01)。添加组方提取物后,组胺释放量明显降低,高、中剂量组较模型组有极显著性差异(P<0.01),低剂量组与模型组相比呈现显著性差异(P<0.05)。这表明组方提取物能有效抑制组胺释放量,具有一定的抗敏舒敏功效。
依据体外实验结果,组方提取物在使用浓度为6%时,具有良好的清除透明质酸酶、清除自由基、抑制组胺释放功效。为使舒敏乳能体现出较好的人体功效评价结果,综合性价比,在制备舒敏乳中组方提取物添加量初步定为6%。
2.3 组方舒敏乳功效评价结果
2.3.1 经皮水分散失测试结果
测试期内,不同测试区域经皮水分散失量随时间变化情况如图5。经皮水分散失量越低,表明皮肤屏障功能越好,组方舒敏乳的舒敏修复效果越好。总体结果见图6,样品在第7天、第14天和第21天与本底值相比有极显著差异(P<0.01),这表明受试样品具有显著减少经皮水分散失、修复并增强皮肤屏障的功效。
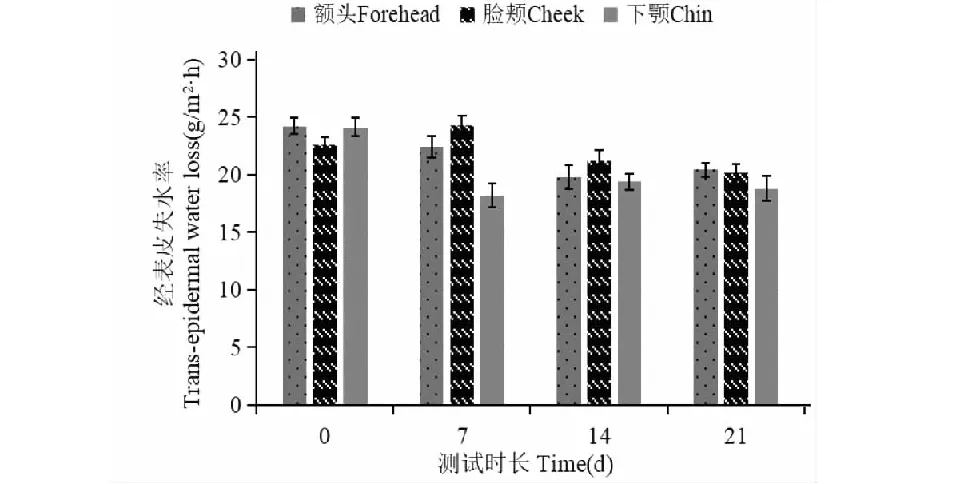
图5 不同区域经皮水分散失Fig.5 Trans-epidermal water loss in different areas
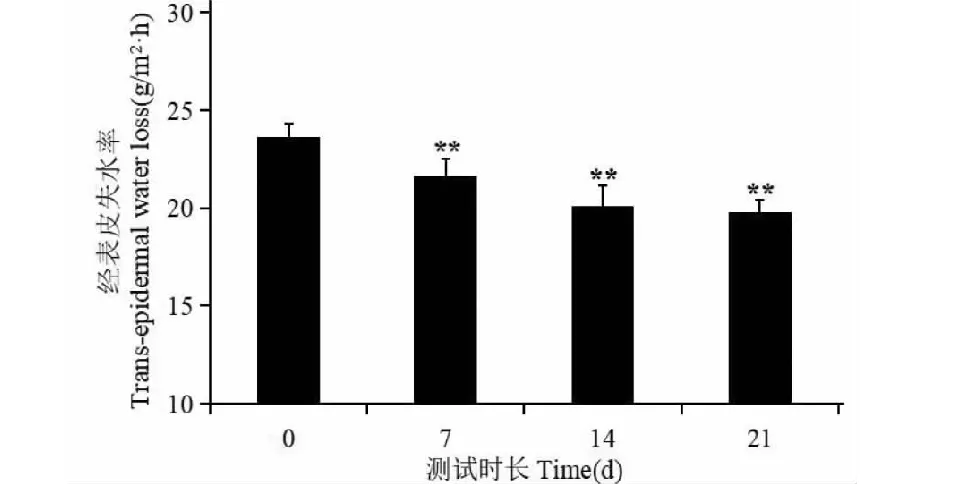
图6 总区域经皮水分散失Fig.6 Trans-epidermal water loss in general areas注:与0天相比,**P<0.01(下同)。Note:Compared with dya 0,**P<0.01 (the same below).
2.3.2 皮肤含水量测试结果
测试期内,不同测试区域水分含量随时间变化情况如图7。测试期内额头、脸颊、下颚的含水量都有所增加,这表明受试样品的舒敏功能良好,且有一定的补水效果。总体实验结果见图8,样品在第7天、第14天和第21天与本底值相比存在显著差异(P<0.01),这表明受试样品具有显著提高皮肤含水量、增强皮肤屏障的功效。
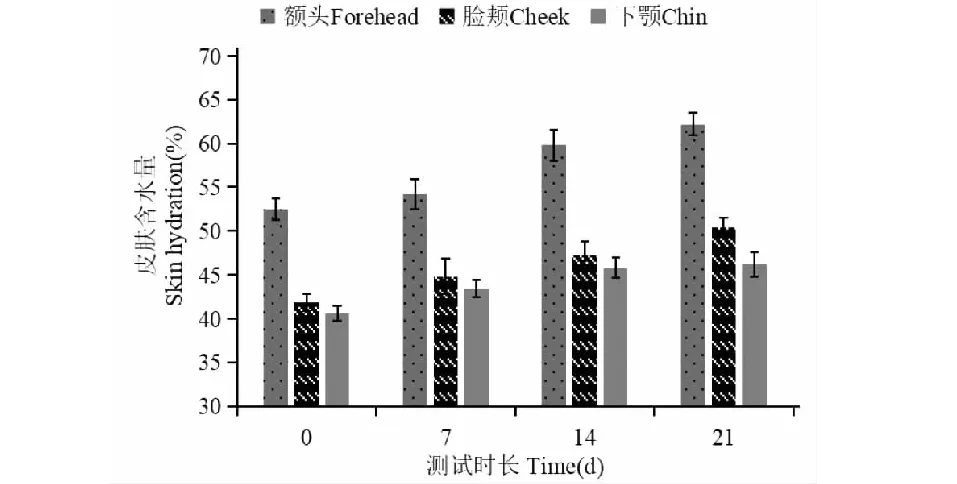
图7 不同区域皮肤含水量Fig.7 Skin hydration in different areas
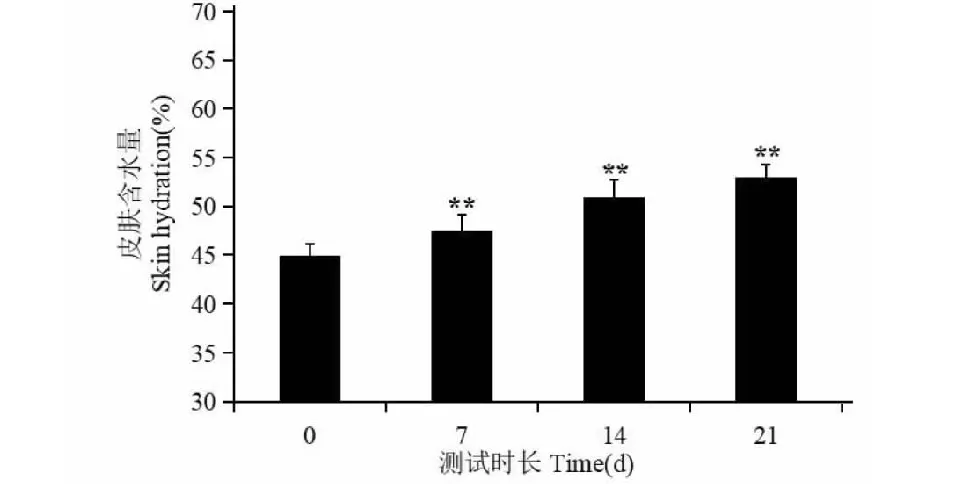
图8 总区域皮肤含水量Fig.8 Skin hydration in general areas
2.3.3 皮肤舒缓测试结果
测试期内,不同测试区域皮肤血红素值随时间变化情况如图9。测试期内额头、脸颊、下颚的皮肤血红素含量都呈下降趋势,表明测试区域皮肤敏感的改善。总体结果见图10,样品在第7天、第14天和第21天相对于本底值存在显著性差异(P<0.01),这表明样品具有显著的舒缓肌肤功效。
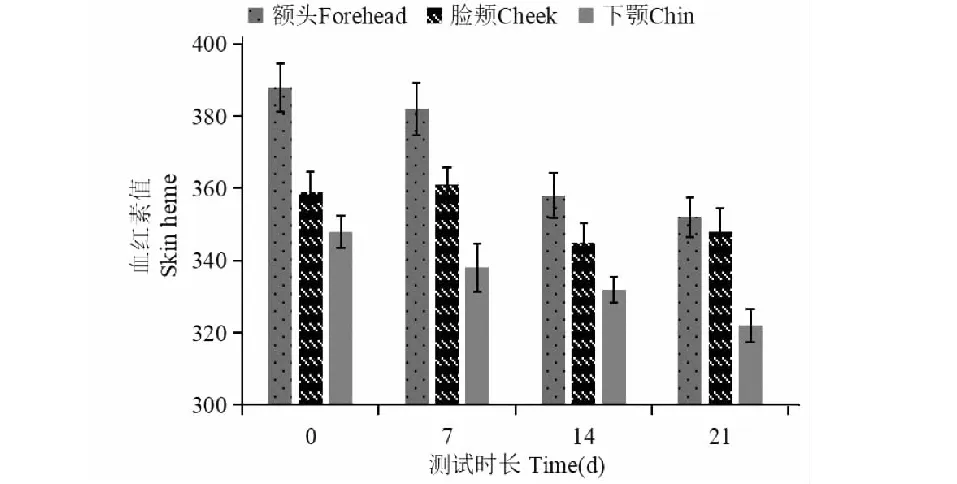
图9 不同区域皮肤血红素Fig.9 Skin heme in different areas
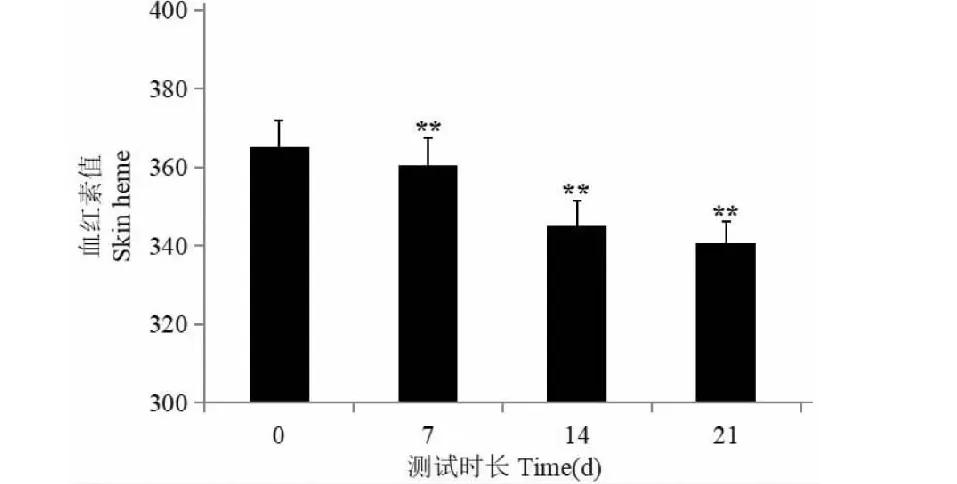
图10 总区域皮肤血红素Fig.10 Skin heme in general areas
2.3.4 抗敏修复实验结果
十二烷基硫酸钠(SDS)是一种阴离子表面活性剂,是一种常用的皮肤刺激剂。用十二烷基硫酸钠斑贴测试的皮肤敏感性评价,已成为研究刺激性接触性皮炎经典模型[14]。本研究的目的是在封闭性的条件下,用10% SDS斑贴作用于皮肤5 h,去除10%SDS斑贴,以建立皮肤过敏模型;再将舒敏乳贴附于同位置皮肤上进行修复,随着时间的推移,观察皮肤的变化情况,对皮肤的反应进行评估。
由表3中的结果可以直观看出:虽存在个体差异性,不同受试者的使用效果有所不同,但整体情况表明该乳液在舒敏方面效果良好。
3 结论
本文在前期研究基础上对香薷、山慈菇、独活、三棱、孩儿茶、远志六味中药提取制备得到组方提取物,利用抑制透明质酸酶活性实验,清除超氧阴离子自由基、羟自由基、DPPH自由基实验,抑制组胺释放实验,探究组方提取物活性和作用机理。结果显示,质量分数为6%的组方提取物对透明质酸酶抑制率达80.06%,对超氧阴离子、羟自由基、DPPH自由基清除率均在70%以上;浓度为200 μg/mL的组方提取物抑制组胺释放率达52%,这表明组方提取物对透明质酸酶、三种自由基及组胺释放均有一定的抑制或清除作用。
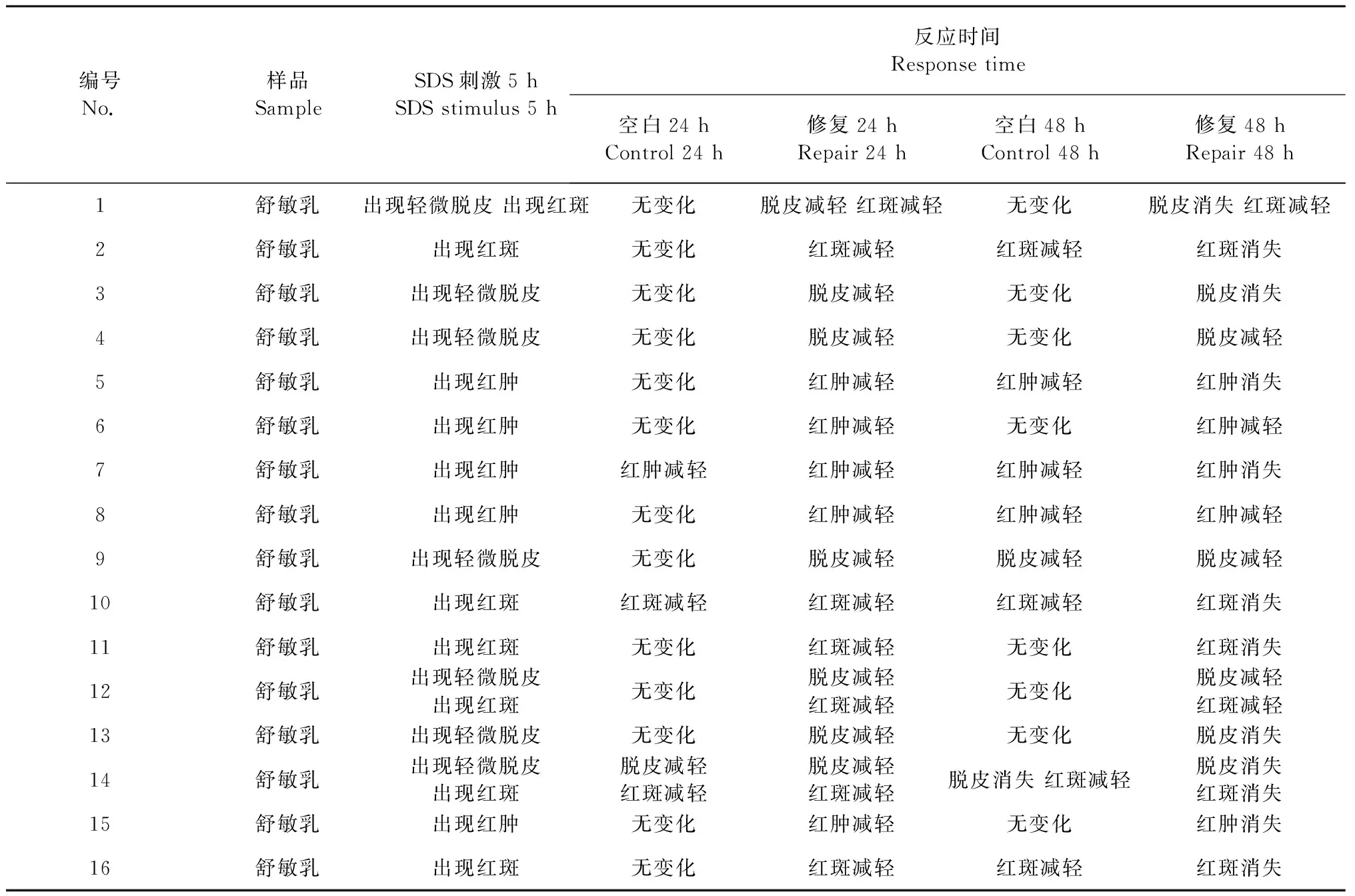
表3 受试者皮肤反应结果Table 3 Results of the skin response in the subjects
将组方提取物添加到乳液配方中,对舒敏乳液进行了相关人体功效评价,以验证其对皮肤过敏症状的舒缓效果。结果表明,添加组方提取物乳液能显著减少皮肤血红素值(P<0.01),减少皮肤水分散失(P<0.01),提高皮肤水分含量(P<0.01),有效改善皮肤过敏症状。
综上所述,该组方提取物能有效抑制引发皮肤过敏反应物质的活性,缓解皮肤过敏症状,快速修复皮肤,增强皮肤屏障功能,是一款较为理想的化妆品用植物源原料。

