基于X射线衍射增强成像的冠脉微循环障碍三维可视化及双参宁心胶囊作用研究*
李 磊 孟红旭 陈 雨 付建华 袁清习 史 跃 马彦雷 刘建勋
(1.中国中医科学院西苑医院基础医学研究所/中药药理北京市重点实验室,北京 100091)(2.中国科学院高能物理研究所,北京 100049)
冠状动脉微循环障碍(coronary microvascular dysfunction,CMD)通常是指发生于直径小于300 μm心脏血管的结构和功能改变,是心脏X综合征、经皮冠状动脉介入治疗(PCI)后无复流等微循环病变的共同发病机制[1]。和心外膜冠脉狭窄一样,CMD导致心肌耗氧的供需失衡,引起临床症状并影响心血管疾病的诊疗和预后。随着现代影像学的迅速发展,CMD的发生和防治得到越来越多的关注[2]。
X射线技术是广泛应用于生物医学领域的一种重要检测分析手段,传统X射线成像技术是基于不同材料或组织对X射线吸收不同而获得成像的衬度,然而生物组织样品产生的吸收衬度有限,直径200 μm以下的微血管不能通过传统的冠脉造影检查评估[3]。传统的血管可视化研究手段如组织病理学切片、血管荧光染色等,对微血管空间结构的展示尚停留在二维平面层次,无法精确再现血管网络的空间分布[4]。目前,在CMD的诊断和疗效评价方面缺乏对微小动脉的可视化技术,尤其缺乏适合小动物冠脉微血管的可视化研究方法。
衍射增强成像(diffraction enhanced imaging,DEI)也称为基于晶体的相位衬度成像,是利用硅晶体极高的角度选择特性探测样品引起的X 射线角度变化来获得样品衬度图像[5]。近年来,X射线衍射增强成像方法逐渐应用到生物医药领域[6-7]。与传统的X射线吸收成像技术相比,由于软组织对X射线的相位衬度比吸收衬度大100~1 000倍,因此DEI在生物软组织方面具有显著优势,为微血管的观测和评估提供了有效手段。血管铸型作为形态学研究的一项经典技术,是管道铸型的重要种类之一,可以通过重建血管树分析和评价血管三维形态,为研究某器官或组织的血管分布做出了重要贡献[8-9]。近年来,Chen等[10]将该技术应用于心衰大鼠心脏微血管病变研究,然而在CMD方面该技术应用鲜有报道。
双参宁心胶囊是本院研发的治疗气虚血瘀证冠心病的组分中药,由人参、丹参和延胡索三药味有效部位按比例组成,具有益气活血、化瘀止痛之功效,用于冠心病、CMD及心绞痛气虚血瘀证。前期研究显示,双参宁心胶囊能明显改善心肌缺血(再灌注)损伤,增加缺血心脏的冠脉血流量,改善冠脉微循环;对血清乳酸脱氢酶(LDH)的增高、肌酸激酶(CK)活性升高及血浆内皮素(ET)的活性有明显抑制作用;通过保存缺血心肌三磷酸腺苷(ATP),对心肌细胞凋亡、自噬、线粒体自噬等均具有调控作用[11-13]。本研究主要采用血管铸型及X射线衍射增强成像技术探索CMD时冠脉微血管三维变化及双参宁心胶囊的作用,为下一步开展机制研究奠定基础。
1 材料和方法
1.1 材料
1.1.1实验动物:SPF级健康雄性SD大鼠18只,体质量 300~320 g,购自斯贝福(北京)生物技术有限公司,实验动物生产许可证号:SCXK(京)2016-0002。动物实验操作及饲养均在中国中医科学院西苑医院实验动物中心进行,实验动物使用许可证号:SYXK(京)2015-0011。实验动物及实验步骤符合国家实验动物管理条例。该研究经中国中医科学院西苑医院动管理委员会批准实验,实验动物处置均符合国家科委《实验动物管理条例》,并遵循:“3R”原则给予实验动物人道的关怀,审批号: 2020XLC007-2。
1.1.2药物与试剂:双参宁心胶囊(中国中医科学院西苑医院基础医学研究所药学室),氢氧化钾和戊巴比妥钠(Sigma);自凝牙托粉和自凝牙托粉水(安阳市鹰牌齿科有限公司);邻苯二甲酸二丁酯(无锡市亚泰联合化工有限公司);大红色油画颜料(广州市美帮祈福文仪有限公司);40~120 μm栓塞微球(Merit Medical)。
1.1.3主要仪器:DW-3000S型双通道小动物呼吸机(安徽正华生物仪器设备有限公司);α77 Ⅱ数码单电相机(SONY)。4W1A成像实验站(北京同步辐射装置)。
1.2 方法
1.2.1实验分组与给药:动物适应3 d后,随机分为三组,每组6只。具体分组如下:①假手术组(Sham):不注射栓塞微球,给予等体积生理盐水;②模型组(Model):注射栓塞微球,给予等体积生理盐水;③双参宁心胶囊组(SSNX):给予双参宁心胶囊,剂量为1 mL/100 g。各组动物3只用于血管铸型研究,另外3只用于X线衍射(X-ray diffraction,XRD)成像研究。双参宁心胶囊组动物,连续给予双参宁心胶囊7 d,剂量为1 mL/100 g灌胃给药,假手术组和模型组给予等体积生理盐水,末次给药后2 h进行模型制备,造模后24 h处死取材。
1.2.2CMD模型建立:参考Sun等[14]造模方法,大鼠按体质量给予戊巴比妥钠腹腔注射麻醉,胸部常规备皮,取仰卧位固定于手术板上,把头颈部拉直固定,行气管插管术,将气管插管与小动物呼吸机连接。大鼠于左前外侧沿胸骨左侧缘纵向切开皮肤,钝性分离肌层,开胸暴露第4肋中部并纵向剪断,以垂直肋骨方向放置大鼠开胸器,剪开心包膜暴露心脏,分离主动脉弓,并在其下穿一棉线,令大鼠稳定10 min后,将棉线两端提起并用血管夹夹闭主动脉,迅速以注射器从心尖部直接向左心室注射0.2 mL栓塞微球(微球直径42~120 μm,约含1 000个微球),注射前回抽血以确保针尖在心腔中,夹闭20 s后,松开血管夹,待呼吸心跳稳定后,彻底止血、逐层缝合肌肉和皮肤。拔除气管插管,普通饲养。假手术组手术过程采用同样的操作,区别仅在于大鼠注射的为 0.2 mL生理盐水。
1.2.3动物冠脉血管铸型及图像采集:根据李忠华等[15]方法及预实验,确定血管铸型剂配方如下:自凝牙托粉25 g、自凝牙托水25 mL、邻苯二甲酸二丁酯12 mL及大红油画颜料2 mL。使用时先将自凝牙托水、邻苯二酸二丁酯及油画颜料混匀搅拌充分,注意用玻璃棒顺时针搅拌使其充分混匀,搅拌过程中避免气泡产生,最后加入自凝牙托水,再次搅拌均匀后立即用20 mL的塑料注射器灌注,不间断、缓慢加压注入,15 min内铸型剂有较好的流动性。
大鼠麻醉后,经腹主动脉插管注入1%肝素生理盐水处死动物。剪开动物下腔静脉放血,直至从静脉端流出清亮的液体为止,再灌入铸型剂,直至铸型剂从下腔静脉流出表示灌注成功。结扎腹主动脉和下腔静脉,静置标本于室温下4 h。待铸型剂完全聚合后,取心脏放置于含有2%吐温80的4 mol/L氢氧化钾碱溶液中腐蚀组织,3 mL/g心肌组织。室温消化24 h,其间适当摇晃以便腐蚀掉的组织脱落,冲洗干净后移入纯水中保存。血管铸型图像采集使用索尼α77 Ⅱ数码单电相机,配合索尼SAL 50 mm f/2.8 Macro 镜头拍摄。使用Image Pro Plus 6.0软件完成定标,并标注相关血管直径。拍照后将冠脉铸型从纯水中取出,修剪去除主动脉弓处等多余部分,室内放置待铸型表面无水分后称质量[16]。
1.2.4X射线衍射增强用样本制备:动物麻醉后分离下腔静脉,并插入留置针。颈总动脉插管,连接三通,50 mL生理盐水从下腔静脉缓慢注入,同时放开颈总动脉插管放血,待颈总动脉血流颜色变为透明时,更换为4%多聚甲醛从下腔静脉插管处缓慢注入,直至大鼠四肢僵硬时停止灌注。假手术组和模型组各取1只动物,在横切面乳头肌水平取3~4 mm心脏切片,其他动物切除左右心房后,保留完整心室组织固定。将心脏组织放入4%多聚甲醛固定液中保存[17]。
1.2.5XRD增强图像采集与分析:衍射成像研究在北京同步辐射装置(Beijing synchrotron radiation facility, BSRF)4W1A成像实验站开展。EDI方法的光路示意见图1A,单色器(晶体)主要作用是从白光X射线中通过调整入射角度获得特定波长的单色X射线,单色X射线通过样品内部密度不同或结构不同区域时会发生不同大小的折射角折射,放置在样品之后的分析晶体通过调节接受角度,选择某一折射角度出射的X射线,放大这种密度不同或结构不同造成的光强度变化,最终在检测器上得到衬度增强图像。高灵敏度衍射成像系统主要包括同步辐射光源、单色器、旋转样品台、分析晶体和探测器组成,见图1B。4W1A 成像实验站建在Wiggler白光束线上,光束线出口距发光点43 m,光源尺寸水平方向为2.2 mm,垂直方向为0.8 mm,X射线能量范围为3~22 KeV,物像距为0.3 m。为获得更好的成像效果,于拍摄前1 h将心脏样品从多聚甲醛中去除,用滤纸拭去表面并置于空气中风干。

图1 XRD光束线及实验装置(北京同步辐射)
实验参数设置: 选择Si(400)晶体进行分析。单色光能量为20 keV,电子束流强度Ie为60~100 mA,曝光时间在峰位为70 ms左右,半高位均为280 ms,探测器使用X射线CCD成像系统探测器:Hamamatsu C12849-101U;探测器像素尺寸:6.5×6.5 μm。放置样品后获取摇摆曲线,然后分别在摇摆曲线的峰位和反射率为50%左右的半高宽位进行成像。CT 扫描参数设置: 光子能量15 keV,曝光时间12 ms,转台转速0.32°/s,CT数据采集的投影范围为180°,角度间隔0.5°。图像采集及三维重建结束后,利用滤波反投影算法进行二维断层重建,并将二维切片图像利用Avizo9.0软件进行三维可视化处理。采用Zanatta等[18]“无血管评分法”对冠脉微血管病变程度进行半定量评分,具体评分如下:0分,未见明显微血管异常;1分,冠脉微血管异常或减少率≤33%;2分,冠脉微血管异常或减少率33%~66%;冠脉微血管异常或减少率>66%。
2 结果
2.1 大鼠冠脉血管铸型结果
本研究所使用的铸型剂可以在室温下2 d内方便快捷的制作出大鼠冠脉血管主干和微血管标本。铸型标本冠脉血管管道较完整、饱满,血管树的空间分布清晰。该铸型剂配方可以一次性灌注完成,显示血管最小直径可达40 μm(见图2),更小的血管在该铸型条件下显示比较困难,更细的血管在心肌消化时多数随心肌脱落。
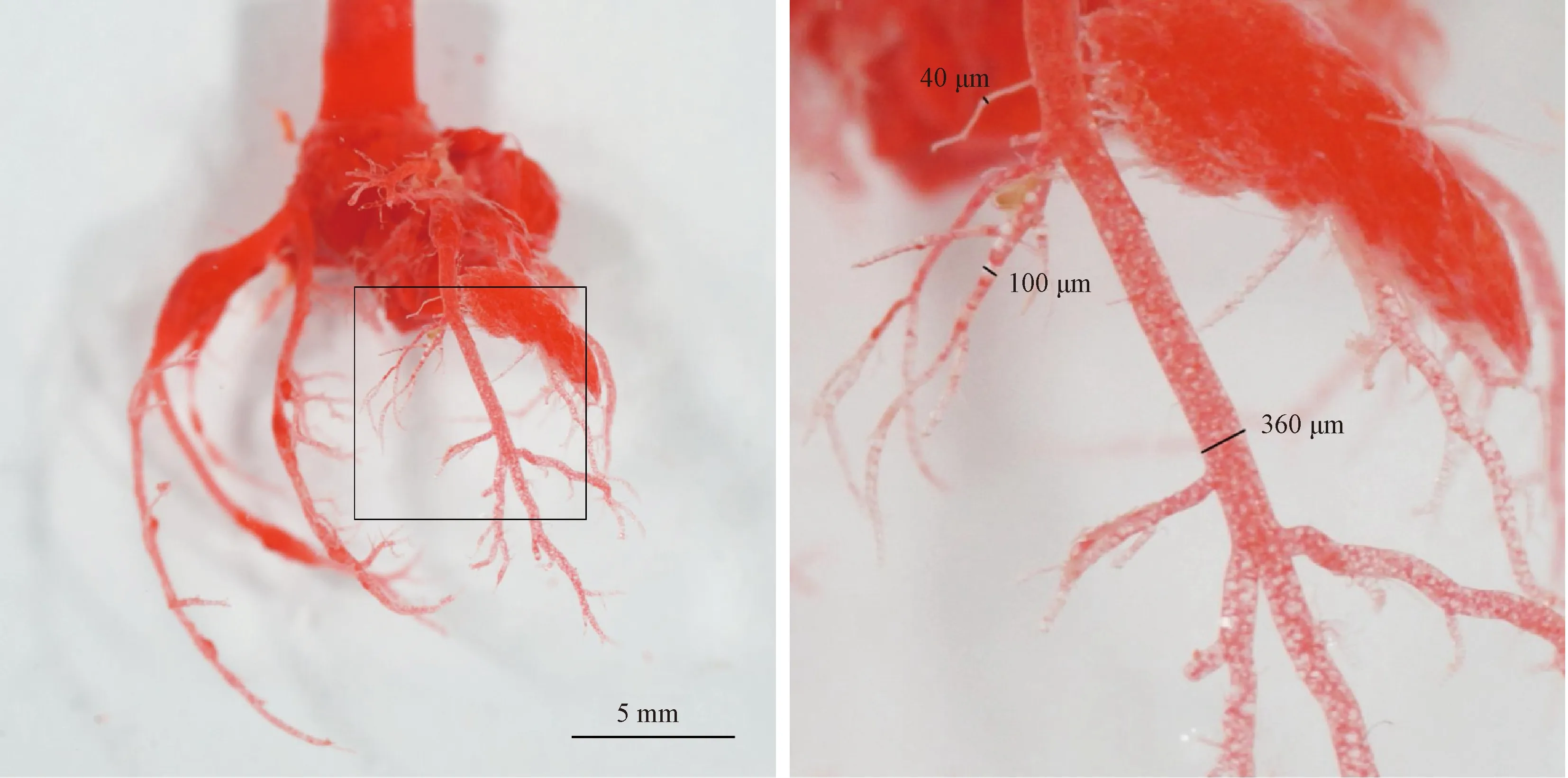
图2 大鼠冠脉血管铸型
2.2 CMD大鼠血管铸型改变及双参宁心胶囊干预作用
经心室内注射栓塞微球建立的CMD大鼠冠脉铸型标本可见冠脉血管稀疏,微血管密度明显较假手术动物减少,冠脉血管铸型质量较假手术组明显降低(P<0.01)。双参宁心胶囊预防后给药7 d可以明显改善冠脉血管分布异常,增加微血管密度(见图3)。

图3 各组动物冠脉血管铸型比较
2.3 高精度衍射成像图采集结果
XRD成像中,为获得样品的吸收、折射、散射等信息,需要样品在摇摆曲线不同位置获得不同衬度的图像,在摇摆曲线峰值位置时采集的图像成为DEI峰位图。所有样本均获得良好的衍射增强图像峰位图,图像衬度较好,立体感较强,呈浮雕样。图像的空间分辨率及衬度分辨率明显要高于常规X线检测。心脏横向切片后,采集的DEI峰位投影图中观察不到明显的血管结构(见图4)。心室纵向放置采集的图像可以观察到类似血管走形的投影,然而各组间未观察到明显差异(见图5)。上述结果提示直接获得的DEI峰位图不能直接用于观察冠脉微血管分布情况。

图4 大鼠心室横切面DEI峰位投影
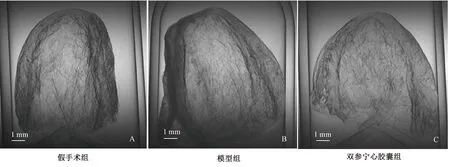
图5 大鼠心室纵向DEI峰位投影
2.4 CT图像及血管三维重建
利用Avizo 9.0软件,对DEI图进行三维重建,选取适当灰度值,可以观察到冠脉微血管走形及空间形态结构。心室横切面取材直接CT三维重建,显示冠脉微血管直径最小15~25 μm,但只能观察到心室壁内部一部分血管走形,对深部穿支血管的形态空间分布显示模糊,同时受到心肌腱索图像干扰较多(见图6)。由于受到图像干扰,该观察条件下,假手术组和模型组大鼠冠脉微血管并未见明显差异。
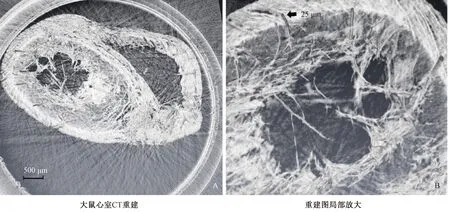
图6 大鼠心室DEI成像CT三维重建
整个心室通过旋转CT扫描拍摄得到361张DEI峰位图,经过滤波反投影法转换可以得到约1 000帧横断面图(见图7A)。对整个心室所有断层进行重建,图像干扰增多,很难发现有意义的血管改变(见图7B)。经过反复对比,发现心脏冠脉回旋支分布节段,200层(第800~1 000层)断层片重建获得的图像比较有利于观察冠脉微血管(见图7C)。通过选择适当的灰度,可以将冠脉微血管较好显示,血管走形遵循从大到小的一般规律,分布情况与解剖学冠脉血管走形分布大体一致,可以见到最小直径为10 μm的冠脉微血管(接近毛细血管直径)。相同观察条件对CMD大鼠冠脉微血管进行观察,假手术组动物冠脉微血管分布主干粗大且分支完整清晰明显(见图7D),而冠脉微栓塞动物的冠脉微血管主干变细,分支数明显减少,冠脉微血管评分降低(P<0.01)(见图7E)。给予剂量为双参宁心胶囊90 mg/kg干预的大鼠冠脉微血管较模型组动物明显血管密度增加,增加冠脉微血管评分(P<0.05),见图7F及表1。

表1 大鼠冠脉微血管铸型质量及XRD成像血管评分

图7 冠脉微血管三维重建
3 讨论
传统的X线冠脉造影技术不能评价冠脉微血管,病理组织学切片技术虽然可以观察到微血管的改变但不能反映血管树的三维立体分布。冠脉微血管铸型技术具有构建性强、美观且色泽鲜艳,能真实的反映出标本的血管网形态、分布及侧支的吻合情况。自2012年,使用自凝牙托材料进行心血管铸型研究已经广泛应用在解剖教学和大动物实验研究中,其制作的标本具有支撑力强、收缩率小、柔韧性好、铸型饱满、价格低廉、化学性能和物理机械性能都比较稳定的特点[17]。本研究结果显示,使用自凝牙托材料可以快捷的制作大鼠冠脉血管铸型标本,铸型标本可以反映出CMD大鼠血管异常,双参宁心胶囊可以明显改善CMD大鼠血管铸型所示的冠脉微血管密度降低。
随着DEI技术的逐步完善,在生物学、医学、材料学等领域表现出广泛的应用前景。XRD成像的中摇摆曲线指出射光强随分析晶体角度摇摆而变化的曲线,分析晶体具有极高的角度选择性,只有那些严格满足布拉格衍射条件的部分X射线才能通过分析晶体到达探测器进行成像。将分析晶体调节到摇摆曲线不同位置,通过转换样品和成像装置之间不同方位,可以获得衍射增强影像[18]。本研究使用北京同步辐射装置开展大鼠冠脉微循环血管三维重建探索。由于心脏相对较厚,前期研究报道在该装置上观察小鼠活体成像十分模糊,较肝脏和肾脏影像清晰度差,除了显示心脏大血管结构外,其余结构显示欠佳[19]。因此本研究采用大鼠离体心脏固定后采集图像进行分析重建。高分辨率和高质量的原始图像是进行精确血管三维重建的重要基础,样品的处理需经过严格统一的灌注、固定、脱水等操作。本研究分别采用横断切片和整个心脏两种方式进行了图像采集的探索,结果显示心脏横切片虽然可以得到横切面的高清晰和高分辨率DEI峰位投影图,同时经过CT重建后可以观察到部分冠脉微血管,然而在空间分辨程度上不够清晰。对心脏整体进行DEI峰位投影图采集可以获得立体、浮雕感的图像,可以直接观察到细微冠脉微血管走形,但并不能区分出假手术大鼠与模型大鼠的区别。若将所有获得的近1 000帧图像进行CT重建,得到的图像由于伪影和图像重叠不能清楚观察到冠脉微血管。因此,本研究通过减少重建的帧数,并调整灰度值,在冠脉乳头肌水平选择200帧进行重建,可以获得冠脉回旋支较为清晰的影像,而且冠脉微球栓塞导致的CMD大鼠冠脉微血管分布出现异常,冠脉主干变细,同时冠脉微血管明显减少,给予双参宁心胶囊预防性给药7 d后,冠脉微循环明显改善,冠脉分支较模型组明显增多。
综上所述,血管铸型和XRD增强成像均能在一定程度上构建出血管网的三维可视化模型。XRD增强成像技术在显示冠脉微血管细节方面具有极大优势,最细可以显示到直径为10 μm级别血管。血管铸型和XRD增强成像均在一定程度上反映大鼠CMD时冠脉微血管空间分布改变,双参宁心胶囊干预对动物模型的冠脉微血管亦可以见到明显改善。XRD增强成像方法的样本制作简便,获得图像可后期转化分析,对CMD的实验研究具有一定参考价值。

