雷公藤多苷致大鼠精子畸形初步研究*
陈小均 贾玉森 张志杰 张延江 张伟涛
(北京中医药大学东方医院,北京 100078)
男性不育为男科临床常见疾病,畸形精子症为男性不育的常见类型。精子形态是影响受孕的重要参数,并对精子活力产生影响,与精子DNA的完整性有关,还可以影响到精卵结合[1-2]。畸形精子症的病因复杂,影响因素较多,发病机理不清[3],亟待研究解释其发病机制。在精子形态方面,实验动物和人类差别较大。雷公藤(Tripterygiumwilfordii)多苷模型为男性不育症常用模型[4],大鼠为研究男性不育症常用实验动物,但针对大鼠的精子形态分析的报道较少。因此本研究对实验中的雷公藤多苷模型大鼠精子形态变化进行观察,描述该模型大鼠精子异常形态,以期对畸形精子症的研究提供参考。
1 材料和方法
1.1 材料
SPF级雄性SD大鼠30只,体质量200~250 g(6周龄),购自北京维通利华实验动物技术有限公司,实验动物生产许可证号: SCXK(京)2016-0011。雷公藤多苷片,规格10 mg,购自远大医药黄石飞云制药有限公司。精子形态染色Diff-Quick试剂,购自深圳华康生物医学工程有限公司。实验已通过北京中医药大学东方医院福利伦理委员会审查,编号:201813。
1.2 实验方法
SD大鼠适应性饲喂1周后,随机分为三组,4周组、8周组和对照组,每组10只。对照组正常饲喂, 予生理盐水剂量为10 mL/kg灌胃,1次/d;4周组和8周组剂量为30 mg/kg,新鲜配制雷公藤多苷混悬液灌胃,1次/d,分别持续4周及8周。大鼠自由进食、饮水,隔日更换笼中的木屑垫料以保持清洁。环境温度:20~25 ℃,相对湿度:40%~70%,昼夜光照:12 h/12 h。实验自开始之日起,大鼠每周称体质量1 次,观察记录体形、毛色、步态、觅食、活动情况、有无死亡及其可能的原因。在给药4周及8周后,分别取4周组和8周组共10只大鼠进行形态学检测。
1.3 大鼠精子形态分析
大鼠末次给药24 h后处死,迅速剪开腹腔,仔细完整地分离睾丸、附睾及输精管,用眼科剪沿附睾纵轴剪一刀使其分为大致均匀的两半,然后沿横轴剪两刀使附睾分为大致均匀的6段,将剪碎的附睾组织移入预置常温孵育缓冲液1 mL 的试管中,然后用1 mL 孵育缓冲液冲洗培养皿,冲洗液移入装附睾的试管中。分离输精管,于输精管与附睾尾结合部、输精管与前列腺结合部剪切离断输精管。用胰岛素注射针抽取孵育缓冲液1 mL,沿输精管一侧断端将针头插入输精管管腔内,轻推注射器,可见另一侧断端流出1~2 滴乳白或灰白色液体,内含大量精子,将所得液体滴入装附睾的试管中并置于37 ℃恒温孵育箱中孵育30 min,进行精子形态学分析。
根据试剂盒说明书进行快速染色法(Diff-Quik),检测精子形态。步骤简述如下:在玻片上标记样本信息,取10 μL精液加在玻片边缘,推片,空气干燥;放入固定液中15 s,沥干;染色(快速染色液1、10 s和快速染色液2、5 s),流水冲洗10~15次,空气干燥玻片;用10×100 亮视野油镜检查染色后的涂片,进行精子形态分析。
1.4 统计方法
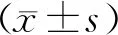
2 结果
2.1 大鼠正常精子形态
在光镜下,大鼠的精子形态与人的精子不同,大鼠精子头部弯曲、呈镰刀型、表面光滑、顶体和顶体后区分界欠清晰、头颈部连接于腹侧、颈部细长、中段粗细一致、主段较长、逐渐变细及无成角弯折(图1)。

图1 大鼠正常形态精子(×100)
2.2 大鼠异常形态描述
无钩、头部折叠、小头、无尾、颈部断裂、无头、尾部卷曲及断尾,其中无头及无尾畸形为常见类型(图2)。
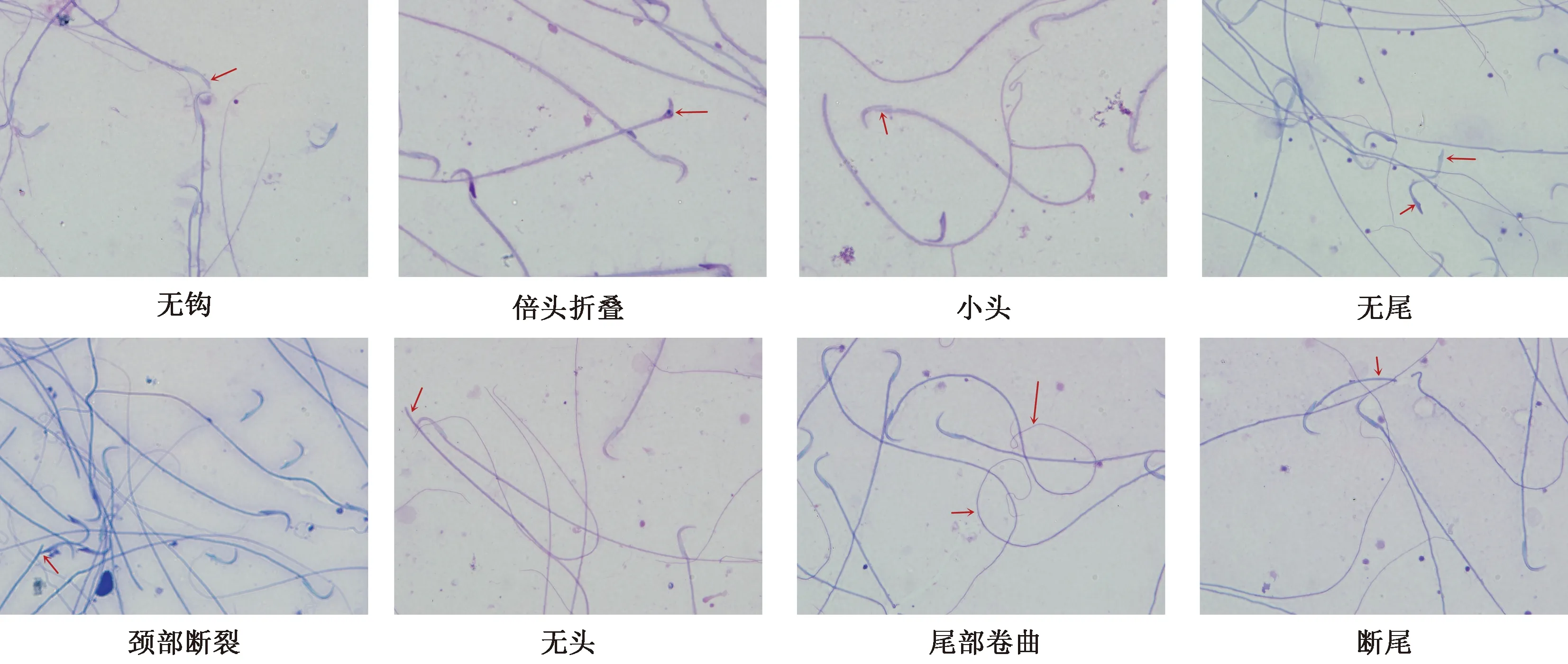
图2 大鼠异常精子形态(×100)
2.3 三组大鼠精子形态异常率比较
三组大鼠精子形态异常率比较结果,F=83.00,P=0.00<0.01,差异极显著。进一步多重比较发现,空白组大鼠精子异常率很低,大多数精子形态均正常;雷公藤多苷灌胃4周后,大鼠精子畸形率升高,与空白组比较,P=0.00<0.01,差异极显著;8周后畸形率进一步升高,与空白组及4周组比较,P=0.00<0.001,差异极显著。

表1 大鼠精子形态异常率比较
3 讨论
在对不育症实验研究的文献中,少有对畸形精子的专门实验研究报告[5],多见于对少弱精、生精障碍[6]、男性不育的病因学[7]等的实验研究。其中最常用的模型是雷公藤多苷模型和奥硝唑模型。药理学研究发现,奥硝唑对附睾中精子的作用,主要是干扰精子成熟和运动所必需的糖酵解酶,使精子获取能量过程受阻,从而降低精子的活率与活力[8-9],而雷公藤多苷既作用于大鼠睾丸曲细精管中各级生精细胞, 又作用于附睾中的精子[10],其作用于精子发生的整个过程,影响生精功能和精子发育形态,长期给药损伤可加重且长时间无法恢复[11]。故而在对精子形态的实验研究中采用雷公藤多苷造模更为合适。
雷公藤多苷的生殖毒理研究表明,其生殖毒性呈时间和剂量依赖性,10~30 mg均可导致生殖细胞损伤,但低剂量需要的时间相对较长。对精子形态的影响方面,文献报道不一,25 mg和30 mg均有报道[5]。本研究采用30 mg的偏大剂量造模,观察精子形态变化。在大鼠精子染色方面,文献中有选择HE染色法[12-13]、伊红染色法[14-16]、伊红/苯胺黑染色法[17-18]、瑞-吉氏染色法[19]等,其中使用最多的是伊红染色及伊红/苯胺黑染色。人精子形态染色常用的染色方法有改良巴氏染色法、瑞吉氏染色法、Shorr 染色法和Diff-Quik 染色法。石亮等[20]对上述4种染色法比较发现,上述4种染色方法检测形态正常精子率、头部畸形精子率和顶体完整精子率,差异均不显著(P>0.05)。但根据盛慧强等[21]报道,Diff-Quik 染色法可将精子顶体区染为淡紫色、核区为紫蓝色和中段及主段为淡红色,为一种简单且快速的染色方法,与经典的改良巴氏染色法在精子形态评估中无显著差异。因此,本研究采用Diff-Quik 染色法对大鼠精子染色,并发现大鼠的精子形态与人的精子差别较大,总结如下:(1)大鼠精子形态正常率很高,异常率低,而人精子形态异常率高,正常率低;(2)大鼠精子头部形状不同于人精子的椭圆形,为弯曲状、呈镰刀型,表面光滑,顶体和顶体后区分界不是很清,大鼠精子头部明显小于人精子头部;(3)在光镜下,大鼠精子颈部为非对称性插入于头部,头颈部连接于腹侧,颈部细长,中段粗细一致;(4)大鼠精子主段明显比人精子长,无成角弯折。上述大鼠精子形态描述和杨燕平等[22]在电镜下观察到的大鼠精子形态类似。研究发现Diff-Quik 染色大鼠精子,图片背景相对干净,大鼠精子密度较高,直接涂片染色,易出现精子重叠,影响观察,建议稀释后染色;大鼠精子头顶体和顶体后区分界不清,可能为大鼠精子头部较小有关;大鼠精子较长,光镜下阅片,每个视野中完整的精子数偏少,影响读片速度;应用此染色方法,染色后保存时间较短,需要尽快完成读片,随着时间延长,存在褪色,影响读片。
在大鼠精子异常形态类型方面,郭健敏等[11]研究雷公藤多苷对雄性SD大鼠生殖系统损伤,发现精子畸形主要有断头、圆头、折叠和头部不定型;柳建明等[23]用奥硝唑灌胃大鼠造模弱精子症大鼠,发现精子表现为无钩、胖头、断头、双尾、尾部折叠及断尾等畸形;熊芬等[24]报道奥硝唑高剂量组还可见大片头部缺失或顶体不完整的精子;孙华明等[25]观察低功率微波对大鼠精子的影响,发现大鼠精子表现为不定形、胖头、香蕉头、无勾、双头(多头)、双尾(多尾)和尾折叠的形态异常;Khalil等[26]证明,暴露于“四溴二苯醚”的大鼠可出现无尾、无头、尾部弯曲、短尾、主段变细、细胞质残留等异常形态。本研究发现的雷公藤多苷造模大鼠精子形态异常类型和上述文献报道类似,与人的精子异常类型相似,但未观察到双头、双尾、细胞质残留等异常类型,而这些文献中对大鼠精子形态异常类型多为文字描述,罕见有详细图示。
大鼠精子异常率方面,吴国琳等[27]用雷公藤多苷剂量为25 mg/kg灌胃,30 d后比较大鼠精子形态异常率结果如下:正常组(6.73±2.28)%,模型组(25.63±7.35)%。张才田等[28]用雷公藤多苷剂量为16 mg/kg灌胃,发现2周后精子畸形率上升(1.2±1) vs (11±1),P<0.05;4周和6周后畸形率升高更显著,P<0.001,证实雷公藤多苷对大鼠精子具有抑制作用。本研究采用30 mg/kg雷公藤多苷灌胃,4周后精子形态异常率明显升高,8周后可见到更为明显的异常率,和徐颖等[29]报道的雷公藤多苷的生殖毒性表现为时间依赖性一致。
综上,畸形精子症为不育症的常见类型,但目前无畸形精子症的实验动物模型报道,并且罕有描述大鼠精子异常形态类型的图片,不利于畸形精子症的研究。本研究采用雷公藤多苷30 mg/kg灌胃大鼠,研究其对大鼠精子形态的影响,发现其可使大鼠精子出现头部、中段及主段的各种畸形,这和人的精子异常类型相似,且精子畸形率较空白组明显增加。虽采用奥硝唑灌胃造模大鼠后,发现亦能造成大鼠精子畸形率增高[23],但采用奥硝唑灌胃后,精子畸形率无明显变化[30],而雷公藤多苷和奥硝唑诱导的大鼠动物模型的病理机制存在着显著差异[31]。在大鼠精子形态染色方面,研究发现Diff-Quik 染色法对大鼠精子染色效果良好,可以作为一种实用的大鼠精子染色方法。大鼠精子和人精子差别较大,本研究对大鼠精子的异常类型进行了描述及图片展示,对大鼠精子和人精子的区别进行了详细描述,为相关研究提供参照及依据。因此,雷公藤多苷灌胃大鼠,可成功建立畸形精子症大鼠模型,且精子畸形类型和人的精子畸形类似。本研究所建立的大鼠模型较为稳定,并且可选择时间及剂量更为灵活,可以作为畸形精子症动物模型。
仅采用雷公藤多苷单一剂量,并且只在光学显微镜下观察,未进行多剂量研究及电镜下大鼠精子形态分析,存在不足。在接下来的研究中,将进行雷公藤多苷多剂量研究,找到最适的雷公藤多苷畸形精子症大鼠模型的剂量及成模时间,以便于相关实验研究。

