家兔PICC静脉化疗动物模型血管病理变化研究*
黄利全 陈桂园 胡庆华 胡 波 方露燕
(1. 金华职业技术学院,金华 321017)(2. 金华市中医院,金华 321017)(3. 金华市人民医院,金华 3210002)
抗肿瘤药物的化学治疗简称化疗,是肿瘤患者的三大治疗手段之一。通过外周静脉注射化疗药物时,常致静脉炎的发生,甚至出现局部皮肤溃疡、皮下组织坏死及功能障碍等严重并发症。张鹍等[1]研究认为,经外周置入中心静脉导管(peripherally inserted central catheter,PICC)指由外周静脉穿刺插管,并使其头端位于上腔静脉中下段的中心静脉导管置入术,上腔静脉处较大的血流量可迅速稀释药物,降低化疗药物对血管壁的刺激,减少化疗药物造成的局部组织红肿、疼痛或坏死。然而,PICC置管患者容易发生静脉血栓、静脉炎、感染等不良反应,影响治疗效果,甚至对患者的生命安全构成严重威胁[2-3]。由于肿瘤患者存在个体差异、不同的病因、不统一的防护方案、无法截取留置血管进行光镜观察等原因,限制了对化疗性静脉损伤的研究。因此,本研究选择酒石酸长春瑞滨注射液(以下简称长春瑞滨)建立PICC静脉化疗动物模型,对化疗性静脉损伤的发生机制和病理反应过程进行实验研究,以期为肿瘤患者探寻针对PICC相关性静脉损伤的防护措施。
1 材料和方法
1.1 实验动物
普通级新西兰大白兔(以下称实验兔)48只,体质量1.2~2.5 kg,雌雄各半,雌兔未孕,购自金华市实验动物中心,实验动物生产许可证号:SCXK(浙)2017-0004,实验动物使用许可证号:SYXK(浙)2016-0008,在金华市食品药品检验检测研究院进行动物实验,经金华职业技术学院动物伦理审批,IACUC编号:2019017。实验兔随机编号,单笼饲养,按编号排列兔笼。
1.2 主要试剂与仪器
1.9 Fr×50 cm的单腔PICC导管(批号:1901002,优力捷公司);0.9%氯化钠溶液(批次:A18122701-1,四川科伦药业股份有限公司);酒石酸长春瑞滨注射液(批次:181001,江苏豪森药业集团有限公司)。全自动凝血分析仪RAC-030(R01001,20181225,深圳雷杜生命科技),兽用全自动血液细胞分析仪(型号:BC-2800vet,深圳迈瑞生物医疗电子股份有限公司); ELISA试剂盒(SEA029Ra,批次L210311678;SEA569Ra,批次L210322259;SEA079Rb,批次L210224762;SEA073Rb,批次L210323353;SEA821Rb,批次L210223758;CEA506Rb,批次L210323381,武汉云克隆科技股份有限公司)。
1.3 实验方法
1.3.1分组方法:对48只实验兔进行编号。随机数字表法,分为第1、2、3、7、14、21、23和24天,n=6,共完成一疗程(2个周期)的化疗。第一周期为第1~3天,第2天用药,第二周期为第22~24天,第23天用药。
1.3.2建模方法:规格为10 mg/mL的酒石酸溶解于10 mL生理盐水,按Meeh-Rubner氏公式计算家兔体表面积,确定25 mg/m2作为实验剂量,使用输液泵缓慢注射15 min,于置管后第2天和第23天各给药一次。用药毕,使用肝素盐水按脉冲式正压法封管。在化疗药物间歇期,按正规操作完成PICC置管维护,每周更换一次敷料,遇敷贴潮湿或卷边随时给予消毒和更换。
1.3.3模型评价方法:评判成功建立PICC动物模型的方法为一次穿刺成功,局部无损伤、渗血,X光透视下确定导管末端无扭曲、折叠,留置在实验兔前腔静脉。实验兔给药后存活,无严重不良反应。
1.3.4标本提取方法:每只实验兔在相应的时间点,拔除PICC留置管并用外科手术法分别在导管前、后截取两段(靠耳缘静脉端为前段、靠前腔静脉端为后段),平均每段长约5 cm;同时截取耳缘静脉与前腔静脉,每段长约3 cm,共4个活体标本,分别在10%甲醛中固定,8组48只实验兔共计192个标本。
1.3.5静脉炎与血栓评价方法:目测观察8组静脉炎发生情况。根据闻曲等[4]报道,按照美国静脉输液护士学会2011年修订标准,结合动物实验特点,去除评价标准中有关疼痛的指标,将静脉炎分为5个等级:0级,没有症状;Ⅰ级:穿刺部位出现红斑,伴随或不伴随疼痛;Ⅱ级:穿刺部位出现红斑及疼痛,和/或水肿;Ⅲ级:穿刺部位出现红斑及疼痛,形成条状痕或纹,可触及静脉索;Ⅳ级:穿刺部位出现红斑及疼痛,形成条状痕或纹,可触及的静脉索>2.5 cm。光镜下观察其病理变化程度,从7个方面判定:①血管肿胀,血管周围水肿;②炎性细胞浸润;③管壁增厚;④管腔充血;⑤纤维增生,内皮细胞增生;⑥血管周围出血;⑦血栓形成。
1.3.6凝血指标与免疫指标监测方法:8组于置管后对应时间分别采集实验兔PICC管内静脉血,检测凝血酶原时间(PT)和血小板计数(PLT),并采用ELISA法检测C反应蛋白(CRP)、D-二聚体(D-dimer)、E-选择素(E-Selectin)、P-选择素(P-Selectin)、白介素-2(IL-2)、白介素-6(IL-6)等含量。
1.4 统计学方法
2 结果
2.1 PICC化疗的静脉炎与静脉血栓发生率对比
观察各组12个静脉标本以12个PICC导管标本,目测静脉炎发生率为33.3%共8组,n=6,均为Ⅰ级静脉炎,实验组与对照组比较,虽无显著统计学差异,但明显可见第7天炎症达高峰。光镜观察静脉血栓及导管血栓发生率分别为9.38%和31.25%,实验组与对照组比较无显著统计学差异,但第21天静脉血栓与导管血栓均未发生(表1)。

表1 各组实验兔PICC化疗静脉炎与静脉血栓发生率比较
2.2 PICC化疗的静脉血管苏木素-伊红(HE)染色检测结果
PICC置管第1天(对照)耳缘静脉血管内膜不规则破溃和纤维性增生,形成瘢痕,管腔几乎闭塞,并伴少量出血。前腔静脉血管内膜不规则破溃,管壁增厚,并伴较多炎性细胞浸润。实验组:第2天(首次给药)耳缘静脉血管壁轻微破溃,并有少量血栓。前腔静脉血管内膜不规则破溃、管壁增厚,并伴少量炎性细胞浸润;第3天耳缘静脉血管内膜不规则破溃、内膜纤维性增生并无血栓。前腔静脉血管内膜变化同第2天;第7天耳缘静脉血管腔内形成瘢痕,管腔未完全闭塞。前腔静脉血管内膜较完整,管壁略增厚,并伴少量炎性细胞浸润;第14天耳缘静脉血管壁轻微破溃,少量血栓,管腔较通畅。前腔静脉血管内膜较完整,管壁正常,并伴少量炎性细胞浸润;第21天耳缘静脉血管较完整,无明显瘢痕,无血栓形成,管腔通畅。前腔静脉血管内膜较完整,管壁略增厚,并伴少量炎性细胞浸润;第23天(再次给药)耳缘静脉血管腔内形成瘢痕,管腔未完全闭塞。前腔静脉血管内膜较完整,管壁略增厚,并伴较多炎性细胞浸润;第24天耳缘静脉管腔内无明显瘢痕及血栓形成。前腔静脉内膜较完整,管壁正常,并伴少量炎性细胞浸润(图1~图2)。

图1 各组实验兔PICC化疗的耳缘静脉HE染色检测结果

图2 各组实验兔PICC化疗的前腔静脉HE染色检测结果
2.3 PICC化疗的导管HE染色检测结果
PICC置管第1天(对照)、第2天(首次给药)及第23天(再次给药)导管内均有血栓,并充满管腔。第3天导管内有血栓,占部分管腔。第7、14、21及24天导管内均无血栓(图3)。

图3 各组实验兔PICC化疗的导管HE染色检测结果
2.4 PICC化疗的凝血指标监测结果
7组实验兔PICC化疗血清中的PLT、PT及D-dimer含量各组间比较,以及与对照组比较,差异极显著(P<0.001,图4)。
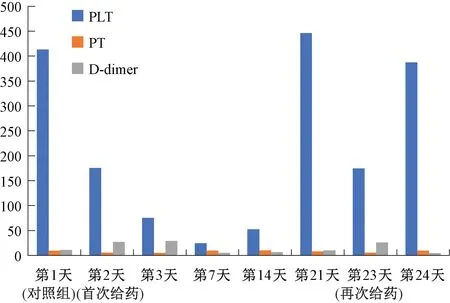
图4 各组实验兔PICC化疗的凝血指标监测结果比较
2.5 PICC化疗的免疫指标监测结果
实验兔PICC化疗血清中,CRP、E-Selectin、P-Selectin、IL-2及IL-6含量各组间比较,并与对照组比较,差异极显著(P<0.001,图5)。

图5 各组实验兔PICC化疗的免疫指标监测结果比较
3 讨论
本研究发现PICC置管引起的静脉炎发生率为33.3%,静脉血栓发生率为9.38%,与李俊英[5]和王红等[6]分别报道的17%~32.3%(静脉炎)以及26.67%(静脉血栓)有差异。推测本研究静脉炎较高发生率可能与以下因素有关:(1)穿刺PICC置管过程中导管尖端错位或血管损伤,引起血管内膜受损;(2)留置导管致局部血流缓慢;(3)导管属机体异物,较快就被血浆蛋白与纤维蛋白包围,血小板聚集;(4)给药后引起血管内膜损伤等。炎症反应在留置PICC管后1 d便出现,第3天(给药后1 d)炎症加重,第7天炎症达高峰,第14天仍有小幅升高,直到第21天降至正常水平。这种静脉炎症高峰期后移以及炎症消退时间延后的现象,与王红等[7]报道的24 h出现静脉炎症反应,48 h最显著,约于1周恢复的时间有差异。推测产生以上差异的原因,除了PICC置管所致的物理性损伤外,主要与长春瑞滨刺激血管内皮细胞、血小板或嗜酸性粒细胞,致组织因子释放,静脉血管损伤有关,还与静脉血栓形成有关,如图1所示,第2天静脉管腔已出现血栓,第7天血栓基本已波及整个血管壁,直至第21天血管壁内膜完整、管腔光滑及血管损伤基本修复。可见一个化疗周期的两个疗程间歇时间安排较为合理。
本研究发现导管血栓的发生率为31.25%,明显高于静脉血栓的发生率,分析原因可能与导管内径较小,血流量较小及血流速度较慢有关。两次用药后,实验兔血液内PLT明显下降、PT缩短及D-dimer时间明显延长,提示PICC置管及使用化疗药物后,家兔处于高凝状态。Maemura等[8]和罗丹凤等[9]研究表明,因长春瑞滨属长春花碱类衍生物,该药对微管蛋白具有较高的亲和力,故能起到阻止微管蛋白聚合及诱发微管解聚等作用,达到抑制肿瘤细胞复制、分裂及增殖的目的,该药骨髓抑制程度较重,血小板减少明显[10]。Haas等[11]证实,该药致血管内皮损伤,内皮细胞表面凝血酶调节蛋白(TM)及内皮细胞蛋白C受体(EPCR)表达降低,蛋白C的活化受损,抗原提呈细胞(APC)活性减低,引起内皮细胞(VEG)促凝及抗凝活性的平衡失调;也可引起血浆蛋白C和游离蛋白S水平下降,增加纤溶酶原激活物抑制剂PAI1水平,从而产生高凝状态。同时,PICC置管产生的机械性刺激,加重损伤血管内皮细胞,增加组织因子的产生,促进凝血功能。周平等[12]研究提示,静脉血栓高发风险为D-dimer时间延长,这与本实验研究结果相符。D-dimer时间延长,可能与置管穿刺操作及化疗药物对血管造成刺激和损伤有关,经同时激活纤溶系统和凝血系统,实验兔在PICC置管第2天、第3天以及第23天家兔的D-dimer时间延长明显。
宋云霄等[13]发现,CRP与IL-6在使用化疗药物后第2天和第23天升高明显,停药5 d后降至较低水平。CRP主要用于感染性疾病的诊断,可反映机体的免疫功能和炎症水平,可与IL-6相互作用,引起炎性细胞浸润。IL-6属于具有多种免疫调节功能的一种前炎性细胞因子[14-15],如升高说明机体处于炎症反应期。结合本实验,实验兔两次给药后,CRP与IL-6明显升高,提示化疗药物对血管内膜的刺激,导致静脉炎的发生。
本实验还分别测定了PICC置管后各时间点的E-Selectin和P-Selectin含量,E-Selectin在用药后升高,但随之小幅下降;P-Selectin含量在置管第3天达峰值。Krause等[16]和Silva等[17]报道,E-Selectin和P-Selectin作为一类重要的细胞黏附分子,在微血管和骨组织中恒定表达,当机体遭遇炎症损伤或肿瘤侵犯时,体内的E-Selectin和P-Selectin表达便会上调,介导层流条件下的白细胞在血管内皮细胞上的滚动及黏附。因此,本实验提示实验兔PICC置管早期,二者可能介导了炎症细胞迁移、黏附,参与了静脉损伤后修复的病理过程。其中,P-Selectin在血栓形成过程中起始动作用,使血小板与中性粒细胞黏附、聚集并形成血栓,上调单核细胞表达组织因子,进一步引起止血异常,导致单核细胞在损伤的血管内皮滚动与聚集,激活炎症细胞引起局部炎症反应,进一步损伤血管内皮功能。
IL-2主要由经充分活化的TH1细胞产生,属人体内一种非常重要的免疫调节因子,不仅可对T细胞分泌淋巴因子过程产生刺激和活化作用,参与到免疫调节机制中,且还可使T淋巴细胞、自然杀伤细胞及单核细胞的细胞毒活性得到显著性提升[18-20]。本实验发现,IL-2在使用化疗药物后,呈下降趋势,在第21天达峰值,说明实验兔使用长春瑞滨后,抑制TH1细胞分泌IL-2,致机体免疫力下降,经化疗间歇期的调整后,基本恢复正常。
综上,本研究在通过建立PICC化疗药物动物模型,检测不同时间点血液内凝血指标与免疫指标的含量及变化规律,探讨炎症反应的可能机制及病理变化,有助于理解各指标在血管损伤修复过程中的作用,为今后采用各指标特性进行PICC化疗静脉并发症的防护研究提供依据与思路。

