苯甲酰芍药苷通过Nrf2/HO-1通路对心肌梗死大鼠心功能的影响作用机制研究
余 莉 邬 洋
(武汉市中医医院二桥分院心血管内科,武汉 430000)
现阶段,急性心肌梗死(AMI)仍然是全世界范围内导致死亡的主要原因之一[1]。氧化应激反应和细胞凋亡在AMI后损伤的病理演变过程中占有重要地位,在早期急性缺血中,血液供应不足会引起氧化应激反应,进而诱导心肌细胞凋亡,改善氧化应激反应和抑制急性心肌缺血后的细胞凋亡是治疗AMI的主要策略[2-3]。根据雷斌等[4]报道,核因子E2相关因子2/血红素加氧酶1(Nrf2/HO-1)通路是调节氧化应激的关键通路,在AMI中发挥重要作用,但是目前尚无治疗AMI的特效药物。近年来中药在治疗AMI中取得了重要进展,赤芍是毛茛科植物赤芍或川赤芍的干燥根,具有清热凉血、活血祛瘀的功效,可有效治疗冠心病及其并发症[5]。苯甲酰芍药苷(benzoylpaeoniflorin,BA)是赤芍的有效活性成分,具有调控氧化应激的功能[6-7]。最新研究显示芍药苷可以缓解脑缺血再灌注损伤引起的大鼠脑组织细胞凋亡[8]。本研究主要分析BA通过Nrf2/HO-1通路对AMI大鼠心功能的影响和作用机制。
1 材料和方法
1.1 实验动物、试剂和材料
成年SPF级的SD大鼠,雄性,220~250 g,购自成都达硕生物科技有限公司,实验动物生产许可证号:SCXK(川)2019-17。本研究相关实验已通过武汉市中医医院实验动物福利伦理审查,编号:WHTCMLLDW2019-017。BA(吉林大学药物化学研究室)、苏木素-伊红(HE)染色试剂盒、ELISA试剂盒及TUNEL凋亡试剂盒(上海碧云天生物技术有限公司),酶标仪(Model 680,Bio-Rad),RIPA裂解缓冲液(Beyotime),BCA蛋白测定试剂盒(Applygen),抗体(Abcam),PVDF膜(Bio-Rad)。小动物超声成像仪(麟得科学仪器有限公司),BX-42光学显微镜(Olympus)。
1.2 动物分组、建模和干预
36只SD大鼠随机分为三组(n=12):Sham组、AMI组和AMI+BA组。AMI组和AMI+BA组大鼠建立AMI模型[9]。AMI模型建造方法简述如下,通过腹腔注射1%戊巴比妥(3 mL/kg)麻醉大鼠,麻醉后连接心电图,使用剪刀小心剪开胸腔暴露心脏,使用6/0线在左心耳下约 2 mm处的冠状动脉前降支结扎。此时心电图显示大鼠心电图显示QRS波增宽,提示结扎成功,继续结扎30 min后取出丝线进行再灌注,然后缝合胸腔。术后使用抗生素进行抗感染干预,注射8万U的青霉素,2次/d,持续3 d。Sham组打开胸腔暴露心脏但不结扎,缝合胸腔后注射青霉素。建模后AMI+BA组大鼠使用BA灌胃,170 mg/kg,1次/d,连续7 d,在第8 天进行后续检测。
1.3 观察指标及方法
1.3.1心功能指标:大鼠通过检查心电图后连接超声成像仪进行心脏超声检查,根据仪器说明书检测左室射血分数(LVEF),以及左室内压力最大变化率(±dp/dtmax)。
1.3.2心肌酶指标:采集大鼠尾静脉血液样本,将血液样本离心收集上层血清(2 000 r/min、20 min)。然后使用ELISA试剂盒检测肌酸激酶MB(CK-MB)和乳酸脱氢酶(LDH),根据制造商说明书加入抗体,然后通过酶标仪检测吸光度,然后根据标准曲线计算浓度。
1.3.3HE染色:大鼠处死后取出心脏,将心肌组织经过梯度乙醇脱水、透明处理后石蜡包埋,冷冻后切成4 μm厚切片,再将切片脱蜡并再水化。使用3%的过氧化氢(H2O2)甲醇溶液封闭内源性过氧化物酶活性。使用蒸锅在95 ℃、0.01 mol/L柠檬酸盐缓冲液(pH=6.0)中对切片进行热诱导的抗原回收。通过HE染色试剂盒观察心肌组织病变情况。
1.3.4TUNEL染色检测心肌细胞凋亡:将心肌组织经石蜡包埋后切成4 μm厚的切片,然后去石蜡、水化,使用蛋白酶K溶液消化15 min,洗涤。将切片与H2O2-PBS缓冲液在室温下孵育15 min,并用PBS洗涤3次,每次5 min。按照试剂盒说明加入染色试剂,然后进行反染色。显微镜下随机选择5个视野,呈现深棕色的细胞计为凋亡细胞,凋亡率(%)=(染色阳性细胞数目/视野中总细胞数目)×100%。
1.3.5Western blot:将心肌组织研磨,使用RIPA裂解缓冲液裂解,使用BCA蛋白测定试剂盒测量总蛋白含量。使用SDS-PAGE分离等量的总蛋白(120 V、90 min),然后将蛋白转移到PVDF膜上(50 V、120 min),在含有5%脱脂牛奶的封闭溶液中封闭,而后将PDVF膜与anti-Nrf2和anti-HO-1(1∶500稀释)在4 ℃孵育过夜,加入HRP偶联二抗(1∶5 000稀释)在室温下孵育1 h。使用ECL试剂盒可视化蛋白条带,并使用ImagePD软件使用GAPDH作为内参对蛋白条带的灰度进行定量。
1.4 统计方法
2 结果
2.1 各组大鼠心功能指标比较
AMI 组大鼠 LVEF、±dp/dtmax和-dp/dtmax显著低于Sham 组(P<0.05),AMI+BA组LVEF、±dp/dtmax和-dp/dtmax显著高于AMI组(P<0.05),见表 1。

表1 各组大鼠LVEF和±dp/dtmax比较
2.2 各组大鼠心肌酶指标比较
AMI+BA组CK-MB和LDH显著低于AMI组(P<0.05),见表2。

表2 各组CK-MB和LDH水平比较
2.3 心肌HE染色结果
Sham组心肌细胞形态正常,且排解紧密。AMI组心肌细胞形排列紊乱,并出现炎性浸润和细胞丢失。AMI+BA组心肌细胞形态基本正常,排列基本正常,细胞丢失显著减少,见图1。

图1 HE染色检测心肌组织损伤情况(×400)
2.4 各组心肌细胞凋亡情况比较
如图2所示,蓝色为细胞核,染色为深棕色的即为凋亡细胞。AMI组的凋亡率(13.08±1.23)%显著高于Sham组(1.14±0.10)%,P<0.05,AMI+BA组心肌细胞凋亡率(6.43±0.78)%显著低于AMI组,P<0.05。

图2 TUNEL染色检测心肌细胞凋亡情况(×400)
2.5 各组Nrf2/HO-1通路水平比较
与Sham组比较,AMI组Nrf2/HO-1水平显著降低(P<0.05),AMI+BA组Nrf2和HO-1水平显著高于AMI组,见表3和图3。

表3 各组Nrf2/HO-1蛋白水平比较
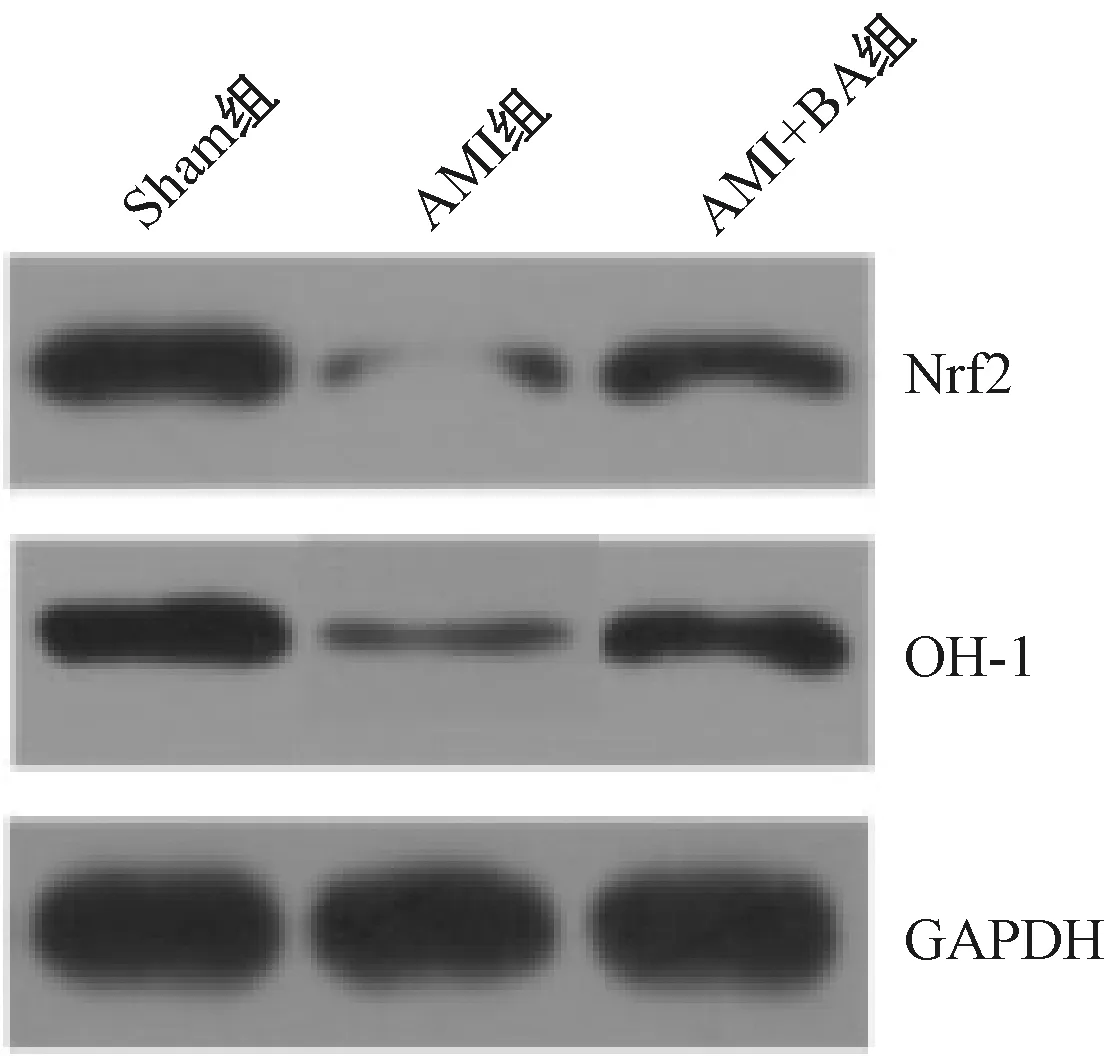
图3 Western blot检测Nrf2/HO-1通路中蛋白水平
3 讨论
心肌组织的急性心肌缺血会导致氧自由基等活性氧物质的产生增加,并引起有害细胞信号的激活,从而促进内皮细胞的炎性细胞因子和趋化因子的表达,导致炎症细胞向缺血的心肌区域浸润,引起心肌损伤。另一方面,高水平的活性氧自由基和炎性因子也会促进心肌细胞凋亡,而心肌组织梗死区和附近的心肌细胞死亡会进一步促进剩余健康心肌的重塑,进而引起左心室重塑引起纤维化和左心室扩张,影响功能,严重时会导致心力衰竭。抑制AMI后的心肌细胞凋亡,增加存活心肌细胞的数量是减少心肌损伤维持AMI后正常心功能的重要途径[10]。
在中药理论中,赤芍具有散瘀止痛、清热凉血及活血化瘀之功效,过往有研究显示赤芍具有保护心肌缺血再灌注损伤的作用[11]。赤芍也对心肌缺血有治疗效果[12]。BA是赤芍中重要的活性物质[13],并且具有抑制氧化应激反应和炎性反应的作用,而这是AMI后主要的病理改变[14-15]。本研究通过结扎的方法建立大鼠AMI模型,并采用BA灌胃干预,结果显示在干预7 d后,AMI组LVEF和(±dp/dtmax)显著降低,其中LVEF降至50%以下,心功能明显受损,并且HE染色结果显示心肌细胞受损和丢失。经过BA干预后,大鼠LVEF和(±dp/dtmax)恢复,提示心功能恢复较好,并且HE染色显示细胞丢失显著减少。这提示BA可显著地减少心肌细胞损伤,从而促进AMI后心功能的恢复。
凋亡是细胞死亡的一种独特形式,心肌细胞凋亡是AMI后的重要特征,是急性缺血阶段心肌细胞减少的重要原因,研究显示在AMI的初期(0~7 d),心肌细胞凋亡优先于细胞坏死,并且细胞凋亡数目是决定最终梗死面积的主要影响因素[16]。抑制心肌梗死后心肌细胞凋亡可能会改善左心室重构,从而改善心脏功能[17]。Nrf2/HO-1通路具有调节凋亡的作用,可通过调节氧化应激或炎性反应的方式,或直接调控心肌细胞的凋亡[18]。Zhao等[19]的研究结果也显示高糖诱导的心肌细胞凋亡与Nrf2/HO-1通路有关。本研究结果显示,AMI建模7 d后,Nrf2/HO-1通路受到抑制心肌细胞凋亡显著增多,而BA可上调Nrf2/HO-1的水平,缓解心肌细胞的凋亡情况。此外,有研究显示BA具有通过上调Nrf2/HO-1水平以缓解小鼠氧化应激的作用[20]。在脊髓损伤的大鼠模型中,BA也可以通过调节Nrf2氧化应激通路减轻症状[21]。这提示BA可能通过上调Nrf2/HO-1通路,抑制AMI大鼠的心肌细胞凋亡。
综上所述,BA通过上调Nrf2/HO-1通路从而抑制AMI模型大鼠的心肌细胞凋亡,并发挥保护心功能的作用。关于BA对AMI的影响以及调控Nrf2/HO-1通路的机制仍需要进一步研究。

