一种新的兔髋关节腔注射给药方法介绍*
张 鑫 李志刚 申意伟 徐西林 刘 钊 张晓峰
(1.黑龙江中医药大学研究生院,哈尔滨 150000)(2. 黑龙江中医药大学附属第二医院,哈尔滨 150001)(3.黑龙江省中医药管理局,哈尔滨 150000)
兔为股骨头坏死常用的实验动物模型,兔股骨头坏死模型建立后,在验证相关注射药物药效时如何将药物注射至股骨头附近是实验时遇到较为棘手的问题。目前在动物实验层面,关节腔注射疗法在研究膝关节疾病时使用较多,而采用髋关节腔注射给药的研究较少[1]。在临床治疗中,对患者进行髋关节注射时多采用仰卧位[2]。然而,兔不是直立行走动物,较难在仰卧位进行髋关节注射,且未有文献对兔髋关节腔的注射方法进行论述。因此,需找到一种新的兔髋关节腔注射方法来帮助相关动物实验的顺利开展。在既往兔股骨头坏死造模及药物治疗的相关动物实验基础之上,根据兔的解剖学特征,介绍一种从背侧入路对兔进行髋关节腔注射的方法操作简单,可靠性高,便于实行,故将该方法总结后进行详细阐述。
1 材料和方法
1.1 材料
1.1.1实验动物:新西兰兔1只,6月龄,体质量约为3.0 kg,购自北京富龙腾飞实验动物研究院有限公司,实验动物生产许可证号:SCXK(京)2018-0009,饲养于河北以岭医药研究院有限公司实验室,实验动物使用许可证号:SYXK(冀)2020-003。饲养期间自由饮水,饲喂兔维持饲料购自北京科澳协力饲料有限公司,京饲证(2018)06073。饲养环境:单笼饲养,相对湿度为(50±5)%,12 h/12 h明暗交替和温度(22±2)℃。所有操作均经过河北以岭医药研究院实验动物实验伦理学要求,审批号:N2021021。
1.1.2仪器、试剂与材料:小动物麻醉机基础型R500IE和异氟烷(深圳市瑞沃德生命科技有限公司),电推剪(CP-7800,CODOS),0.5% 伊文思蓝染色液(Evan blue,DK0001,北京索莱宝科技有限公司),碘伏、棉球、1 mL无菌注射器、直尺、记号笔等。
1.2 方法
①备皮:用电推剪剔除兔臀部毛发,充分暴漏兔臀部皮肤,便于定位和消毒(图1)。
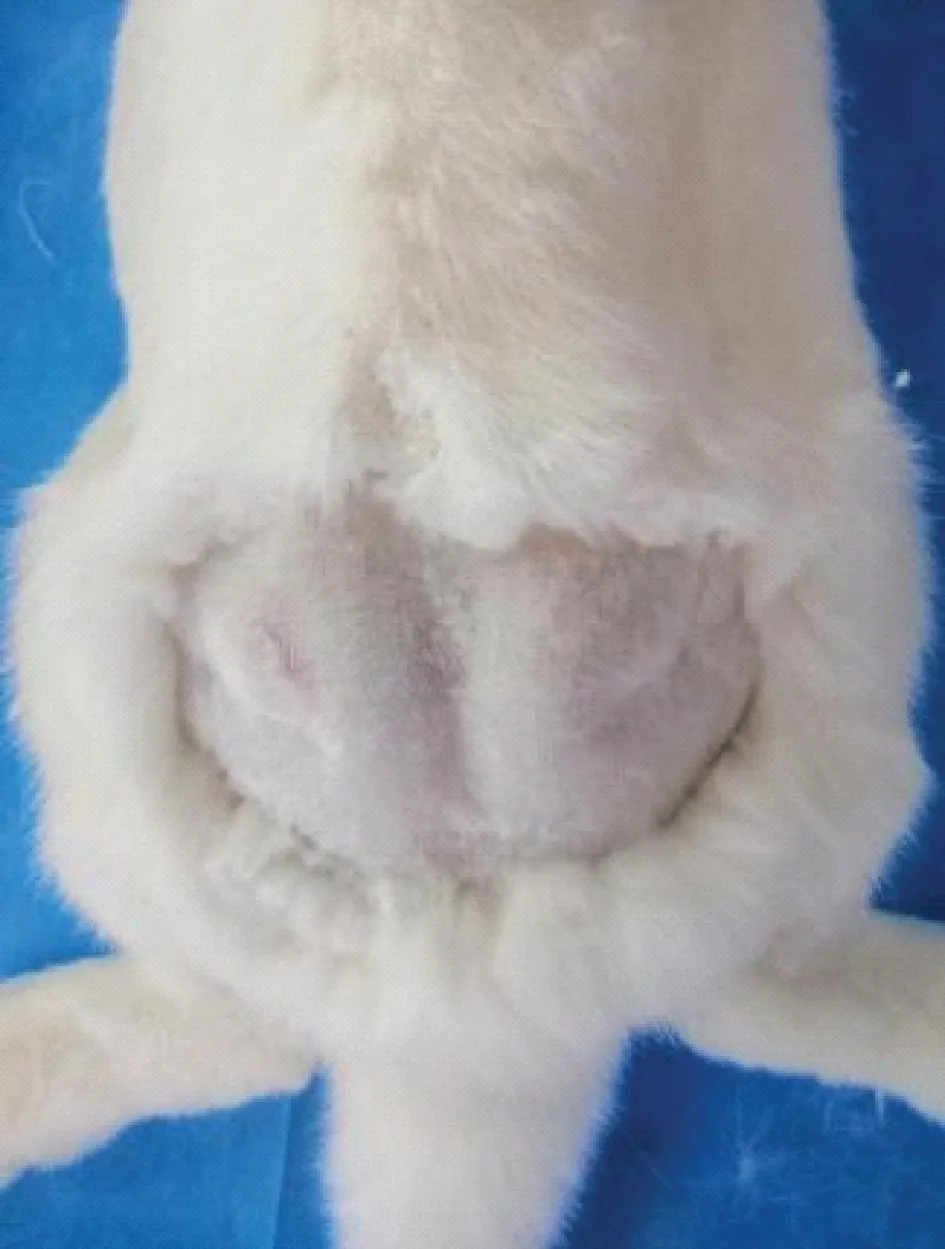
图1 备皮
②麻醉:通过小动物麻醉机,使用异氟烷麻醉动物。
③定位:麻醉后兔俯卧位放置于无菌单上,呼吸面罩持续吸入异氟烷维持麻醉,操作者立于兔的右侧。定位之前,需将兔摆放至髋关节注射时体位,以确保定位的准确性,避免定位与注射时因体位不同而导致体表定位不准确。
体位摆放如下:将兔注射侧髋膝关节各屈曲90°(图2),并使其髋关节内收,双侧膝关节相互靠拢,以增加股骨头与髋臼之间的间隙,有利于注射时顺利穿刺至髋关节腔。第一步,左手拇指置于兔臀部触摸大转子,以大转子后上部为第一定位点并标记(图3)。第二步,触摸兔脊正中线并标记一直线,作为第二标记线。第三步,用直尺经第一标记点做脊正中线之垂线,将大转子与脊正中线之垂线所构成的线段分为7等份,选取距大转子内三份为进针点,亦可在大转子向脊正中线方向距大转子1.5 cm处左右做标记,即为进针点(图6)。
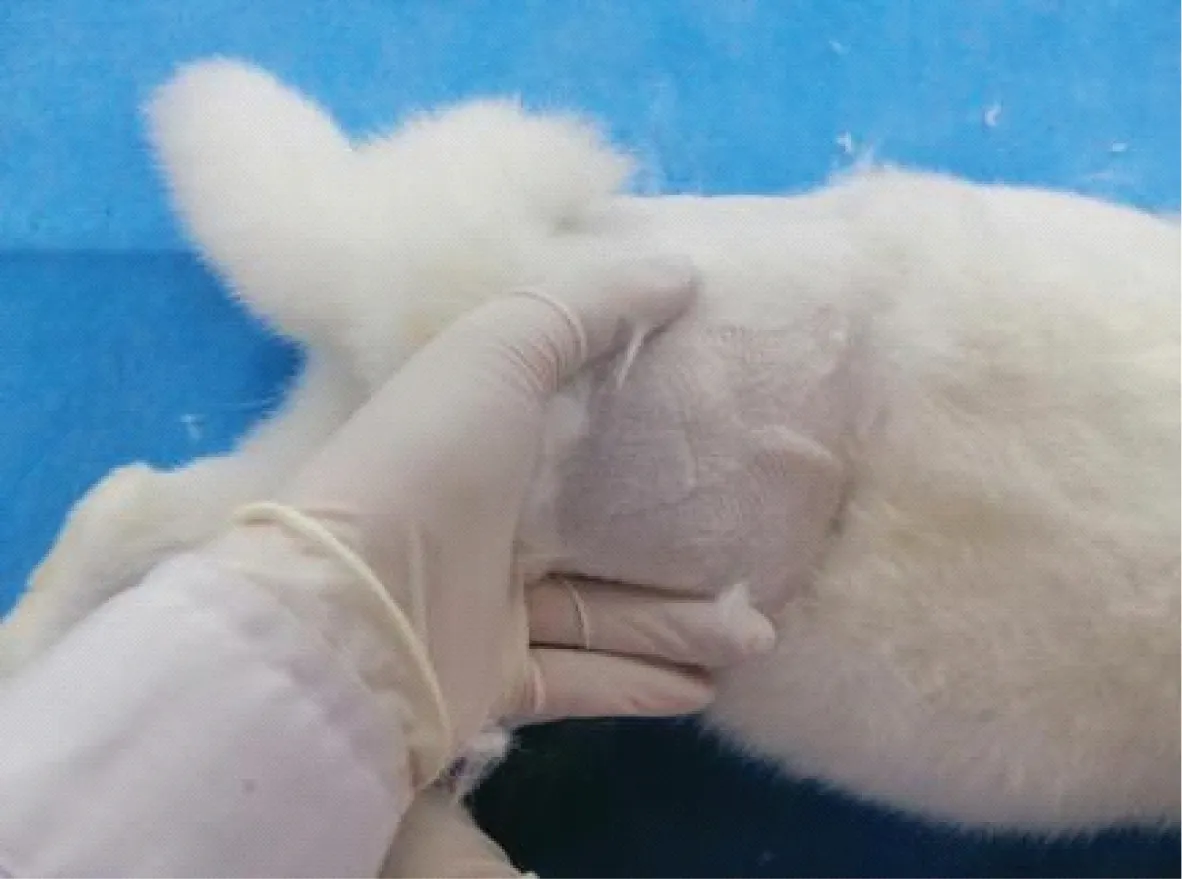
图3 定位大转子后上部

图4 右侧注射体位

图5 左侧注射体位

图6 测量
④消毒:碘伏棉球消毒进针点及周围皮肤(图7)。
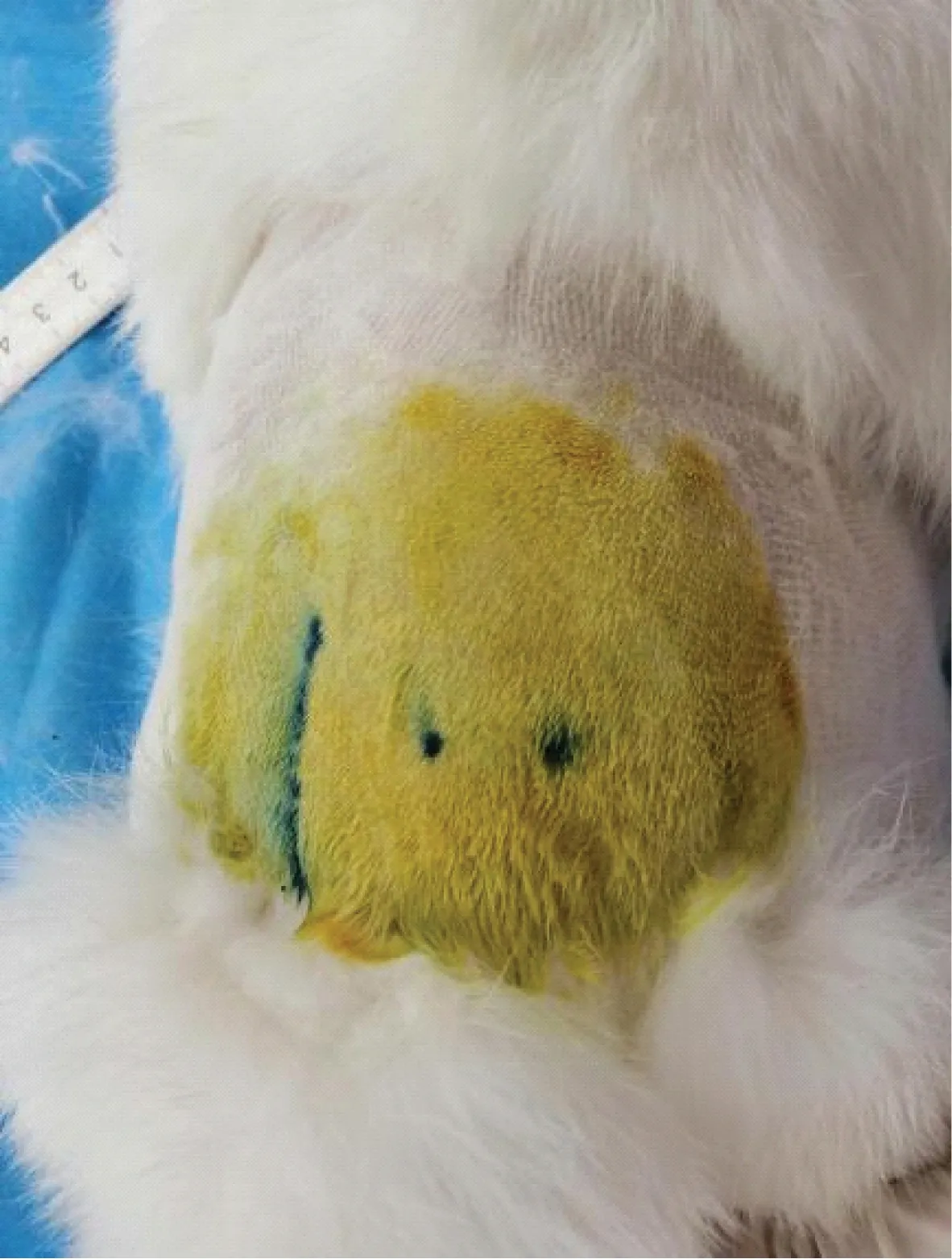
图7 消毒
⑤给药:右侧髋关节注射时,右侧屈髋屈膝90°,左手持兔左侧股骨,左手拇指置于大转子后上部,小指置于股骨外侧,其余三指置于股骨内侧,夹持股骨向外稍用力(图3~4),扩大股骨头与髋臼之间的间隙,左手拇指触摸到大转子固定于大转子后上部,根据大转子后上部的位置确定进针点。
左侧髋关节注射时,左手的放置方法稍有不同,但都应以固定兔股骨稳定为原则,左侧屈髋屈膝90°,左手持兔左侧股骨,左手拇指置于大转子后上部,其余四指握持左侧股骨并将兔与操作者腹壁紧贴以保持稳定(图5),左手拇指将大转子部向外推动,其余四指将股骨内收以扩大股骨头与髋臼之间的间隙,左手拇指固定于大转子后上部,根据大转子后上部的位置确定进针点。
碘伏消毒后用一次性1 mL无菌注射器垂直进针(图8),注意避开坐骨神经和血管。进针后在触及骨骼后停止进针(垂直进针距离约1 cm左右),此时即进针至髋关节附近,稍微调整针头寻找股骨头与髋臼之间缝隙,针头有触及滑膜感的囊性感时即进入髋关节腔,立即进行注射。注射完成后拔出注射器针头,碘伏棉球按压片刻不出血即可。随后关闭气麻机,将兔侧卧位平放于兔笼内,约3~5 min后即可苏醒。

图8 注射
2 讨论
2.1 髋关节注射进针点的合理性
兔髋关节的解剖如图9所示,在大量兔动物实验的基础上根据其解剖形态发现经背侧对兔进行髋关节腔注射在解剖学上有充分的合理性。在兔髋关节内收的前提下,背侧髋关节间隙增宽,且神经血管距髋关节间隙存在着一定距离,此时进行兔髋关节注射时不会损伤血管和坐骨神经,安全性高。
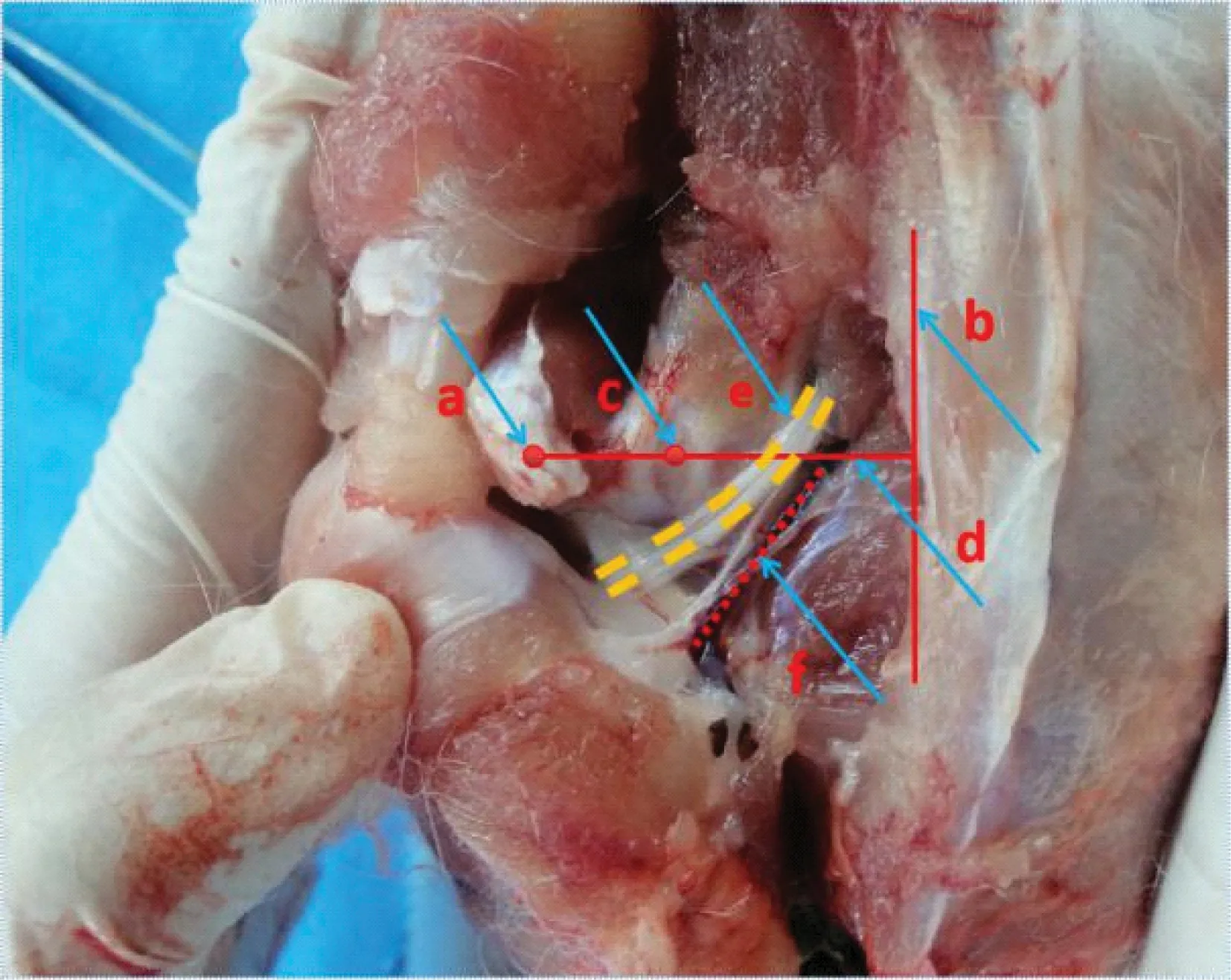
图9 兔髋关节解剖
根据分离的股骨头测量数据得出,兔大转子距股骨头最远处的距离为1.5 cm左右(图10)。在体表测量大转子距后正中线的总距离为3.5 cm左右(图6),因兔子个体大小略有差异,可按比例进行计算定位,即将大转子距后正中线的总距离分为七等份,选取外侧三等份与内侧三等份交界点为进针点,也可直接取大转子后上部内侧沿向后正中线垂线内侧1.5 cm左右进针。

图10 大转子至股骨头前端的距离测量
取一只新西兰兔按照前期总结的髋关节注射操作方法,向兔髋关节腔注射伊文思蓝染色液进行验证。操作方法如上所述,注射完成后,将兔髋关节进行解剖,注射后未去除关节囊可见伊文思蓝染色液成功注射至髋关节腔(图11)。去除关节囊后,可见股骨头已被成功染色(图12)。将股骨头分离后可见,整个股骨头已被伊文思蓝溶液充分染色(图13),证明药物成功注射入髋关节腔并在关节腔内充分的分布,与股骨头表面接触完全,达到药物注射的理想效果。

图11 注射伊文思蓝染色剂后未分离关节囊的股骨头
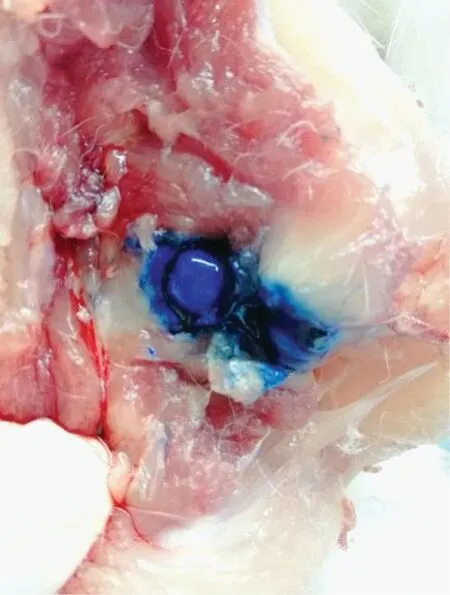
图12 注射伊文思蓝染色剂后分离关节囊的股骨头

图13 分离后的股骨头
2.2 优点
①相对于耳缘静脉注射戊巴比妥钠麻醉,气麻机麻醉后兔能够快速苏醒,反复进行关节腔注射时对实验动物的影响较小,且无需使用兔固定盒,避免了在关节腔注射过程中兔的剧烈反抗而伤及实验人员;②只要严格按照文中介绍的定位方法定位进针点,即可将药物注射至关节腔及周围。操作熟练后,单人即可快速完成,省时省力;③关节内给药是一种保守治疗方法,可将治疗性药物直接注射到关节腔中。相比传统的口服等给药方式,避免了首关消除,直达病所,改善了药物生物利用率的问题,从而最大限度的扩大治疗效果[3];另一方面,关节腔注射时药物使用较低剂量即可达到治疗浓度,减少了药物的使用剂量,同时也减少了不良作用发生的概率[4-5];④髋关节腔是由滑膜和关节囊构成的一个密闭且独立的解剖间隔,髋关节腔注射使治疗药物直接进入关节腔,随后立即与股骨头、软骨、髋关节滑膜与关节囊动脉等病灶部位直接接触,有利于药效的充分发挥[6]。
2.3 不足
关节内给药是一种有创操作,一定程度上会增加感染、肿胀等并发症的风险[7]。因此,在操作时要严格备皮、消毒后再进行后续操作。
2.4 注意事项
①定位之前,需将兔摆放至髋关节注射时体位,以确保定位的准确性,避免定位与注射时因体位不同而导致体表定位不准确;②进针时要将兔髋关节内收以牵开坐骨神经和血管,扩大关节间隙。
综上所述,本方法操作简便,可行性高,严格按照操作步骤定位即可将药物顺利注射入兔髋关节腔,为大量动物实验的大批量开展提供了便捷,是一种行之有效的兔髋关节腔注射给药方法。

