一种阿尔茨海默病大鼠模型的建立*
孟 雪 贾 璞 郑晓晖 王世祥 骆 晶
(1. 陕西省中医药研究院中药研究所,西安 710003)(2. 西北大学生命科学学院,西安 710069)
阿尔茨海默病(Alzheimer’s disease,AD)是以进行性认知障碍和记忆力损害为主的神经系统退行性疾病。我国每年治疗AD患者的直接费用和间接费用合计高达1万多亿元,给家庭和社会带来沉重负担[1]。目前,AD发病机制尚无定论,病因有β-淀粉样蛋白异常沉积、胆碱能损伤学说、Tau蛋白过度磷酸化、氧化应激等[2]。复杂病因使得基于药物靶标的AD西药研发进展缓慢。因此,中药复方多途径协同起效,防治AD的独特优势日益受到重视。良好的病理模型是AD新药研发临床前研究的基础[3-4]。由于其疾病本身的复杂性,单一病理因素模拟下的AD动物模型无法复制该病的整体症状,越来越多的研究趋向于复合造模。D-半乳糖(D-gal)可在脑组织中形成淀粉样斑块,诱导神经细胞老化、损伤等[5-6]。Anil等[7]报道,铝是慢性蓄积性神经毒物,动物实验表明铝会导致神经病理、神经行为及神经化学的改变,从而导致记忆能力损伤。因此,本研究选择皮下注射氯化铝(AlCl3)和腹腔注射D-gal的复合造模方法,制作一种创伤小、周期短且易操作,但接近真实病理状况的AD大鼠模型,通过经典Morris水迷宫实验及大鼠脑内乙酰胆碱酯酶(AchE)水平检测对模型进行评价。
1 材料和方法
1.1 实验动物
SD雄性大鼠,SPF级,20只,体质量220~240 g,购自广东省医学实验动物中心,实验动物许可证号:SCXK(粤)2018-0002。饲养于清洁级环境,温度(21±2)℃、相对湿度为(50±2)%,明暗交替周期为12 h/12 h,大鼠自由进食和饮水。本实验通过陕西省中医药研究院中药研究所福利伦理审查,审查编号:CAP2017(A)0029-2019,伦理审查意见第503号。
1.2 试剂
AlCl3购自天津市大茂化学试剂厂,D-gal购自Sigma,AchE测定试剂盒及总蛋白定量测定试剂盒购自南京建成生物工程研究所。
1.3 主要仪器
Spectra Max 340PC型酶标仪:Molecular Devices;DY89-Ⅱ型电动玻璃匀浆机:宁波新芝生物科技股份有限公司。Morris水迷宫:中国医学科学院药物研究所提供,水池为不锈钢制品,直径120 cm,高50 cm,水深25 cm,水池内壁为黑色,配套有机玻璃圆形平台(直径12 cm、高20 cm)。水迷宫正上方安装有摄像机,连接计算机后,可以即时跟踪和拍摄大鼠的运动轨迹,并将记录数据发至电脑系统,图像自动采集系统和SMART2.5.20水迷宫视频分析软件:Panlab。
1.4 建立动物模型
大鼠随机分成正常组和模型组,每组10只。模型组腹腔注射D-gal,给药剂量60 mg/kg;同时皮下注射AlCl3水溶液,给药剂量为100 mg/kg,1次/d,连续45 d,建立AD大鼠模型。
1.5 行为学测试
1.5.1Morris水迷宫适应训练:造模完成后,进行1 d水迷宫适应训练,每只大鼠训练2次。圆形水池被等分为4个象限,定为1、2、3、4象限,平台定为第5象限。大鼠从不同象限入水,如果90 s找不到站台,则人为引导至站台,停留20 s。每次训练完成后,迅速将大鼠用洁净毛巾擦拭干净,轻轻放回笼盒,减少其应激反应。
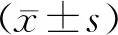
1.5.3空间探索实验:进行4 d的定位航行实验后,大鼠对于水迷宫测试已经比较熟悉,所以选择第5天进行大鼠空间探索实验。撤除平台,选择原平台象限(第4象限)的对侧象限,即第2象限入水,记录大鼠在90 s内跨越原平台(第5象限)的次数。由软件系统自动分析水迷宫内大鼠的航行轨迹,记录大鼠在第4象限的停留时间和游泳距离。
1.6 AchE活性检测
水迷宫测试完成后,大鼠处死,取脑组织,冷生理盐水冲洗,称质量后,以每克组织加入9 mL生理盐水的比例计算,冰浴条件下用玻璃匀浆机充分研磨,将制得的10%脑匀浆液,4 ℃下3 500 r/min离心10 min,吸取上清液。总蛋白含量选取BCA法进行,按照蛋白含量测定试剂盒方法进行,计算出总蛋白含量。AchE检测,严格按照试剂盒测定方法进行。AchE活力值的定义为:(组织蛋白样本/ng)在37 ℃孵育6 min,水解反应体系中1 μmoL基质为1个活力单位。
1.7 统计学处理方法
2 结果
2.1 行为学测试
2.1.1模型死亡率:模型死亡率为0。
2.1.2定位航行实验:结果见表1。第1天,正常组与模型组的潜伏期时间最长,随着天数增加,两组大鼠的逃避潜伏期都逐渐缩短,例如:第4天和第3天的逃避潜伏期接近。将两组每天的潜伏期进行比较,模型组均高于正常组(P<0.01);4 d潜伏期平均值比较发现,模型组的大鼠潜伏期与正常组比较,差异极显著(P<0.01),模型组潜伏期延长约10 s。

表1 大鼠逃避潜伏期测定结果
2.1.3空间探索实验:结果见表2,模型组大鼠穿越原平台次数仅为2.1次,明显低于正常组大鼠的5.1次(P<0.01);模型组大鼠在平台所在象限的游泳时间百分比和距离百分比,分别是(44.87±3.47)%和(42.97±3.91)%,分别高于正常组的(28.09±4.64)%和(29.86±5.91)%,且差异极显著(P<0.01)。
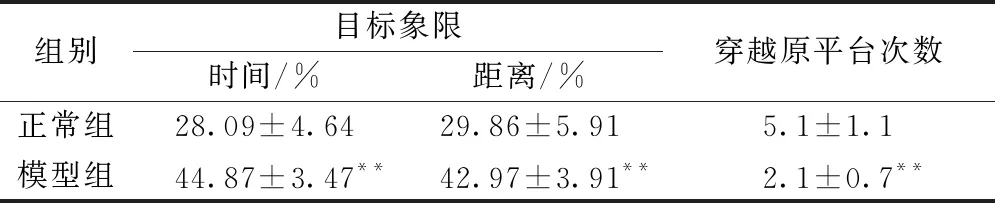
表2 大鼠空间探索实验测定结果
2.2 AchE活性测定
大鼠大脑AchE活性测定结果见表3。模型组的AchE酶活力升高,与正常组相比,差异极显著(P<0.01)。

表3 大鼠大脑AchE活力测定结果
3 讨论
Morris水迷宫是一种检测大鼠学习记忆能力的经典行为学考察方法,实验数据精确,对动物损害较小,相比较其他记忆测试实验,能系统全面地考验动物空间认知加工过程[8]。定位航行实验结果表明,模型组大鼠潜伏期明显延长;空间探索实验中,在目标象限中游泳距离和时间延长,但是穿越平台次数显著减少,与定位航行实验结果基本一致,提示模型组动物学习记忆能力下降。中枢胆碱能系统与学习记忆关系密切,AD患者的中枢神经系统胆碱神经功能明显下降,乙酰胆碱(Ach)为促进学习记忆的重要的神经递质,AchE是表征脑胆碱能系统功能完善、良好的重要标志酶,其活性变化能间接反映Ach在脑中的变化[9]。本研究中,AD模型大鼠脑内AchE活力升高,说明动物胆碱能系统功能受损。综上可知,通过D-gal和AlCl3复合造模方法复制AD模型大鼠,能够复制AD临床病理特征,为防治AD中药新药临床前研究提供合格模型动物。
AD致病因素较多,针对各病因建造的动物模型也较多[10]。目前,AD病理模型主要有以下几种:物理方法(如基底核损坏等)、化学方法(β淀粉样蛋白注射、D-gal、AlCl3)等损毁病理模型;复合动物模型;快速老化小鼠模型;转基因动物模型等,但是这些模型均有一定不足之处,如Aβ损害模型,造模时注射方式会对脑组织形成不可逆地穿透损伤,且随着给药时间的延长,体内会自动清除注射的Aβ,无法维持长时间实验周期。脑是AD疾病的主要病位,某些损毁模型,对动物脑部造成创伤较大,间接干扰实验结果。快速老化小鼠和转基因动物模型则较为昂贵,因此制作复合模型与单因素模型比较而言,更能复制AD疾病复杂的临床病理变化,且造价较低,对动物损伤小,易于操作造模。
D-gal可对机体产生氧化损伤,从而导致脑部神经细胞结构发生改变、脑内正常的生理功能降低,使模型近似于人类自然衰老,产生相近的生理生化功能改变,使得学习记忆能力下降[11]。铝属于慢性毒物,具有神经毒性作用,可导致神经纤维缠结和脑内淀粉样斑块生成[12]。杨坦[13]报道采取灌胃AlCl3结合腹腔注射D-gal制作AD模型,但以小鼠为多见,大鼠模型较少。由于中药复方多为汤剂口服给药,长期灌胃AlCl3对胃肠刺激可能影响口服药物的吸收,间接影响药效实验结果。罗红波等[14]采用灌胃AlCl3和腹腔注射D-gal制作复合模型大鼠,采取Y-迷宫实验检测模型大鼠学习记忆能力下降,已证实该造模方法可以促使海马部位老年斑增多,但未对胆碱能系统影响进行研究。因此,本研究采用Morris水迷宫及脑内AchE检测对模型建立成功与否,进行行为学考察和病理指标评价,进一步验证该AD模型合理性。

