2型糖尿病视网膜病变大鼠模型建立*
朱晓燕 刘 勤, 白惠玲 金 涛 张 书 张延英 康万荣
(1. 甘肃中医药大学第一临床医学院/甘肃省人民医院,兰州 730000)(2. 甘肃中医药大学科研实验中心,兰州 730000)(3.甘肃省人民医院眼科,兰州 730000)
2型糖尿病(rype 2 diabetes mellitus,T2DM)是临床最常见的慢性病及基础疾病之一。近年来,随着人们生活水平的不断提高,T2DM的发病率也呈逐年升高趋势[1]。糖尿病视网膜病变(diabetic retinopathy,DR)是T2DM患者中较常见的一种微血管并发症,亦是导致盲眼病的重要原因[2]。根据Olivares等[3]报道,国内对DR的研究多集中在1型DR模型上,理想的2型DR动物模型仍处发展阶段,国外建立2型DR动物模型多采用基因敲除法。由于条件所限,国内用这种方法建立模型尚有困难,且因无法在活体上动态的监测视网膜变化,国内以往对于DR大鼠视网膜的观察多在离体眼球上进行,导致动物所需数量较多。因此,研究较为简单的方法建立理想的2型DR模型并优化观察视网膜的方法具有一定的现实意义。本研究采用SD大鼠建立2型DR模型,并通过眼底荧光造影(fundus fluorescein angiography,FFA)和病理形态改变动态的观察视网膜,以了解大鼠眼底血管形态及病变严重程度,以期为DR相关治疗提供研究基础。
1 材料和方法
1.1 材料
1.1.1实验动物:SPF级SD大鼠80只,雄性,6周龄,体质量(150±20)g,购自甘肃中医药大学动物实验中心,实验动物生产许可证号:SYXK(甘)2020-0009,所有大鼠屈光间质清晰,外眼及眼前节检查均无异常表现,常规饲养于甘肃中医药大学SPF级实验室。实验动物处理遵守甘肃中医药大学第一临床医学院实验动物伦理原则,实验动物伦理审查编号:2020-298。
1.1.2试剂与仪器:链脲佐菌素(strep-tozotocin,STZ),购自北京索莱宝科技有限公司,批号616S0212;柠檬酸和柠檬酸钠,购自天津市大茂化学试剂厂,批号20161101,20171010;复方托吡卡胺滴眼液购自沈阳兴齐眼药股份公司,批号200802;荧光素钠注射液,购自Alcon Research LLC,批号314040F;血糖仪及试纸,购自拜耳(中国)有限公司,批号DP9LM3F02 A;大鼠胰岛素ELISA试剂盒,购自江苏菲亚生物科技有限公司;高脂高糖饲料,购自沈阳茂华生物科技有限公司,生产许可证号SCXK(辽)2017-0001,基础饲料上加20%蔗糖、10%猪油、2.5%胆固醇及1%胆酸钠;眼球固定液购自武汉赛维尔生物科技有限公司;眼底血管荧光造影机(型号SpectralisHRA+Multicolor)购自德国海德堡公司。
1.2 方法
1.2.1大鼠分组及造模:将所有大鼠按随机数字表法分为空白对照组及T2DM组,n=40。造模方法根据王保伟等[4]研究,将所有大鼠适应性喂养1周后,空白对照组给予普通饲料,T2DM组给予高脂高糖饲料,喂养4周,禁食不禁水16 h后,T2DM组按30 mg/kg腹腔注射STZ(STZ溶于0.1 mol/L的pH 4.5的柠檬酸钠缓冲液中,配成1%溶液,现配现用,30 min内用完)以诱发T2DM;空白对照组仅注射等量的柠檬酸钠缓冲液。72 h后,在大鼠尾静脉采血,用血糖仪检测血糖浓度,凡空腹血糖浓度≥16.7 mmol/L、HOMA-IR增加伴尿量及饮水量均明显增多的大鼠作为T2DM成模标准。模型成立后,将T2DM组40只大鼠随机分为造模后3个月组、造模后4个月组、造模后5个月组及造模后6个月组,每组10只。
1.2.2模型的观察指标:注射STZ后,每天观察并记录大鼠的一般状况,主要包括精神状态、毛发颜色、运动情况、摄食量、饮水量、垫料潮湿程度等,并及时更换尿湿的垫料;每周测量各组大鼠的体质量、随机血糖、空腹血糖及空腹血清胰岛素(FINS)指标,比较各组的体质量变化及血糖值变化并计算分析HOMA-IR(=空腹血糖×FINS/22.5)。
1.2.3FFA检查:大鼠T2DM造模后3个月、4个月、5个月及6个月进行FFA检查。所有大鼠腹腔注射2%戊巴比妥钠50 mg/kg进行麻醉,双眼滴复方托吡卡胺散瞳,将大鼠麻醉、散瞳后移至荧光造影机前,按0.5 mL/kg向腹腔注射10%荧光素钠,注射后即开始摄影,主要以视盘为正中心拍摄中心图。另外,根据实际情况可拍摄上、下、左、右的视网膜情况。
1.2.4苏木素-伊红(HE)染色:分别于T2DM造模后3个月、4个月、5个月及6个月FFA检查完毕后颈椎脱臼处死大鼠,迅速摘除眼球,眼球固定液固定,石蜡包埋后切片,切片时定位到靠近视神经完整的视网膜进行纵切,使切片之间具可比性,HE染色,光学显微镜观察并拍照。

2 结果
2.1 一般情况观察
空白对照组大鼠精神状态良好,毛发柔顺光滑,活泼好动,每日摄食量和饮水量适中,垫料干燥;T2DM组大鼠STZ腹腔注射后第1周,大鼠表现出多食、多饮、多尿及体质量减轻的糖尿病症状,随着病程延长,大鼠逐渐表现出精神萎靡,毛发杂乱枯黄、易脱毛,倦怠懒动,每日的饮食、饮水及尿量明显增多,垫料潮湿并伴烂苹果味。随时间增加,上述症状愈加明显,伴体型极度消瘦萎靡、皮包骨样、弓背蜷缩且状态不佳。
2.2 体质量及血糖变化
造模前,空白对照组与T2DM组大鼠体质量和血糖差异无显著性(P>0.05);造模后,空白对照组大鼠体质量稳定增加,T2DM组大鼠体质量增加不明显且随着时间的延长伴有不同程度的减轻。T2DM造模后3个月、4个月、5个月及6个月时大鼠体质量明显减轻,与空白对照组比较差异极显著(P<0.01);血糖显著升高,与空白对照组比较差异极显著(P<0.01),见图1和图2所示。

图1 不同病程各组大鼠体质量变化趋势
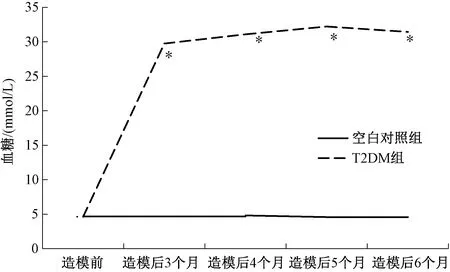
图2 不同病程各组大鼠血糖变化趋势
2.3 HOMA-IR比较
造模前,空白对照组和T2DM组大鼠FINS和HOMA-IR差异无显著性(P>0.05);造模后,T2DM组FINS和HOMA-IR较空白对照组显著升高,经统计学处理后差异极显著(P<0.01)。造模后,FINS和HOMA-IR之所以升高,考虑原因是高脂高糖饲料喂养联合小剂量STZ注射只是部分破坏了大鼠胰岛B细胞功能,说明此种造模方法已经成功复制出了大鼠胰岛素抵抗模型,即T2DM模型(表1)。
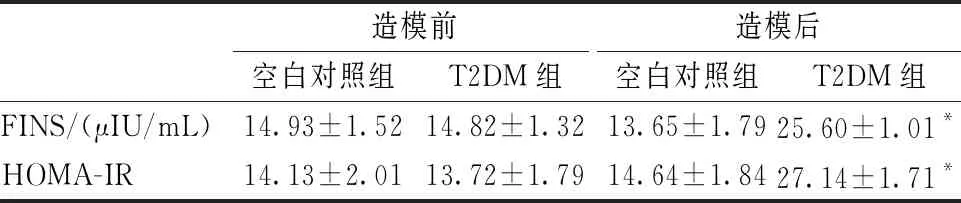
表1 造模前后两组大鼠FINS和HOMA-IR比较
2.4 FFA检查情况
空白对照组大鼠眼底清晰且视网膜血管走行规则、粗细均匀一致并以视盘为中心呈放射状分布;T2DM组:3个月大鼠眼底尚清晰、视网膜血管走行迂曲、可见微动脉瘤及少量点状强荧光;4个月大鼠视网膜血管不规则扩张、并可见毛细血管丛及大面积强荧光渗漏;5个月大鼠眼底模糊、血管周围可见荧光渗漏及片状出血;6个月大鼠因晶体混浊眼底窥不清、隐见血管走行迂曲且血管周围可见荧光渗漏及出血(图3)。
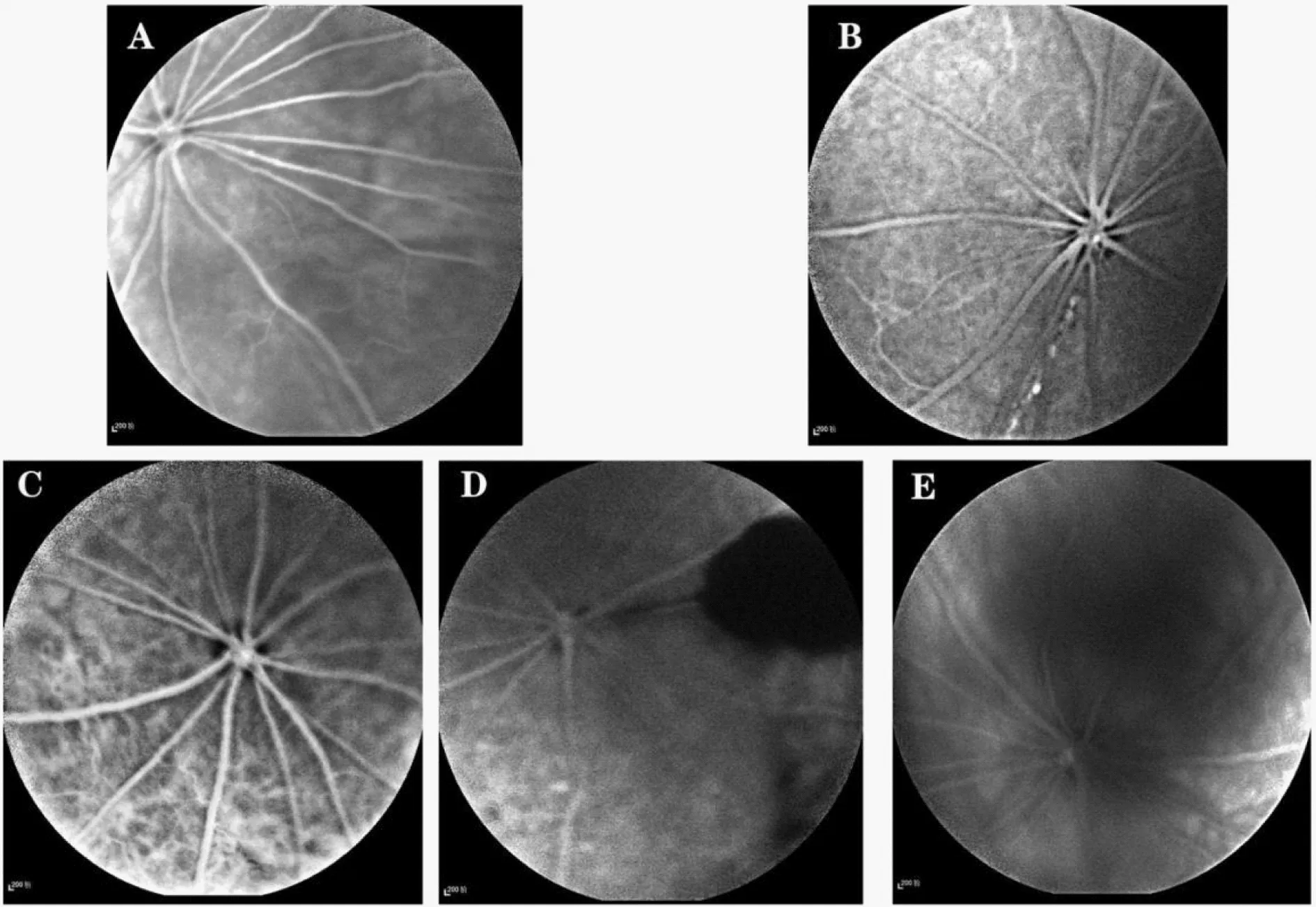
图3 不同病程各组大鼠FFA结果
2.5 HE染色
空白对照组大鼠视网膜各层结构完整且排列整齐、细胞形态正常、内界膜清晰可见,神经节细胞单层排列,内核层由3~5层细胞构成,外核层较厚,由8~10层细胞排列而成;T2DM组3个月大鼠,各层细胞排列紊乱,神经节细胞层可见扩张的血管(×200),内外核层细胞数量减少,排列稀疏;T2DM组4个月大鼠,各层细胞排列紊乱且界限不清,神经节细胞层可见血管样结构,视网膜神经节细胞层及内、外核层水肿;T2DM组5个月大鼠,神经节细胞水肿,可见突破内外丛状层的血管样结构,神经节细胞数量减少,内外核层界限不清、细胞稀疏、排列紊乱、出现空泡样变和异常血管样结构;T2DM组6个月大鼠,神经节细胞进一步减少,内外核层间界限消失,结构紊乱甚至中断,细胞排列杂乱无章,神经节细胞层和内外核层空泡样变性明显,可见大量穿行于内外核层的迂曲血管,见图4所示。

图4 不同病程各组大鼠视网膜HE
3 讨论
DR作为T2DM严重的微血管并发症,可导致视力永久性丧失[5],而该病的患病率也在逐年增加,据估计到2040年全球约有6.24亿人患有糖尿病[6],其中T2DM占糖尿病总数的90%~95%[7]。临床研究表明,DR的发病与T2DM的病程和血糖水平直接相关[8],因此建立理想的T2DM动物模型是研究DR的重要基础。
根据林春华等[9],T2DM动物模型按造模方式主要分为三类:自发性T2DM动物模型、诱导性T2DM动物模型和转基因T2DM动物模型,但是自发性和转基因T2DM动物因价格昂贵、来源相对较少等缺点,限制其在科学研究方面的应用和普及,而实验性T2DM动物模型则因为成本较低、操作简便、重复性高等优点,应用最为广泛。建立T2DM动物模型常用的实验方法包括手术诱导、饮食诱导、药物诱导、联合诱导等,其中因联合诱导(高脂高糖饮食联合小剂量STZ)的T2DM大鼠能较好的模拟T2DM的发病因素、病理过程和临床特征,并且造模时间相对较短,成本相对较低,而成为该病的理想造模方法[10-11]。高脂高糖饮食可通过降低实验动物的胰岛素敏感性,使机体糖耐量降低从而诱发胰岛素抵抗[12]。STZ是一种广谱抗菌素,对动物胰岛B细胞具有特异性的毒性作用,它会选择性损伤胰岛B细胞,导致胰岛素分泌减少[13],而胰岛素抵抗和胰岛功能受损是T2DM的典型病理生理特征和重要依据[14]。Gheibi等[15]以高脂喂养大鼠2周后,单次腹腔注射STZ 30 mg/kg 建立T2DM模型;Gomaa等[16]以高脂喂养大鼠4周后单次腹腔注射STZ 25 mg/kg建立T2DM模型。因此,结合上述文献报道和预实验结果,本研究改进实验方法,采用高糖高脂饮食喂养4周联合小剂量STZ 30 mg/kg腹腔注射建立T2DM大鼠模型,大鼠模型血糖维持较好,且在长达6个月的实验周期内无一死亡。
虽然有大量的物种被用于制作DR模型,比如小鼠、大鼠、猫、狗、猪和非人灵长类动物,但大鼠模型仍是最常被研究的,因为它们体积适中、寿命短且繁殖速度快,可以进行最有效的研究[17]。目前,国内DR模型常用的大鼠品系是SD大鼠或者Wistar大鼠。章成昌等[18]选用Wistar大鼠,因为Wistar大鼠不仅有SD大鼠的优良基因,且比SD大鼠更温顺,有利于实验操作的进行和实验数据的采集,但是农慧等[19]用相同剂量的STZ造模,发现Wistar大鼠的死亡率可以达到50%以上,可见SD大鼠的抵抗力强于Wistar大鼠。由于本实验周期长,对大鼠的生存能力要求较高,故选用SD大鼠。
庄秋霞等[20]和姜晓丹等[21]研究表明,FFA是临床上诊断DR时最常采用的一种方法,它可以通过动态反映视网膜毛细血管的实时循环情况从而实现DR的早期诊断和分期,即使是微小病变也能准确捕捉,而目前DR大鼠模型验证方面恰恰缺乏这部分内容。以往国内针对DR大鼠视网膜的观察主要在离体眼球上进行[22-24],但这些方法较为局限,因为无法在活体上动态观察眼底改变,它意味着必须先处死大鼠才能观察到视网膜,因此大鼠使用量较大,不符合3R操作原则。鉴于此,本研究结合FFA和HE染色,在活体动态监测T2DM大鼠视网膜出现病变的基础上,再处死大鼠进行视网膜组织病理学改变的观察,研究方法的改进在符合动物伦理学要求的原则下更加全面的模拟T2DM的DR大鼠模型。由于条件所限,本研究对大鼠行FFA检查时,使用为人眼设计的海德堡血管造影机,但人眼球的参数与大鼠眼球参数存在明显区别,这种差异导致需要耗费大量时间调整动物眼位才能获得FFA图像。若能改进技术,可以调整适应大鼠的眼球参数,便能更加简便地获得DR大鼠FFA图片。同时在研究过程中,随着T2DM大鼠病程的延长,尤其至6个月时,大鼠普遍发生白内障,严重的晶状体混浊导致FFA不能评估视网膜血管的变化并无法获得清晰的FFA图片。如果研究初期,能同时结合光学相干断层扫描(optical coherence tomography,OCT)、FFA和HE技术,不仅能对补后期难以进行的FFA问题,还有助于活体上观察T2DM大鼠视网膜厚度的动态变化,从而可以进一步与HE结果对比分析,这无疑对研究DR模型具有更重要的意义。
总之,本研究通过高脂高糖饲料喂养4周联合30 mg/kg STZ腹腔注射建立的T2DM大鼠模型,并应用FFA和病理学技术动态监测到T2DM大鼠在病程3个月时观察到视网膜血管发生的病变,同时也观察到DR的病理形态学改变。随着病程延长,病变也在逐渐加重。因此,该模型的成功建立以及病变的验证方法可以被进一步用于研究T2DM的DR发病机制及对新型抗DR药物的评估。

