肝细胞癌患者根治性切除术后的生存影响因素分析
吕欣建 杨明正 谷昱颖 张捍博 丁璐 陈清梅 邓阳
原发性肝癌是全球内常见的恶性肿瘤,2021年全球癌症数据显示,原发性肝癌新发病例约90.6万例,死亡病例约83.0万例[1]。其中肝细胞癌(hepatocellular carcinoma,HCC)是原发性肝癌的主要类型,约占全部病例的75%~85%[2]。近年来肝癌诊疗技术不断进步,以手术切除为主的综合治疗策略也在很大程度上使HCC患者术后5年累积生存率和无复发生存率显著提高,但是术后复发率仍高达60%~70%,术后复发也成为患者预后不良的主要原因[3-4]。既往研究显示,影响HCC患者术后预后的因素往往是复杂、多样的,因此患者预后也呈现较大差异性。有研究报道针对影响因素采取干预措施可有效降低HCC患者术后复发率和死亡率,改善患者预后[5]。本研究通过分析1 744例HCC患者术后生存状况并探讨其影响因素,以期为临床上制定术后治疗策略及评估预后提供依据。
1 对象与方法
1.1 研究对象
选择2008年1月至2017年7月于山东第一医科大学第二附属医院及山东大学第二医院行根治性肝切除术的1 744例HCC患者作为研究对象。纳入标准:⑴经病理证实为HCC;⑵首次发病,且术前未接受任何抗肿瘤治疗;⑶无淋巴结转移和远处转移;⑷术后常规随访,临床及随访资料完整。排除标准:⑴失代偿期肝硬化或Child-Pugh C级;⑵合并其他恶性肿瘤;⑶合并心血管疾病和呼吸系统疾病。本研究获山东第一医科大学(山东省医学科学院)伦理委员会批准(审批号:201910271)。
1.2 临床资料收集及随访
通过医院电子病历系统回顾性收集以下资料:⑴一般人口学资料,包括年龄、性别等;⑵术前临床生化免疫检查指标,包括总胆红素(total bilirubin,TBIL)、白蛋白(albumin,ALB)、血小板与淋巴细胞比值(platelet to lymphocyte ratio,PLR)、中性粒细胞与淋巴细胞比值(neutrophil to lymphocyte ratio,NLR)、甲胎蛋白(alpha-fetoprotein,AFP)水平、乙肝病毒(hepatitis B virus,HBV)感染情况、HBV DNA含量等;⑶肿瘤相关信息,包括肝硬化程度、Child-Pugh分级、巴塞罗那(Barcelona clinic liver cancer,BCLC)分期、微血管侵犯(microvascular invasion,MVI)情况、肿瘤包膜完整性、肿瘤大小、病灶数目、门静脉高压症;⑷术后接受肝动脉化疗栓塞(transcatheter arterial chemoembolization,TACE)情况。
通过电话或门诊复查进行随访,术后半年内每月随访1次,术后6~12个月每3个月随访1次,1年后每6个月随访1次,随访截至2019年6月30日。以患者因HCC死亡为终点事件,失访、因其他疾病死亡或随访结束仍存活则为截尾事件。以总生存期(overall survival,OS)作为预后指标,OS定义为从手术当日起至患者死亡或末次随访的时间。
1.3 统计学方法
利用SPSS 21.0软件进行统计学分析。计量资料以均数±标准差()表示,计数资料以n(%)表示。通过受试者工作特征曲线确定NLR和PLR的最佳临界值。应用Kaplan-Meier法计算生存率,并绘制生存曲线。采用Cox回归对影响患者术后预后的因素进行单因素分析,将单因素分析中有统计学意义的因素及临床专业判断有意义的因素如AFP、肿瘤大小、肿瘤包膜完整性、MVI等[6-7]纳入多因素分析。利用R 4.1.1软件survminer软件包进行多因素Cox回归分析并使用森林图进行可视化展示[8]。以双侧P<0.05为差异有统计学意义。
2 结果
2.1 研究对象基线特征及生存情况
1 744例HCC患者平均年龄为(54.28±11.44)岁;男性1 513例,占86.8%;HBV感染1 498例,占85.9%;BCLC分期B/C期1 050例,占60.2%。患者基线资料见表1。HCC患者术后中位OS为24.98个月,1、3、5年总生存率分别为73.5%、51.0%、22.2%。生存情况见图1。
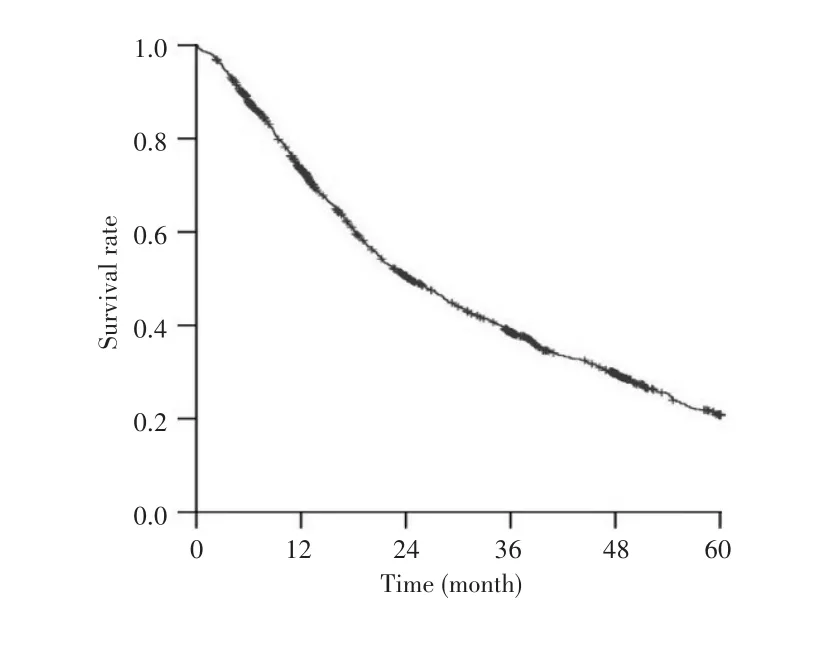
图1 1 744例HCC患者术后的生存曲线Fig.1 Survival curve of 1,744 HCC patients after radical hepatectomy

表1 1 744例HCC患者的基线资料[n(%)]Tab.1 Baseline characteristics of 1,744 HCC patients[n(%)]
2.2 影响HCC患者术后生存的单因素Cox分析
单因素Cox回归分析结果显示,年龄≥60岁、男性、HBV DNA≥500 copies/mL、AFP≥400 ng/mL、NLR≥3.3、PLR≥117、BCLC B/C期、MVI、肿瘤包膜完整、肿瘤大小≥5 cm、多发病灶和术后行TACE与HCC患者术后生存相关(均P<0.05)。而HBV感染、肝硬化、TBIL≥20 μmol/L、ALB≥35 g/L、门静脉高压症和Child-Pugh B级与HCC患者术后生存无关(均P>0.05)。见表2。

表2 1 744例HCC患者术后生存的单因素Cox分析Tab.2 Univariable Cox analysis on the survival of 1,744 HCC patients after radical hepatectomy
2.3 影响HCC患者术后生存的多因素Cox分析
多因素Cox分析结果显示,男性(HR=1.242,95%CI:1.027~1.502,P=0.026)、HBV DNA≥500 copies/mL(HR=1.265,95%CI:1.117~1.432,P<0.001)、AFP≥400 ng/mL(HR=1.597,95%CI:1.384~1.842,P<0.001)、NLR≥3.3(HR=1.288,95%CI:1.090~1.522,P=0.003)、微血管侵犯(HR=1.548,95%CI:1.364~1.757,P<0.001)、肿瘤大小≥5 cm(HR=1.944,95%CI:1.500~2.519,P<0.001)、多发病灶(HR=1.422,95%CI:1.227~1.647,P<0.001)、BCLCB/C期(HR=1.734,95%CI:1.265~2.218,P<0.001)是影响HCC术后OS的独立危险因素,而肿瘤包膜完整(HR=0.673,95%CI:0.581~0.778,P<0.001)和术后行TACE(HR=0.652,95%CI:0.559~0.762,P<0.001)是影响HCC术后OS的独立保护因素,见图2。

图2 影响HCC患者术后生存的多因素Cox分析Fig.2 Multivariable Cox analysis on factors influencing the survival of HCC patients after radical hepatectomy
3 讨论
目前随着对HCC致病机制和治疗靶点研究的深入,手术虽然仍然是HCC患者尤其是早期患者首选的治疗方法,但是HCC的治疗有了更多的选择,如介入治疗、免疫治疗、靶向治疗等,这对延长患者的生存时间及改善生存质量具有积极意义。然而,肝癌患者术后5年生存率仍不超过40%[9],其中术后复发率高是导致HCC患者术后生存率低及生存质量不良的主要原因[10-11]。本研究纳入的1 744例HCC患者中,术后1、3、5年生存率分别为73.5%、51.0%、22.2%,5年生存情况与之相当。因此,如何解决及应对术后复发问题也成为该领域学者的关注热点之一。既往已有不少研究关注HCC术后预后影响因素,以期通过相应干预而解决术后复发问题。但是由于目前尚无统一的HCC预后影响因素评估标准,加之不同研究者纳入的检测指标及研究侧重点不尽相同,因此各研究中得出的预后因素往往差异较大。如关于年龄,有研究发现高龄(>53岁)是影响肝切除术后患者生存的独立危险因素[12],但也有研究认为年龄对HCC患者术后生存无显著影响[13]。本研究中多因素Cox分析结果也提示年龄不是影响HCC术后生存的独立危险因素,考虑上述差异可能是由于不同研究中年龄的分类截断值不一致造成。
在性别方面,本研究发现其与HCC患者的术后生存状况密切相关,其中男性的总体OS较女性短。王琦等[14]等研究观察性别对肝癌微创介入治疗预后的影响,结果也发现男性HCC患者术后OS较女性差,且主要与男性患者肝细胞损伤及肝硬化程度较高,而肝功能代偿能力较弱有关;也与男性患者雄激素受体(androgen receptor,AR)阳性率较高有关,因为当雄激素与AR特异性结合后,可以通过AR介导而促进肝癌细胞生长,并增强对周围肝组织的侵袭能力。此外,由个体遗传背景造成的性别免疫差异也提示男性先天性或适应性免疫反应更弱[15]。但是性别在HCC患者预后中的具体作用机制仍需深入探索。
本研究还发现术前临床生化免疫检查指标如HBV DNA≥500 copies/mL、AFP≥400 ng/mL、NLR≥3.3等也是影响HCC患者术后生存的独立危险因素。在既往研究中,术前HBV DNA载量已被证实可作为预测HCC术后复发指标,术后血清高HBV DNA载量通常与预后不良呈正相关[16]。还有研究报道,手术切除诱发的免疫抑制可增加HBV再激活的发生风险,而HBV再激活会损伤肝功能,加速肝硬化进展,并最终引起HCC复发[17]。在HBV相关HCC患者中,术后接受抗病毒治疗可通过抑制HBV再激活而减轻残肝炎症水平,从而逆转肝硬化和肝功能障碍[18]。AFP是目前临床上诊断HCC最常用的特异性肿瘤标志物。既往研究证实AFP可在多种HCC细胞系或动物模型中促进细胞增殖、运动、侵袭性生长和肿瘤细胞转移[19]。炎症反应通过促进血管生成、抑制细胞凋亡、诱发DNA损伤等机制在HCC发生发展中发挥重要作用[20]。HCC患者NLR值上升也会导致较差的临床预后,因此NLR值可作为评估预后不良稳定且独立的指标[6]。本研究也显示了同样的现象,且当患者的NLR≥3.3时表现为更差的生存状况。但是值得注意的是,目前最佳的NLR截断值尚未明确,有待进一步深入研究。
在本研究中,BCLC B/C期、微血管侵犯、肿瘤大小≥5 m、多发病灶等肿瘤相关信息也预示HCC患者术后预后不良。其中BCLC B/C期患者肝功能严重损伤,实施切除术时手术范围较大,术中容易出现大出血或肝功能衰竭等,术后残肝负担加重,并发症较多,因此预后也较差[21]。发生微血管侵犯的HCC患者,易造成微血管癌栓并通过血管向周边播散,从而在瘤体周边形成卫星灶,进而侵犯包膜。此外,微血管侵犯还与AFP水平、卫星灶数目呈正相关,从而导致预后不良[22]。在HCC患者中当肿瘤大小≥5 cm时属于大肝癌,一方面瘤体越大越容易受压破裂,从而发生腹腔转移;另一方面大肝癌手术时间较长,同时游离较大肝肿物时,发生肿瘤破裂、肝脏血管破裂出血、肝内转移、腹腔转移等并发症的概率增加,也更容易造成患者预后不良[22]。伴多发病灶的HCC患者,发生肝内转移的概率也往往较高,同时手术时难以完全清除肉眼不能分辨的转移灶,因此也更容易出现近期复发,导致较短的生存期。此外,本研究还发现肿瘤包膜完整和术后行TACE治疗是HCC术后生存的独立保护因素。肿瘤包膜是一种很好机械屏障,能阻碍肿瘤向周边组织浸润;术后行TACE治疗能使肿瘤组织血管阻塞和坏死,进一步消除潜在及术中未发现的微小病灶,从而遏制肿瘤多中心生长,延长患者术后生存期。
综上所述,男性、HBV DNA≥500 copies/mL、AFP≥400 ng/mL、NLR≥3.3、BCLC B/C期、微血管侵犯、肿瘤大小≥5 cm、多发病灶是影响HCC患者术后生存的独立危险因素,而肿瘤包膜完整和术后行TACE则是独立的保护因素,因此在制定HCC诊疗方案及判断预后时应充分考虑上述因素并对患者进行分层,从而实施差异化治疗策略,使患者获得更好的预后和生存结局。

