miR-145-5p靶向调控LOX基因对肝癌细胞侵袭和迁移的影响
邢婉婷 徐静轩 齐鲁楠
肝癌是全球第六大最常被诊断的癌症,死亡率位居第四[1]。手术切除是肝癌的主要治疗方法,然而术后复发率依然较高,而高复发率也是制约肝癌患者预后的主要原因。microRNA(miRNAs/miR)是长度为17~25个核苷酸的高度保守的非编码小RNA[2]。既往研究显示,miRNAs异常表达可通过mRNA降解和翻译抑制参与调控基因表达、细胞分化、细胞增殖以及恶性肿瘤的侵袭和转移等[3]。miRNA在肝癌中的作用也引起广泛关注,miR-145-5p作为miRNA家族中重要的一员,目前也被发现在多种类型肿瘤中具有抗肿瘤作用,包括肝细胞癌[4-6]。但miR-145-5p在肝癌中确切的作用及其机制仍不明确。赖氨酰氧化酶(lysyl oxidase,LOX)是一种分泌的铜依赖性单胺氧化酶,可对细胞外基质(extracellular matrix,ECM)中可溶性胶原和弹性蛋白交联的关键酶步骤进行催化[7-8]。近年来越来越多的证据表明LOX在肝癌发病机制中起着关键作用。在肝癌组织中LOX呈高表达,且LOX过表达能导致上皮细胞-间充质转化(EMT),并与肝癌患者的高早期复发率和低总生存率相关[9-10]。还有研究报道,在富含肿瘤起始细胞的肝癌中,LOX过表达能通过增加血管内皮生长因子(VEGF)和增强内皮细胞的成管能力而部分激活血管生成[11]。因此,推测miR-145-5p可能通过靶向调控上游靶基因LOX而影响肝癌进展。为此,本研究通过在肝癌细胞系SMMC-7721、SK-Hep1中探讨miR-145-5p和LOX在肝癌细胞侵袭和迁移中的作用及其靶向调控机制,以期为靶向基因治疗肝癌提供新思路。
1 材料与方法
1.1 临床标本、细胞系及主要试剂
收集2017年9月至2019年9月于广西医科大学附属肿瘤医院肝胆外科手术切除的73例肝癌患者肿瘤组织及其相应配对的邻近正常组织样本,所有肿瘤组织标本均经病理学证实为肝癌,并将切除的样本立即置于-80℃冰箱中备用。本研究方案经广西医科大学附属肿瘤医院伦理委员会批准,患者均提供书面知情同意书。
人肝癌细胞系SMMC-7721购自上海生命科学院细胞库,人肝癌细胞系SK-Hep1购自上海中乔新舟生物科技有限公司。miR-145-5p慢病毒载体、LOX过表达质粒、LOX慢病毒沉默载体均由吉凯基因科技有限公司(中国上海)提供。重组Anti-LOX抗体购自英国ABCAM公司,Anti-GAPDH抗体购自北京索莱宝科技有限公司。RNA提取试剂盒Total RNA Kit购自美国OMEGA公司;逆转录试剂盒、microRNA反转录试剂盒、PCR检测试剂盒、Takara microRNA TB Green mix均购自日本Takara公司;SDS PAGE凝胶配制试剂盒、ECL化学发光试剂盒购自北京索莱宝科技有限公司;Matrigel胶购自美国BD公司;SYBGreen染料购自德国Roche公司;LipofectamineTM3000转染试剂购自美国Invitrogen公司;Opti-MEM无血清培养基、胰酶、青霉素双抗购自上海碧云天生物技术有限公司;胎牛血清(FBS)购自美国Gibco公司。
1.2 细胞培养及转染
1.2.1 细胞培养 人肝癌细胞SMMC-7721、SK-Hep1均培养于含10% FBS的完全培养基中,置于37℃、5% CO2饱和湿度条件下培养。待细胞贴壁生长至整个培养瓶底面积的80%~90%时进行传代。
1.2.2 质粒瞬时转染 取对数生长期SMMC-7721细胞,以1×106/mL浓度接种于6孔板中。根据LipofectamineTM3000试剂盒说明书分别转染LOX过表达质粒(pBABE组)以及空白载体(pBABE-NC组),以不做任何处理的细胞作为空白对照组(Control组)。
1.2.3 慢病毒载体转染 参考吉凯基因的慢病毒使用手册进行实验操作。取对数生长期SK-Hep1细胞,以5×104/mL浓度接种于6孔板中。实验分组:将LOX沉默慢病毒转染SK-Hep1细胞,记作sh组;转染空白载体记作sh-NC组,以不做任何处理的细胞作为空白对照组(Control组)。另外分别将miR-145-5p mimics(mimics组)、mimics control(NC组)转染SK-Hep1细胞。取对数生长期细胞SMMC-7721,以1×106/mL浓度接种于6孔板中,分别将miR-145-5p mimics(mimics组)、miR-145-5p inhibitor(inhibitor组)及其相应空白载体转染至SMMC-7721细胞,同时设相应空白对照组。
1.2.4 共转染 分别将miR-145-5p mimics(mimics组)、mimics control(NC组)以及LOX过表达质粒+miR-145-5p mimics(共转染组)转染至SMMC-7721细胞,并按照LipofectamineTM3000试剂盒说明书进行转染。
1.3 qRT-PCR检测LOX和miR-145-5p表达水平
1.3.1 miRNA逆转录及qRT-PCR检测 参照说明书操作步骤提取各组组织中的总RNA。按照Takara microRNA反转录试剂盒说明书步骤操作合成cDNA,加A尾和RT反应一步完成。按照Takara microRNA TB Green mix说明书进行反应。PCR反应条件:95℃变性10 min,60 ℃退火30 s、72 ℃延伸40 min,共40个循环。引物序列:miR-145-5p加尾法设计,CAGTTTTCCCAGGAATCCCTAA;U6作为内参由Takara microRNA反转录试剂盒提供。用2-△△Ct法计算miR-145-5p相对表达量。
1.3.2 LOX逆转录及PCR检测 按照Takara逆转录试剂盒说明书操作合成cDNA。荧光定量反应体系20 μL,其中 SYBGreen 10 μL,Forward primer 0.6 μL,Reverse primer 0.6 μL,cDNA 模板 2 μL,无酶水加至 20 μL。PCR反应条件:95℃ 10 min,95℃ 15 s,60℃ 60 s共扩增40个循环。引物序列:LOX(F)TTCTTACCCAGCCGACCAAGATA,(R)GTGTTGGCATCAAGCAGGTCA;β-Actin(F)CTGGAACGGTGAAGGTGA-CA,(R)CGGCCACATTGTGAACTTTG。用2-△△Ct法计算LOX相对表达量。
1.4 Western blot检测LOX表达水平
取转染后的各组细胞,加入蛋白裂解液,4℃下以12 000 r/min离心,提取总蛋白,用BCA试剂盒检测蛋白质浓度,用10%SDS-PAGE分离,然后转移至PVDF膜上。用TBST缓冲液漂洗后,室温封闭15 min。加入LOX抗体按1∶300稀释作为一抗,4℃孵育过夜。次日将PVDF膜置于1∶2 500稀释的GAPDH抗体中,室温下孵育3 h。然后采用ECL化学发光试剂盒观察蛋白条带。实验重复3次。
1.5 Transwell小室实验检测肝癌细胞迁移和侵袭能力
迁移实验:用纯DMEM培养基重悬各组细胞(密度为500/μL)。将100 μL细胞悬液接种至24孔板Transwell小室上室中,下室加入含10%FBS的600 μL完全培养基作为趋化剂。每组细胞重复2个孔,做好标记,密封条包好后在37℃、5% CO2潮湿环境的细胞培养箱中继续培养。16 h后取出,用1 mL甲醇固定30 min,0.5 mL 0.1%结晶紫染色20 min,在倒置显微镜下观察并拍照,计数5个视野细胞数。实验重复3次。侵袭实验中预先将Matrigel基质胶和DMEM培养基按照1∶8比例稀释并包被Transwell小室上室,待其凝固后,接种细胞悬液。除培养时间调整为36 h外,其余操作同迁移实验。
1.6 miR-145-5p靶基因预测及其功能分析
通过生物信息学技术TargetScan(http://www.targetscan.org/vert_72/)对差异表达的miR-145-5p的可能靶基因进行预测,利用Cluster Profiler包对预测的差异表达miR-145-5p靶基因交集进行GO功能注释和KEGG通路分析。其中GO功能注释富集分析包括生物过程(biological process,BP)、细胞组分(cellular component,CC)、分子功能(molecular function,MF)三个方面。对miR-145-5p可能的靶基因在以上三方面的富集结果按照从大到小排序,用GraphPad Prism 5.0绘制GO富集分析,R软件4.0.2绘制KEGG生物通路富集分析结果的气泡图,采用Benjamini-Hochberg法矫正P值。
1.7 统计学方法
采用SPSS 22.0和GraphPad Prism 8.0对数据进行分析。计量资料以均数±标准差表示,两组均数比较采用独立样本t检验,多组均数比较采用单因素方差分析,若组间差异有统计学意义,采用Bonferroni检验进行多重比较。以双侧P<0.05为差异有统计学意义。
2 结果
2.1 miR-145-5p和LOX在肝癌组织中的表达
qRT-PCR检测结果显示,miR-145-5p在癌旁正常组织中的表达高于肝癌组织(4.196±2.288 vs 2.835±1.817,P<0.0001),见图1A;LOX在肝癌组织中的表达高于癌旁组织(12.17±1.369 vs 11.26±1.556,P<0.001),见图1B。
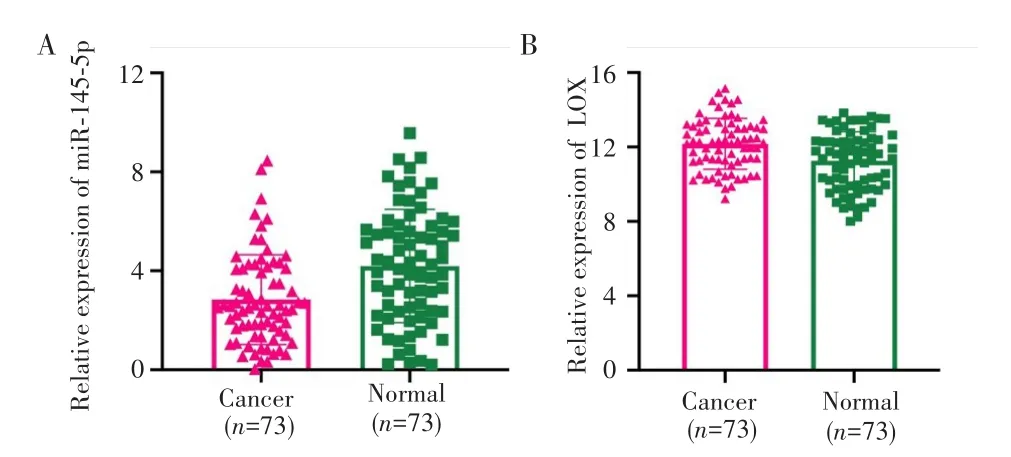
图1 miR-145-5p和LOX在肝癌组织及其癌旁正常组织中的表达Fig.1 Expression of miR-145-5p and LOX in liver cancer tissues and adjacent normal tissues
2.2 LOX对肝癌细胞迁移和侵袭能力的影响
用Transwell小室实验分别检测过表达LOX对SMMC-7721细胞侵袭、迁移能力的影响,及沉默LOX对SK-Hep1细胞侵袭、迁移能力的影响,结果显示,与Control组和pBABE-NC组比较,pBABE组中SMMC-7721细胞侵袭和迁移个数增加(P=0.011,P<0.001),见图2A、C;与Control组和sh-NC组比较,沉默LOX组(sh组)SK-Hep1细胞侵袭和迁移个数明显减少(均P<0.001),见图2B、D。说明敲低LOX能抑制肝癌细胞的侵袭、迁移能力,过表达LOX增强肝癌细胞侵袭、迁移能力。

图2 过表达和沉默LOX对肝癌细胞迁移和侵袭能力的影响Fig.2 Effects of overexpression and silencing of LOX on migration and invasion of liver cancer cells
2.3 miR-145-5p对肝癌细胞迁移和侵袭能力的影响
Transwell小室实验检测结果显示,与NC组和Control组比较,转染miR-145-5p mimics的SK-Hep1细胞侵袭和迁移细胞个数均减少(均P<0.001),见图3A;与NC和Control组比较,转染 miR-145-5p inhibitor组的SMMC-7721细胞侵袭和迁移细胞个数均明显增加(均P<0.001),见图3B。说明过表达miR-145-5p抑制了肝癌细胞SK-Hep1的侵袭和迁移能力,沉默miR-145-5p则促进了肝癌细SMMC-7721的侵袭和迁移能力。
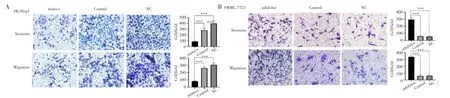
图3 过表达和沉默miR-145-5p对肝癌细胞迁移和侵袭能力的影响Fig.3 Effects of overexpression and silencing of miR-145-5p on migration and invasion of liver cancer cells
2.4 LOX能逆转miR-145-5p抑制的肝癌细胞侵袭和迁移
TargetScan 7.0数据库分析显示,LOX基因的3'-UTR区与miR-145-5p存在结合位点,见图4A。Western blot检测结果显示,与NC组相比,转染miR-145-5p mimics的SMMC-7721细胞中LOX的表达水平降低(P<0.001),而转染miR-145-5p inhibitor能明显升高LOX的蛋白表达水平(P<0.001),见图4B;与mimics组比较,共转染组SMMC-7721细胞中LOX蛋白表达水平显著增加(P<0.001),见图4C。Transwell小室实验检测结果显示,与mimics组比较,共转染组中SMMC-7721细胞迁移和侵袭数目均增加(P<0.001),见图4D~E。说明miR-145-5p能抑制LOX蛋白表达水平,LOX过表达逆转了miR-145-5p对SMMC-7721细胞迁移和侵袭的抑制能力。

图4 LOX过表达可逆转miR-145-5p对SMMC-7721细胞侵袭和迁移的抑制能力Fig.4 Overexpression of LOX reversed the inhibitory ability of miR-145-5p on migration and invasion of SMMC-7721 cells
2.5 miR-145-5p的靶基因功能分析
用TargetScan获取miR-145-5p所有靶基因,再用Cluster Profiler包进行GO功能注释富集分析,分别从生物过程、细胞组分、分子功能三方面进行GO功能注释富集分析(图5A)并按照大小排序,结果显示,miR-145-5p靶基因与小GTP酶结合、Ras GTP酶结合、蛋白丝氨酸/苏氨酸激酶活性、GTP酶调节活性、核苷三磷酸酶调节活性、肌动蛋白结合酶激活剂活性、肌动蛋白丝结合、蛋白酪氨酸激酶活性等紧密相关。细胞组分富集分析显示miR-145-5p的靶基因与细胞前缘、黏着斑、细胞-基底连接、细胞-细胞连接、突触后特化作用、突触后密度、不对称突触、神经元间突触、谷氨酸能突触、细胞皮层等有关。生物过程富集分析发现miR-145-5p靶基因参与GTPase活性调节、GTPase活性正性调节、细胞连接组件、细胞形态发生调控、轴突生成、胚胎器官发育、阿米巴型细胞迁移以及细胞-基质黏附等过程。
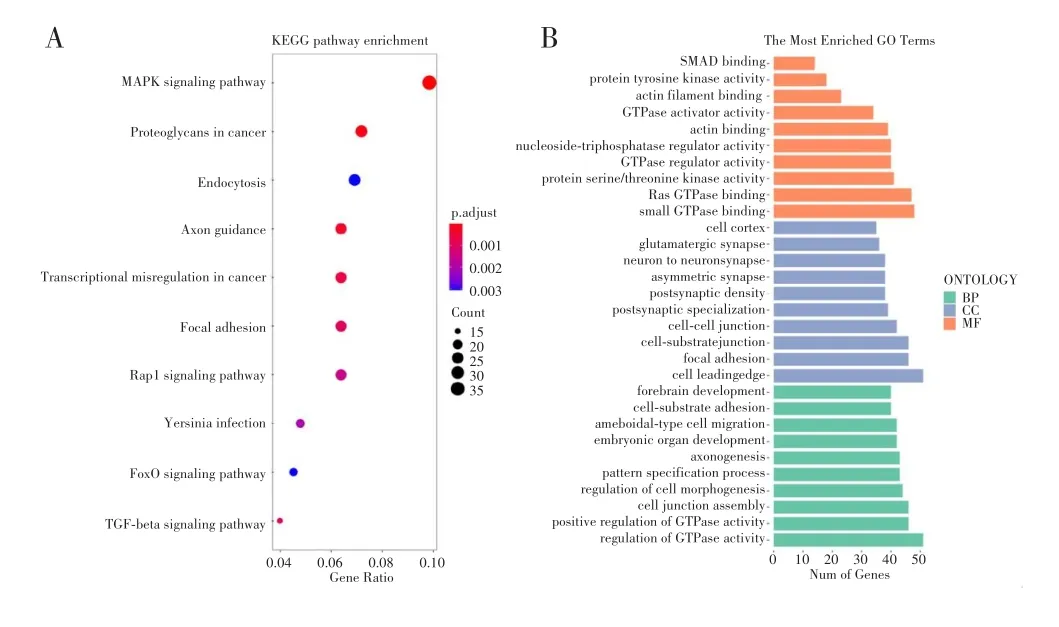
图5 miR-145-5p靶基因的GO和KEGG富集分析结果Fig.5GO and KEGG enrichment analysis of miR-145-5p target genes
使用Cluster Profiler包对预测的miR-145-5p靶基因集合进行KEGG生物通路富集分析,对miR-145-5p靶基因富集的通路进行排序汇总,其中位于前10的参与信号通路包括MAPK信号通路、癌症中的蛋白聚糖、(细胞)内吞作用、轴突导向、癌症中的转录失调、黏附连接、Rap1信号通路、耶尔森菌感染、FoxO信号通路、TGF-β信号通路。见图5B。
3 讨论
肿瘤的发生发展是一个复杂的进化过程,受肿瘤前体和抗肿瘤因子共同调控[12]。既往研究显示多种miRNAs可以通过调节靶基因的表达参与肿瘤的生物学行为,在肿瘤诊断和预后中均具有重要作用[13]。异常表达的miRNA可以作为原癌基因或肿瘤抑制基因影响多种恶性肿瘤的发展和转移[14]。多项研究也报道了miR-145-5p在不同癌症类型中异常表达,并显示出抗肿瘤作用[15-16]。如在胰腺癌研究中发现miR-145-5p可通过靶向MUC13抑制细胞侵袭和迁移[17];在口腔鳞状细胞癌中通过调控c-Myc和CDK6发挥抗肿瘤效应[18];在子宫内膜癌[19]和黑色素瘤[20]也发挥了抑制细胞侵袭和迁移作用。在肝癌中,尽管有研究证实miR-145-5p表达下调[21],但其作用机制尚不清楚。LOX是一种铜依赖性单胺氧化酶,在肿瘤发生中发挥关键作用,近年来,越来越多的研究表明LOX家族参与了肿瘤细胞增殖、迁移、侵袭和转移的调控,且可作为调节多种基因的转录因子[22]。但是,LOX在肝癌中的研究机制并不全面,为了探索miR-145-5p是否通过调控LOX而在肝癌中发挥抗肿瘤作用,本研究首先采用Transwell小室实验检测LOX对肝癌细胞侵袭、转移的影响,结果发现过表达LOX能增强细胞侵袭和迁移能力,而沉默LOX则抑制肝癌细胞的侵袭和迁移能力;同时还发现在肝癌细胞中miR-145-5p具有抑制细胞侵袭、迁移能力,并且这种能力可通过上调LOX表达逆转。为了进一步验证两者的关系,本研究还进行生物信息学分析,结果发现LOX mRNA的3'-UTR区与miR-145-5p有结合位点;且Western blot实验验证miR-145-5p对肝癌细胞中的LOX表达水平具有一定调控作用;qRT-PCR检测结果也显示大多数HCC患者癌旁组织中miR-145-5p mRNA的表达水平高于相应癌组织,而LOX则相反,提示miR-145-5p可能为上游调控LOX的一个关键miRNA。此外,本研究还通过生物信息学预测miR-145-5p的靶基因并找出了与miR-145-5p在生物过程、细胞组分、分子功能三个方面的作用。但是,本研究未进行双荧光免疫实验验证LOX是否为miR-145-5p的结合靶点,有待今后进一步验证。
综上所述,本研究发现miR-145-5p在肝癌组织中低表达,而LOX则高表达,miR-145-5p可能通过负向调控LOX抑制肝癌细胞侵袭和迁移,因此miR-145-5p的升高或抑制可能是一种潜在的治疗策略。本研究初步探索了miR-145-5p通过靶向LOX抑制肝癌恶性生物学行为,研究结果有望为肝癌复发和转移的诊疗提供新思路。

