氩氦刀冻融治疗对兔VX2肝移植瘤微血管的影响
林懋捷 易峰涛,2
正常情况下,恶性肿瘤的生长都依赖于血管的生成,包括新生血管的生成以及将现有的血管重新聚集到不断增大的肿瘤组织中[1]。多数肝脏肿瘤具有血供丰富的特点,血管因素在肝脏肿瘤的生长、浸润和转移过程起着至关重要的作用[1-3]。临床上多数肝癌患者因确诊时已处于中晚期而失去手术机会。氩氦刀冻融治疗是一种局部物理治疗手段,对不宜手术切除的肝脏恶性肿瘤具有重要治疗价值,与其他消融技术相比,具有疼痛轻、术中可监测等特点[4]。因此,探讨冻融治疗对肝脏微血管的影响具有重要意义。320排CT可通过器官灌注和功能成像,明确治疗后肿瘤周围血管的变化,为肿瘤预后评估提供依据。既往研究显示,肿瘤内的微血管密度(microvascular density,MVD)是影响肝癌患者总体生存的因素[5],能从病理学层面预测患者预后。本研究拟通过建立兔VX2肝移植瘤模型,采用320排CT灌注成像和免疫组化MVD计数法探讨氩氦刀冻融治疗对肝脏肿瘤微血管的影响,以期明确氩氦刀冻融治疗在临床上治疗肝癌的疗效。
1 材料和方法
1.1 动物及主要试剂
20只健康日本雄性大白兔来自武汉大学细胞储藏中心,兔龄 5~8个月,体质量为 3~5 kg。3只种植VX2肿瘤细胞(兔间变表皮鳞癌瘤株)雄性荷瘤兔来自武汉大学细胞储藏中心,兔龄为4~6个月,体质量为2.5~4.0 kg。实验用兔均经适应性喂养1周后开始实验,用速眠新Ⅱ注射液麻醉,剂量0.1 mL/kg,双侧后肢肌肉注射,5 min后观察,若达到麻醉效果(昏睡状态,对手术刺激无明显反映)则进行后续实验。
速眠新Ⅱ注射液购自长春军事医学科学院兽医研究所;注射用头孢唑林钠购自齐鲁制药有限公司;碘必乐购自上海博莱科信谊药业有限责任公司;鼠抗兔血小板-内皮细胞黏附分子(CD31)抗体、鼠抗兔血管内皮生长因子(vascular endothelial growth factor,VEGF)抗体均购自苏州百远生物科技有限公司;山羊抗兔二抗购自Proteintech公司;PBS磷酸盐缓冲液、柠檬酸钠缓冲液、正常羊血清工作液、链霉素卵白素工作液、DAB染色液、苏木素染液均购自北京中杉金桥生物技术有限公司。
1.2 兔VX2肝移植瘤模型的构建
3只VX2荷瘤兔麻醉后,切取有光泽白色鱼肉样且生长良好的肿瘤组织,放入含适量小牛血清的生理盐水中,剪成直径≤1 mm小块,备用。20只健康雄性大白兔麻醉后,固定、剃毛、剖腹、暴露肝脏。用眼科无齿镊将肿瘤组织分别植入2个肝叶,用无菌明胶海绵填塞植入孔,然后缝合腹腔。后肢肌肉注射0.5 g头孢唑林钠预防感染。肝内移植VX2细胞第3周,用超声检测20只大白兔肝内肿瘤生长情况,若见生长于肝内的瘤样结节则视为种植成功。
1.3 动物分组与实验步骤
15只VX2肝移植兔按随机数字表分为对照组(冻融0 d)和不同时间氩氦刀冻融治疗组(包括3 d组、7 d组、15 d组、30 d组),每组3只。320排CT增强扫描后,对照组当天经耳缘静脉注射15~20 mL空气处死;冻融治疗组进行氩氦刀冻融治疗,并分别于治疗后第3、7、15、30天再次进行320排CT增强扫描,扫描后以同样方法处死大白兔。然后剖腹、取出肝脏,留取肿瘤组织行病理切片及HE和SP免疫组化染色。
1.3.1 氩氦刀冻融治疗方法 各冻融治疗组大白兔麻醉后,固定四肢,取仰卧位;腹部剔毛,消毒,放置无菌洞巾,切开皮肤,剥离肿瘤部位皮肤,暴露肿瘤,记录肿瘤数量、大小及形态。将2 mm冷刀从肿瘤中间插入,穿过肿瘤约0.2 cm;插入到位后,接通常温高压氩气进行冷冻治疗,刀尖温度在30 s内降至-135℃左右,持续5~10 min后,停止氩气输注;改输常温高压氦气,刀尖温度在3 min内上升到15℃,可见冰球融化。再冷冻-复温循环1次。然后拔除超导刀,填塞明胶海绵止血,消毒、缝合皮肤。
1.3.2 320排CT增强扫描观察肿瘤及微血管变化 采用东芝320排CT(Aquilion One)进行扫描。扫描方法:VX2肝移植兔麻醉后仰卧于扫描床后进行动态容积采集,共采集13个容积。扫描参数:电压100 kV,电流100 mA,层距0.5 mm。经兔耳静脉高压注射碘必乐(370 mg/100 mL),流率1 mL/s,总量1 mL/kg。全程扫描时间为30 s。扫描完成后将数据传输到VITREA fx Viion 3.0工作站进行图像后处理,应用容积再现(volume rendering,VR)和多平面重建(multiplanar reformation,MPR)等后处理技术观察肿瘤形态及血供情况等。
1.3.3 组织学HE染色法观察肿瘤组织病理学的变化 将处死大白兔后留取的部分肿瘤组织置于40%甲醛溶液中固定,常规石蜡包埋,制成4 μm组织石蜡切片后进行HE染色。石蜡切片经梯度脱蜡、水化后用苏木素染液染色10 min,自来水冲洗,当标本转为深蓝色后浸入1%稀盐酸酒精中分色15 s,立即用自来水浸洗15 min,蒸馏水洗3 s,伊红染色5 min,蒸馏水洗去浮色后常规脱水、透明、封片。在生物显微镜下观察氩氦刀治疗前后肿瘤组织的病理学改变情况。
1.3.4 免疫组化法观察微血管的变化 处死大白兔后留取的部分肿瘤组织样本行SP免疫组化染色。制成4 μm切片后常规脱蜡脱水;用3% H2O2溶液在37℃下孵育10 min,PBS冲洗后,置于0.01 mol/L柠檬酸钠缓冲液煮沸以修复抗原(95℃,15 min),冷却至室温,用PBS冲洗;然后用正常羊血清工作液封闭,滴加稀释(1∶1 000)一抗CD31抗体或VEGF抗体(使用PBS缓冲液代替一抗行阴性对照),4℃孵育过夜,用PBS冲洗;加入二抗,37℃下孵育30 min,PBS冲洗后,滴加链霉素卵白素工作液,继续孵育30 min,用PBS冲洗,DAB显色,自来水冲洗,苏木素复染,常规脱水、透明、封片。通过计数光镜下单位面积中微血管数目(即MVD)量化分析微血管变化。MVD判定标准:参照文献[6]的计数方法,即首先在低倍光镜下(×40)选取微血管最密集区(即“热点”),然后于高倍光镜视野下(×200)计数“热点”区域中4个视野内染成棕黄色的血管数目并取其平均数,以表示MVD-CD31或MVD-VEGF的表达水平。被抗体染色的单个内皮细胞或细胞团,无论是否形成管腔,只要与周围微血管、肿瘤细胞和其他连接组织有清楚界限,则判定为一个可计数的微血管。排除肿瘤内硬化区及肿瘤交界处软组织内的微血管,以及有平滑肌及管腔直径大于8个红细胞直径的血管。
1.4 统计学方法
用不同方法测量所得的肿瘤大小的一致性采用MedCalc 20.0软件进行Bland-Altman分析;MVD计数用均数±标准差(±s)表示,采用SPSS 25.0软件进行统计学分析,用GraphPad Prism 8.0.2软件绘图。多组间均数比较采用单因素方差分析,若组间差异有统计学意义,则采用Bonferroni检验进行多重比较,以双侧P<0.05表示差异有统计学意义。
2 结果
2.1 兔VX2肝移植瘤模型鉴定
20只大白兔肝内移植VX2细胞后第3周行超声检测,结果显示,5只大白兔未见肝内瘤样结节,即建模失败;15只大白兔肝内可见明显的瘤样结节,视为成功构建兔VX2肝移植瘤模型。
2.2 CT增强扫描和剖腹观察方法测量兔VX2肝移植瘤
15只成功构建的兔VX2肝移植瘤模型经CT增强扫描共发现31个肿瘤,最大径为(1.9±1.4)cm。计数对照组解剖时及冻融治疗组行肝内肿瘤氩氦刀冻融治疗时的肝内肿瘤数目,共发现30个肿瘤,最大径为(2.0±1.5)cm。上述两种方法统计的肿瘤数目符合率为96.7%;MedCalc 20.0软件Bland-Altman分析显示,两种方法所测的肿瘤大小最大差值为0.7 cm,均值相差0.02 cm;绝大多数差值在95%可信区间以内,见图1。说明两种方法检测结果一致。

图1 不同方法测量肿瘤大小的Bland-Altman分析Fig.1 Bland-Altman analysis of tumor size measured by different methods
2.3 氩氦刀冻融治疗前后的CT增强扫描结果
CT增强扫描结果显示,对照组中最大径在0.5 cm以下的肝内VX2移植瘤呈结节状,最大径在0.5 cm以上的肝内VX2移植瘤中间出现坏死,呈囊状;表现为结节实性部分动脉早期即出现明显强化,静脉期呈低密度表现;结节中坏死部分呈低密度、始终无强化表现,见图2A。冻融3 d组和7 d组治疗区内呈囊变、坏死改变,表现为平扫呈低密度、增强始终无强化改变;三维重建可见治疗区为一空洞。冻融15 d组和30 d组提示坏死范围缩小,治疗区周边无明显强化;结节较大时仍可见囊性、坏死表现。当冷冻范围大于肿瘤边缘时周围未见肿瘤血管残存;当冷冻范围仅覆盖甚至小于肿瘤边缘时提示明显肿瘤血管残存。见图2B~C。
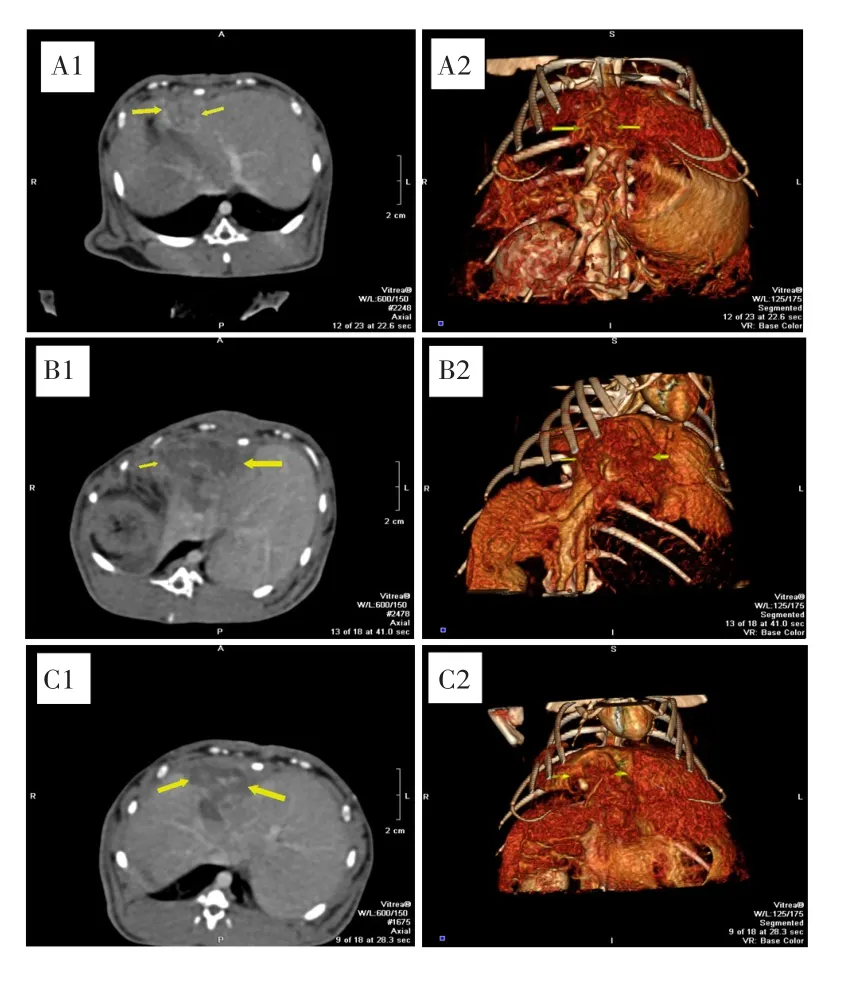
图2 冻融治疗前后的CT增强扫描结果Fig.2 CT enhanced scan results before and after cryoablation
2.4 冻融治疗前后肿瘤大体标本和组织病理学改变情况
对照组见肿瘤呈结节状,光滑无包膜,肿瘤最大径在0.5 cm以上的,中间可见坏死,呈乳白色渣样物质;HE染色示肿瘤细胞呈巢状分布,排列紊乱,与周围分界不清,见图3A。冻融3 d组和7 d组可见冻融区域表现为边界清楚的类圆形坏死区,范围逐渐缩小;HE染色示冻融完整的治疗区边界清晰,其内细胞结构不完整,逐渐形成无结构的组织,周边可见少许纤维组织包绕及大量炎性细胞浸润,呈炎性细胞反应带;冻融不全的治疗区周边可见肿瘤细胞残留,见图3B。冻融15 d组和30 d组的冻融区域随时间延长出现灰白色质硬小结节;HE染色示在坏死区域周围可见纤维增生带,其内可见小核类圆炎性细胞,炎性细胞逐渐减少,见图3C。
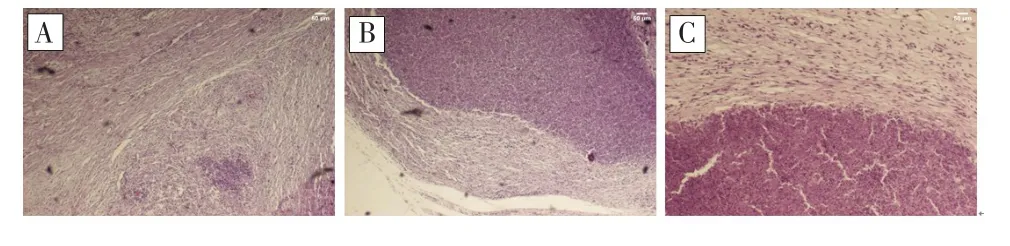
图3 冻融治疗前后的HE染色结果(HE×200)Fig.3 HE staining results before and after cryoablation(HE×200)
2.5 冻融治疗前后MVD-CD31、MVD-VEGF的表达情况
免疫组化检测结果显示,抗CD31抗体及抗VEGF抗体均结合于血管内皮细胞,镜下呈棕黄色,见图4~5;其中,对照组和冻融30 d组免疫组化染色均不明显,但冻融3 d组可见多个细胞的细胞膜和细胞质呈棕黄色,冻融7 d组在炎性细胞反应带可见大量细胞质和细胞膜呈棕黄色,冻融15 d组可见细胞膜或细胞质呈棕黄色的炎性细胞。对照组及各冻融治疗组组间MVD-CD31和MVD-VEGF的表达水平比较差异均有统计学意义(F=117.863,P<0.001;F=274.784,P<0.001),其中冻融3 d组和冻融7d组的MVD-CD31、MVD-VEGF表达均较对照组明显增加(MVD-CD31:P=0.009;P<0.001;MVD-VEGF:P<0.001;P<0.001),且冻融7 d组最高;但冻融15 d组和冻融30 d组的MVD-CD31、MVD-VEGF表达均明显低于对照组(MVD-CD31:P=0.005;P<0.001;MVD-VEGF:P<0.001;P<0.001),且冻融30 d组最低。见图6。
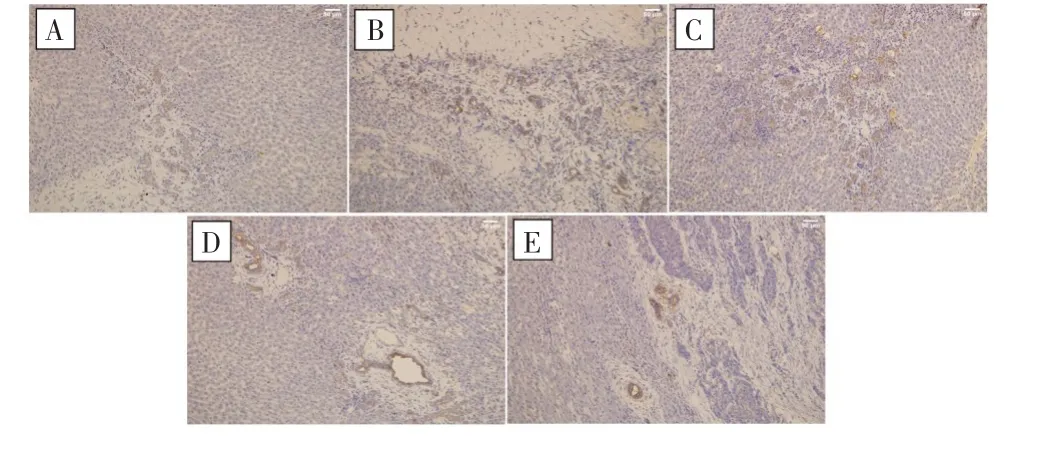
图4 冻融治疗前后抗CD31抗体的免疫组化检测结果(SP×200)Fig.4 Immunohistochemical staining results of anti-CD31 antibody before and after cryoablation(SP×200)
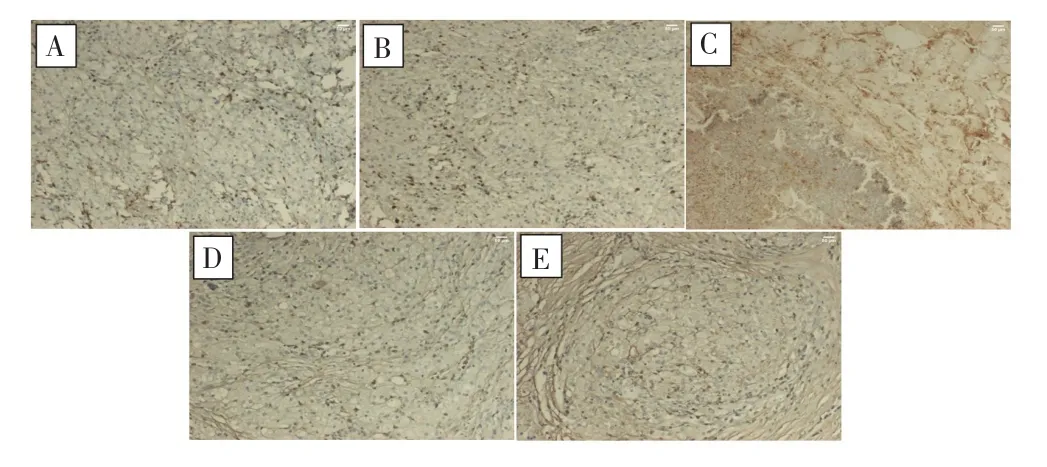
图5 冻融治疗前后抗VEGF抗体的免疫组化检测结果(SP×200)Fig.5 Immunohistochemical staining results of anti-VEGF antibody before and after cryoablation(SP×200)

图6 冻融治疗前后MVD-CD31和MVD-VEGF的表达情况Fig.6 Expression levels of MVD-CD31 and MVD-VEGF before and after cryoablation
3 讨论
氩氦刀冻融治疗又称冷冻治疗,是通过使氩氦刀达到超低温条件而将肿瘤组织杀灭的一种治疗手段,也是肝癌微创治疗的方法之一,尤其适用于不能手术切除的肝癌。多项临床研究[7-9]显示氩氦刀治疗肝脏肿瘤具有良好的效果。不管是原发性肝癌还是转移性肝癌,其预后均与血管变化密切相关[1-3]。肿瘤内的MVD也是肝癌患者预后的预测因子[5]。正常情况下,肝动脉供血占全肝血供的20%~25%,门静脉为80%~85%,两者之比为 1∶3~4。多数肝脏肿瘤包括VX2移植瘤血供丰富,且主要由肝动脉供血。一般实体肿瘤的生长均需要新生血管,而新生血管能引起血容积、灌注量及毛细血管通透性改变。另有研究[10]指出,氩氦刀疗效易受病灶大小、形态和位置等因素影响,对于病灶较大、形态不规则的瘤体,消融过程中单个冰球难以覆盖整个病灶;而多次消融时,相邻冰球之间不能完全融合,会导致肿瘤部分残留从而增加复发风险。氩氦刀冷冻治疗作为肝癌患者重要的局部治疗手段,其治疗疗效对制定后续治疗策略具有重要意义,因此准确评估氩氦刀冷冻治疗效果尤为必要。基于此,本研究选择目前较为成熟的兔VX2肝移植瘤模型,利用氩氦刀处理肝内移植瘤,并分析治疗前后的肿瘤微血管变化情况,以期反映氩氦刀冷冻治疗在肝脏肿瘤中的治疗效果。
本研究结果显示,用320排CT增强扫描计数的肿瘤数目与剖腹观察计数肿瘤数目的符合率为96.7%,表明该法能较好地反映肿瘤数目。同时320排CT也能较好地反映血管分布和血流灌注情况,冻融治疗前肿瘤组织血供丰富,在增强CT动脉早期呈明显强化表现,而治疗后相应区域始终无强化,表现为持续性血流灌注缺损。同时,HE染色见治疗前肿瘤组织呈典型的巢状分布特点,而治疗后可见肿瘤组织缺血坏死呈无细胞结构的组织。上述表现也符合既往研究[11-13]报道的氩氦刀冻融治疗“血管效应”,即氩氦刀冻融治疗会造成微血管内皮细胞损伤,引起血小板聚集、血液瘀滞、微血栓形成,进一步导致冻融区域缺血坏死。对比冻融治疗前后不同阶段的影像学表现与相应组织学HE染色结果,发现冻融治疗3~7 d HE染色见治疗区域内部逐渐形成无细胞结构区域,而CT可见治疗区域呈囊样坏死改变,三维重建则表现为空洞;15~30 d HE染色可见治疗区域周围的纤维增生修复,而CT显示坏死范围缩小,治疗区周边亦未见肿瘤复发,呈无明显强化表现。由此可见,肝脏肿瘤经氩氦刀冻融治疗后病灶逐渐缩小,呈坏死-炎症渗出-纤维修复的改变过程。此外,本研究还发现对于肿瘤冻融完整的靶区,实验期内亦未见新生肿瘤;但冻融不完整则可见冻融靶区边缘有肿瘤残存。
肿瘤组织内部的血供分布及新生血管空间分布有一定差异,呈不均衡性,单层面或局部几个层面的肿瘤灌注参数并不能代表肿瘤整体的血流灌注特点[14]。MVD是目前常用于肿瘤血管生成的评价指标,能反映肿瘤微血管变化,在一定程度上可弥补CT的不足。CD31是一种血小板-内皮细胞黏附分子。既往研究显示,与其他血管内皮标志物比较,CD31能更精确、稳定地反映肿瘤微血管数量[15]。VEGF作为肿瘤组织中最重要的血管生成因子,不仅可以诱导血管内皮细胞迁移、增殖并延长其存活时间,影响肿瘤血管生成和血管通透性,还直接与肿瘤浸润、转移有关[16-17]。因此,本研究在SP免疫组化染色实验中分别采用抗CD31抗体和抗VEGF抗体检测MVD。有研究指出,氩氦刀冻融治疗后数小时至数天内可发现炎症反应存在,3 d内淋巴细胞聚集在肿瘤组织周围,而巨噬细胞数量在7 d内达到高峰,一直持续15 d左右[18]。此外,冻融治疗的靶区中央还会发生坏死,但炎性细胞可在靶区外周诱导新血管形成和后期的纤维化改变[19]。本研究进一步通过MVD监测微血管变化,结果发现氩氦刀冻融治疗后MVD呈先升高后降低趋势。结合HE染色和SP免疫组化染色结果,考虑冻融治疗前期MVD增加可能与冻融治疗后产生的肿瘤组织坏死物刺激机体免疫和炎症系统,从而产生局部大量炎性细胞浸润有关;而治疗后期MVD减少可能与炎性细胞减少,且治疗后肿瘤组织供血微血管数量也随之减少有关。但是冻融治疗前期在CT上未见治疗区域明显强化及血流高灌注表现,这一方面可能是由于氩氦刀冻融治疗主要是通过冰晶的形成与解冻引起肿瘤供血血管损伤,易导致血栓形成,因此也减少了肿瘤组织的血流灌注量。另一方面可能是320排CT单层面或局部几个层面的肿瘤灌注参数并不能代表肿瘤整体血流灌注特点[14]。
综上所述,肝脏肿瘤经氩氦刀冻融治疗后逐渐缩小,肿瘤内MVD呈先升高后降低趋势,冻融治疗最终能使肝脏肿瘤微血管数量明显下降,具有良好的治疗效果。但本研究为肝癌动物模型研究,样本量较少,冻融治疗后MVD的变化及其作用机制仍需进一步深入研究。

