稀释法对抗核抗体中复合核型结果判读的影响
钱 红 朱文波 陶月 宁明哲 戴 蕾▲
1.南京鼓楼医院集团宿迁医院检验科,江苏宿迁 223800;2.南京大学医学院附属鼓楼医院检验科,江苏南京 210008
抗核抗体(anti-nuclear antibody,ANA)是抗所有核酸和核蛋白抗体的总称,包括细胞核、细胞浆、细胞骨架、细胞分裂周期中产生的某些成分等[1-2]。 抗核抗体的类型及滴度高低对疾病的诊断与鉴别诊断、病情评估、疗效监测及预后判断等都起着重要的作用[3-6]。目前, 国内外对ANA 检测推荐使用的方法为间接免疫荧光法(indirect immunofluorescence,IIF)[7-8]。 而对于IIF 结果的判读,虽然已经在向自动化探索,但国内大多数实验室依然采用经典的人工阅片。如同一标本细胞核内同时存在多种荧光模型,对于每个荧光模型的判断及其滴度的判断就很容易受到互相的干扰,甚至出现较强的荧光模型遮盖另一种较弱的荧光模型的情况发生,从而导致最终结果判读的不准确。 本文通过对细胞核复合核型进行稀释后重新判读结果,旨在提高结果的准确性,从而为临床提供更确切的诊断依据。
1 材料与方法
1.1 检测对象
采集2019年6月至8月南京鼓楼医院门诊及住院患者共计8460 份ANA 标本,从中选取初筛为细胞核复合核型的56 例标本,10 例细胞核单核型标本。56 例细胞核复合核型患者中,男8 例,女48 例;年龄15~77 岁,平均(47.2±17.4)岁;10 例细胞核单核型患者中,男1 例,女9 例;年龄24~83 岁,平均(45.8±17.6)岁。 患者于抽血后2 h 内送至检验科,当天分离血清后检测。
1.2 仪器与试剂
EUROLineMaster Plus-A 全自动免疫印迹仪、Sprinter XL 全自动间接免疫荧光操作/酶联免疫一体机均由欧蒙医学实验诊断有限公司生产,抗核抗体免疫球蛋白G(immunoglobulin G,IgG)检测试剂盒(间接免疫荧光法;批号:CD190429AA)、抗核抗体谱(IgG)检测试剂盒(免疫印迹法;批号:CF190604AC)均购自杭州欧蒙医学科技有限公司。
1.3 检测方法
将收集的研究标本,收集当天即分别按照1∶100、1∶1000、1∶10 000 稀释,操作步骤严格按照厂家提供的说明书进行,检测后,在EUROStar III Plus 荧光显微镜下(40×物镜)观察检测结果。 激发滤片:488 nm;分光滤镜:510 nm;阻挡滤镜:520 nm。 所有荧光显微镜判读结果均由1 名副主任技师和1 名主管技师共同阅片完成。抗核抗体谱(IgG)试剂盒检测完成后,将检测膜条放置在结果判定模板中,风干后判读结果。
2 结果
2.1 10 例细胞核单核型标本稀释后荧光模式分析
稀释前后的荧光核型及滴度完全一致, 见图1(封三)。
2.2 56 例细胞核复合核型标本抗核抗体谱结果及稀释后荧光模型分析
56 例细胞核复合核型标本抗核抗体谱结果及稀释后荧光模型分析见表1~2、图2~3(封三)。
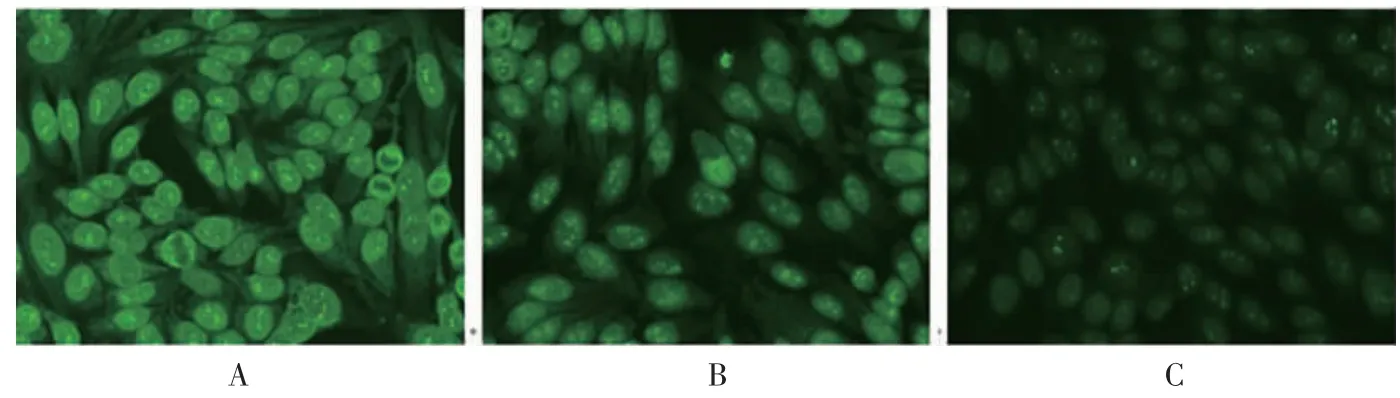
图2 稀释前后的荧光核型及滴度均有改变举例(400×)
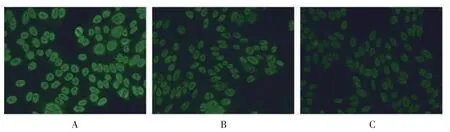
图3 稀释前后的荧光核型无变化,滴度有改变举例(400×)

表1 核型变化及抗核抗体谱结果

表2 滴度变化
3 讨论
抗核抗体的检测方法有很多种,包括IIF 法、酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)、化学发光免疫分析(chemiluminescence im munoassay,CLIA)等,且不同的检测方法具有各自的优缺点[9-11]。 ELISA 的优点是容易操作、标准化、定量检测及敏感性高等;缺点是需要对每项自身抗体进行逐一检测。 CLIA 的优点是敏感性高、特异性强、重复性好等;缺点是检测成本高、需对每个自身抗体进行逐一检测,速度慢。 而Hep-2 细胞属于人来源培养细胞,含大约100~150 种自身抗体,细胞核大、细胞结构清晰、易于结果观察及核型分析,被美国风湿病学会誉为ANA 检测的“金标准”[12]。虽然IIF 结果的判读已有自动化趋势[13-15],但目前国内对于IIF 的结果判读临床应用最广泛的依然是人工方法。由于每个实验室的荧光显微镜、操作人员的专业背景以及经验积累的差异,又缺乏标准化的操作程序,会造成主观判断的标准不同,从而影响结果的准确性和重复性[16-17]。
本研究的10 例细胞核单核型标本, 稀释前后核型及滴度均无变化,说明对单核型样本的判断是准确的。 而56 例细胞核复合核型标本, 就核型和滴度分析,虽然大部分与稀释前相同,但仍出现部分核型增多或减少、滴度升高或降低的情况。
核型增多的8 例中,1 例稀释前判读为细胞核细颗粒斑点型, 稀释后判读为细胞核细颗粒斑点型、细胞核均质型,其原因可能是细颗粒斑点型荧光强度大于均质型,稀释前分裂期细胞浓缩染色体区域荧光较外周弱,但稀释后浓缩染色体区域荧光增强,故判断均质型阳性, 与抗核抗体谱中dsDNA、NUC、Hi 阳性相关。 2 例稀释前判读为细胞核均质型,稀释后判读为细胞核细颗粒斑点型、细胞核均质型,其原因可能是均质型荧光强度大于细颗粒斑点型,稀释前受分裂期细胞浓缩染色体荧光干扰导致误判,稀释后可见细胞间期核内除均匀荧光外也可见颗粒荧光,故判断细胞核细颗粒斑点型阳性, 与抗核抗体谱中SSA、SSB阳性相关。 1 例稀释前判读为细胞核粗颗粒斑点型,稀释后判读为细胞核粗颗粒斑点型、着丝点型,其原因可能是分裂间期细胞核中粗颗粒荧光影响,而分裂期细胞浓缩染色体区域也有颗粒干扰,无法辨认着丝点存在,但稀释后在分裂期细胞浓缩染色体中可见带状的浓缩点状荧光,故判断着丝点型阳性,与抗核抗体谱中CENP-B 阳性相关。 3 例稀释前判读为细胞核细颗粒斑点型, 稀释后判读为细胞核细颗粒斑点型、核仁型,其原因可能为细颗粒型荧光较强,只有部分核仁呈现阳性, 符合细颗粒斑点型荧光模型特征,但标本为1∶1000 稀释时,核仁均呈现荧光染色,故判断核仁型阳性。 1 例稀释前判读为细胞核细颗粒斑点型、核膜型,稀释后判读为细胞核细颗粒斑点型、核膜型、核点型,其原因可能为稀释前误将核点认作核中细颗粒样荧光,该标本1∶10 000 稀释时,细胞核细颗粒斑点型已看不见,核点依然可见,故判断核点型阳性。
核型减少的3 例中,1 例稀释前判读为细胞核细颗粒斑点型、核膜型、胞浆网状/线粒体型,稀释后判读为细胞核细颗粒斑点型、胞浆网状/线粒体型,其原因可能是胞浆中颗粒附着在细胞核周围形成荧光导致误判,稀释后逐一观察,与其荧光模型特征不符,最终判断核膜型阴性,稀释后判读模型与抗核抗体谱结果RO-52、AMA-M2 阳性相关。 2 例稀释前判读为细胞核细颗粒斑点型、细胞核均质型,稀释后判读为只有细胞核细颗粒斑点型, 其原因可能是分裂期细胞浓缩染色体外周区荧光太强, 误判为浓缩染色体区域有荧光, 稀释后分裂期细胞浓缩染色体外周区荧光减弱,可见浓缩染色体无荧光,故判断均质型阴性,稀释后判读模型与抗核抗体谱结果SSA、SSB 等阳性相关。
滴度升高的23 例中,当细胞核中同时存在多种荧光模型时,稀释前可能出现荧光较强的核型遮盖荧光较弱的核型的情况出现, 而随着稀释度的增加,这种遮盖效应会减弱,被遮盖的核型也显示出来。 也有报道IIF 检测高滴度的ANA 样本在低稀释度时容易产生前带效应,造成1∶100 稀释时荧光亮度反而弱于1∶1000 稀释时荧光亮度[18]。
滴度降低的8 例中,当细胞核细颗粒斑点型(或粗颗粒斑点型)和细胞核均质型同时存在于细胞核时,间期细胞核均表现为阳性,可导致荧光叠加造成滴度判读偏高。当细胞核细颗粒斑点型(或均质型)和核仁型同时存在时, 两种核型表现为不同强度荧光,据此判断滴度时,可能将荧光强度较强的模型滴度判读偏高。
综上所述,在读片时,若只做一个稀释度(1∶100),其余结果的判读就需要依靠工作人员的经验。实际临床工作中,受限于检测周转时间、成本控制等,目前大多数医院在检测ANA 时,只做一个稀释度,这样易造成漏读、错判。只做一个稀释度时,对单核型的判断影响不大;但对部分细胞核复合核型中核型及滴度的判断会造成影响。所以,当出现细胞核复合核型时,可以通过稀释的方法来协助判断。

