硫辛酸对高糖诱导的肾小球系膜细胞NLRP3炎症小体表达的影响
冯 颖 赵淑敏 王中英 刘 艳
1.菏泽医学专科学校内科教研室,山东菏泽 274000;2.菏泽医学专科学校附属医院内分泌科,山东菏泽 274000
糖尿病(diabetic mellitus,DM)是最常见的代谢性疾病之一,严重影响人类身心健康,国际糖尿病联盟2019年的资料显示,在世界范围内DM 患病人数已达10 亿人,预计该数字将在2030年增加25%,在2045年增加51%[1]。 糖尿病肾病(diabetic nephropathy,DN)是DM 患者最常见的慢性并发症之一。一项对400 名2型糖尿病患者的研究发现,将近一半的患者有微量白蛋白尿[2],是DM 患者死亡的主要原因之一。
近年来有研究显示,氧化应激与DM 及其并发症的发生发展密切相关[3]。 DN 患者应用硫辛酸(lipoic acid,LA) 可以降低血清中炎症细胞因子的水平并改善肾脏功能[4]。 DN 患者应用LA 是否影响NLRP3 炎症小体表达,目前鲜有报道,本研究拟观察高血糖对培养的人肾小球系膜细胞(human glomerular mesangial cells,HMC)中NLRP3 炎症小体表达的影响,并通过观察LA 对高糖诱导的HMC 中NLRP3 炎症小体表达的影响,探讨LA 对肾脏保护作用及可能作用机制,以期探寻DN 发病的新机制和防治新策略。
1 对象与方法
1.1 主要仪器与试剂
人HMC 购自美国ATCC 公司;10%胎牛血清的DMEM 培养液、青霉素-链霉素双抗、胎牛血清及胰酶购自美国HyClone;LA 购自美国Sigma 公司; 细胞计数试剂盒-8 购自同仁化学研究所;Real Time PCR 试剂盒购自Invitrogen(Carlsbad,CA,USA);分光光度计购自Thermo Fisher Scientific(Waltham,MA,USA);NLRP3 抗体购自北京中杉。 蛋白上样缓冲液、PBS 粉剂脱脂奶粉、BCA 蛋白浓度测定试剂盒购自江苏碧云天生物试剂公司。
1.2 实验分组及方法
实验分为:NG 组、HG 组、LA 组、HG+不同浓度LA组(分别为50、100、200、300、400 μmol/L)。NG 组:葡萄糖浓度为5.6 mmol/L,HG 组:葡萄糖浓度为20 mmol/L,LA 组: 依据细胞存活率, 选择明显抑制细胞增殖的LA 浓度。
1.2.1 CCK-8 方法检测细胞存活率 HMC 株解冻复苏后, 接种到含10%胎牛血清的DMEM 培养液的培养瓶中,并置于37℃,含5% CO2,饱和湿度的孵箱中培养,定时观察细胞的生长状态。观察细胞生长至75%~85%时, 胰酶消化制成单细胞悬液。 以3.5×104/ml 的细胞密度接种于96 孔板内, 置于37℃、5% CO2培养箱中培养过夜,使细胞贴壁。 LA 预处理12 h 后高糖刺激48 h,48 h 后每孔加入10 μl CCK-8 试剂,轻摇,37℃孵育3 h,酶标仪(λ=450 nm)记录各孔的吸光度(optical delnsity,OD),取4 孔OD 值的平均数,按公式计算细胞存活率,细胞存活率(%)=处理组OD/NG 组OD×100%,重复3 次。
1.2.2 流式细胞术检测细胞内ROS 水平 实验时取对数生长期的细胞,胰酶消化培养液中和后,制成单细胞悬液。 以3.5×105/ml 的细胞密度接种于六孔板的四个孔中, 培养12 h 使之贴壁,LA 组、LA+HG 组加入浓度为200 μmol/l 的LA 处理12 h 后,HG 组、LA+HG 组高糖刺激48 h, 然后弃上清,PBS 漂洗1 次后,加入新鲜配制的DCFH-DA(10 μmol/L),每孔1 ml,37℃避光孵育20 min,PBS 漂洗2 次后, 上机流式检测ROS 的表达水平。
1.2.3 RT-PCR 检测NPR-A mRNA 的表达 按“1.2.2”实验处理细胞,按试剂盒产品说明书进行,采用TRNzol 总RNA 提取试剂进行样本RNA 提取。 纯度和浓度通过使用Nanodrop ND-1000 分光光度计测量A260 nm/A280 nm 来确定。使用2-△△CT方法分析数据。
1.2.4 Western-blot 检测NLRP3 蛋白的表达 按“1.2.2”实验操作分组并处理细胞,蛋白提取后,检测蛋白浓度, 蛋白15 μl 上样并电泳。 电泳后转印到PVDF 膜上,质量分数5%脱脂奶粉封闭并用TBST 清洗后分别加入稀释过的蛋白抗体 (一抗),4℃过夜,BST 清洗3 次,快晃,每次持续10 min;将二抗按一定的比例(1∶2000)稀释于封闭液中,用TBST 清洗3 次,快晃,每次持续10 min。 化学发光,显影,定影,使用UVP 凝胶图像处理系统Labworks4.6 软件。
1.3 统计学方法
应用SPSS 19.0 统计软件进行分析, 实验数据均采用均数±标准差(±s)表示,多组间的比较采用单因素方差分析, 组间两两比较采用LSD-t 检验, 以P<0.05 为差异有统计学意义。
2 结果
2.1 不同浓度LA 对人HMC 细胞存活率的影响
NG 组、HG 组、HG+不同浓度LA 组(分别为50、100、200、300、400 μmol/L)。 如图1 所示,与NG 组相比,HG 组细胞活性明显增高,提示高糖环境可促进细胞的增殖。与HG 组相比,HG+不同浓度LA 组可抑制高糖情况下细胞的增殖, 当LA 浓度为200 μmol/L时,明显抑制细胞增殖,差异有统计学意义(P<0.05)(图1),200 μmol/L 的LA 浓度为本次实验选择的浓度。
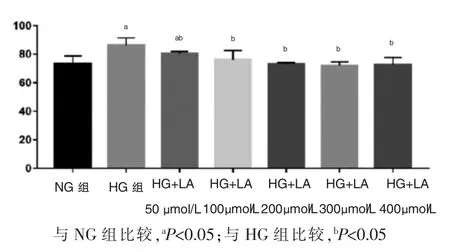
图1 CCK-8 检测不同浓度LA 对HMC 细胞存活率的影响
2.2 流式细胞术检测ROS 的表达水平
图2 结果显示,NG 组ROS 的表达水平(0.15±0.05)和LA 组ROS 的表达水平(0.17±0.04)比较,差异无统计学意义(P>0.05),HG 组ROS 表达水平为(1.08±0.11),高于NG 组,差异有统计学意义(t=1.73,P<0.05),加入LA 后,HG+LA 组ROS 表达水平为(0.22±0.08),低于HG 组,差异有统计学意义(t=1.89,P<0.05)。
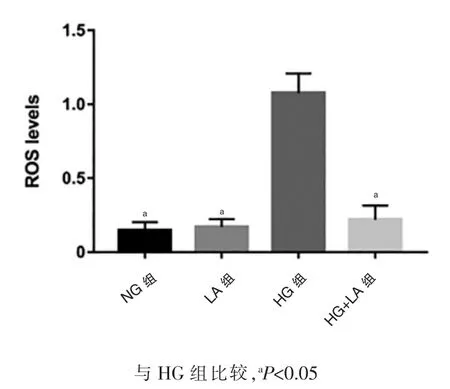
图2 流式细胞术检测ROS 表达水平
2.3 RT-PCR 检测NLRP3 mRNA 的表达水平
图3 结果显示,NG 组(0.79±0.07)和LA 组(0.73±0.08)NLRP3 mRNA 的表达水平没有明显变化,HG 组NLRP3 mRNA 表达水平(1.08±0.11)高于NG 组,差异有统计学意义(t=0.98,P<0.05)。 加入LA 后,HG+LA组NLRP3 mRNA 表达水平为(0.68±0.02), 低于HG组,差异有统计学意义(t=1.05,P<0.05)。
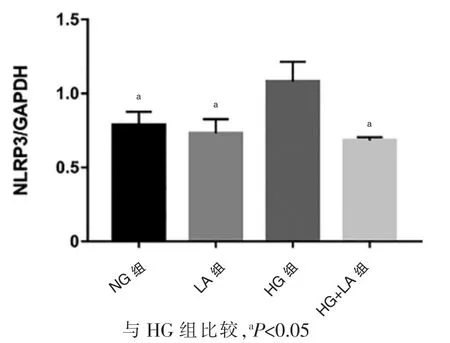
图3 RT-PCR 检测NLRP3 mRNA 的表达
2.4 Western-blot 检测HMC 中蛋白表达
图4 结果显示,HG 组NLRP3 炎症小体高于NG组,HG+LA 组的NLRP3 炎症小体低于HG 组, 差异有统计学意义(P<0.05)。
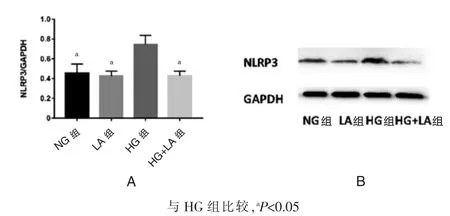
图4 Western-blot 检测NLRP3 炎症小体蛋白的表达
3 讨论
炎症小体被认为是DN 的关键病理生理机制,NLRP3 炎症小体是炎症反应的重要组成部分, 参与了DN 的发生发展过程[5]。 NLRP3 炎症小体在先天免疫中起重要作用, 但NLRP3 炎症小体的激活机制尚不清楚。 研究发现,在人或动物模型中,NLRP3 炎症小体的不适当激活与许多疾病有关,例如炎症疾病和自身免疫性疾病[5-6]。 NEK7 是一种多功能激酶,可影响中心体复制、DNA 修复和有丝分裂纺锤体组装[7]。研究发现NEK7 可调控NLRP3 炎症小体信号通路的基因转录或蛋白质表达。 NEK7 的抑制剂可影响NLRP3 炎症小体的表达进而消除炎症反应,NEK7 可能是NLRP3 炎症小体相关疾病的潜在治疗靶点[7]。α-LA 是天然存在的微量营养素, 可充当线粒体酶活性的辅助因子,由于其潜在的抗氧化剂活性,被认为是通用抗氧化剂。 长期应用α-LA 被证明可以改善肾功能,主要机制是其可改善DN 氧化应激状态[8],DN 是DM 最常见的慢性微血管并发症之一,是导致患者终末期肾脏疾病主要原因之一[9],实验证据表明,氧化应激和炎症反应是DN 的重要发病机制[10]。
炎症小体是一种多蛋白复合物,可通过促进细胞因子的产生和分泌来增强炎症反应。 NLRP3 炎症小体作为炎症小体家族成员之一,被认为是炎症和自身免疫性疾病的关键介体[11],已有研究证实,NLRP3 炎症小体高表达可促进氧化应激,加速DM 并发症的发生发展[12]。 近年来,许多的临床和基础实验研究证实,NLRP3 炎症小体可增加肾小球硬化和肾小管纤维化的发生发展[13]。 在高脂饮食/链脲佐菌素诱导的DN 大鼠实验中发现,DN 大鼠的ROS 和NLRP3 炎症小体表达增加,干扰NLRP3 炎症小体表达可延缓DN 的发生发展[14-15]。ROS 的大量生成,诱发肾脏纤维化及炎症反应,并通过促进脂质过氧化、DNA 损伤及线粒体功能紊乱导致肾组织损伤[16],足细胞是粘附于肾小球毛细血管的上皮细胞,可调节肾小球滤过屏障的完整性,不可逆的足细胞损伤引起肾小球炎症, 并引起慢性肾脏疾病, 裂解补体C5b-9 在足细胞中通过抑制NLRP3 炎症小体表达, 可能有助于肾炎症疾病的靶向治疗[17]。在高脂饮食/链脲佐菌素诱导的DM 小鼠实验中发现, 下调氮氧化物4 的表达和抑制TXNIP/NLRP3途径介导的细胞凋亡有助于糖尿病并发症的治疗[18]。
HMC 是肾脏最为重要的固有细胞之一, 对于肾小球毛细血管簇的形成至关重要[19]。 高糖和高脂多糖可激活HMC 中的ROS/TXNIP/NLRP3/IL-1β 炎症小体信号传导,参与DN 进展[20]。本实验结果显示HG 组较NG 组、LA 组ROS 水平增加, 证实高血糖可增加HMC 氧化应激水平, 本实验也显示HG 组较NG 组、LA 组NLRP3 炎症小体水平表达升高,表明高血糖可能通过氧化应激途径增加NLRP3 炎症小体的表达,从而加重DN 的发生发展。 α-LA 是预防DM 及其并发症的重要抗氧化剂, 它可以再生其他抗氧化剂,例如维生素E,维生素C,辅酶Q10 和谷胱甘肽等,被称为通用抗氧化剂[21]。 然而α-LA 可以改善肾功能损害是否与NLRP3 炎症小体有关鲜有报道, 本研究发现与HG 组比较,HG+LA 组ROS、NLRP3 炎症小体表达水平下降,差异有统计学意义,LA 作为重要的抗氧化剂, 对DN 的保护作用可能与通过降低NLRP3 炎症小体的表达有关,从而为DN 提供新的治疗思路。
综上所述,高血糖使ROS、NLRP3 炎症小体水平升高可能是导致DN 进展的原因之一,LA 保护高糖环境下HMC 的分子学机制可能与抑制ROS、NLRP3炎症小体表达有关,从而抑制DN 的发生发展。

