柴胡皂苷d对蟾蜍离体坐骨神经干电生理特性的影响∗
罗 林,徐婷婷,陈 卫,杨春艳,张建武
川北医学院,四川 南充 637100
柴胡皂苷d(Saikosaponin d,SSd,C42H68O13)是从伞形科植物柴胡Bupleurum ChineseD C.和狭叶柴胡Bupleurum scozonerifoliumWilld.干燥根中提取的一类皂苷类单体成分,是柴胡主要化学指标和生物活性成分之一[1]。近年来国内外研究表明,SSd具有抗肿瘤[2]、抗炎[3]、保肝[4]、免疫调节[5]、雌激素样作用[6]等多种药理作用,同时还有一定的毒性作用[7],但SSd对外周神经系统的影响及其机制报道较少。为进一步完善SSd的作用机制,本研究从电生理学的角度探讨SSd对蟾蜍离体坐骨神经干动作电位的影响,为临床应用提供一定的电生理实验依据。
1 材料与方法
1.1 实验动物选取活跃、皮肤湿润、肤色均匀灰暗的中华蟾蜍40只,体质量(50±5)g,雌雄兼用,由川北医学院动物实验中心提供,实验动物许可证号:SYXK(川)2018-076。饲养条件:常规条件下饲养于川北医学院动物实验中心。
1.2 试剂与仪器SSd(CAS:20874-52-6,上海阿拉丁生化科技股份有限公司),纯度≥98%;标准任氏液(NaCl 6.5 g,KCl 0.14 g,CaCl20.12 g,NaHCO30.20 g,NaH2PO40.01 g,加蒸馏水至1000 mL,所用试剂均为化学纯品,成都科龙化工试剂厂提供;BL-420F生物机能实验系统(成都泰盟科技有限公司);AC0033型神经屏蔽盒(成都泰盟电子有限公司);AC0047型刺激电极(成都泰盟电子有限公司);引导电极(成都泰盟电子有限公司,AC0043);常用蛙类手术器械:蛙足钉(成都泰盟电子有限公司,AC0012)、蛙板(成都泰盟电子有限公司,AC0014);电子天平ES6000-1(沈阳龙腾电子有限公司);记录显示设备(联想公司);优普纯水/超纯水制造系统(四川优普超纯科技有限公司);加样枪(芬兰biohit)。
1.3 实验方法
1.3.1 试药制备60 kg柴胡在60℃条件下,用丁柱工业甲醇提取3次。然后依次用二氯甲烷和正醇萃取,将所得2.1 kg正丁醇萃取物进行硅胶层析,依次用12∶1的二氯甲烷∶甲醇及二氯甲烷∶甲醇∶水的溶剂系统按照极性由小到大进行梯度洗脱,薄层层析合并得到9个组分。利用其制备高效液相色谱,采用80%甲醇对组分4(170 g)进行反相制备(10 cm柱,流速280 mL/min,检测波长:203 nm),得到3个组分;用42%乙腈对组分3即CH-4-3(21 g)进行反相制备纯化(10 cm柱,流速280 mL/min,检测波长:203 nm),得到化合物1(18.11 g)。采用1H-NMR和13C-NMR对该化合物进行结构鉴定,通过解析图谱发现该化合物1与文献 报 道 基 本 一 致[8],故 鉴 定 该 化 合 物1为SSd。
1.3.2 分组及处理 预热电子天平30 min后,精确称量所取SSd,并按照所取质量分别加入相应任氏液配置成阳性组所需试剂。基于预实验的前提下,阳性组按照SSd溶液的浓度分为SSd 18、36、72 μmol/L,对照组则选用同一来源的任氏液作为实验试剂。随机选取制备好的蟾蜍离体坐骨神经干标本分配至对照组及各阳性组,运用加样枪准确抽取200 μL相应试剂,小心滴至刺激电极和引导电极之间的神经干上,待药物充分作用后,检测动作电位相关参数。每次给药前进行充分摇匀再用加样枪抽取试剂,以防局部浓度不均导致实验误差。
1.3.3 标本制备 将蟾蜍进行称重,破坏其脑和脊髓,剪除躯干上部及内脏,剥皮并分离左右腿,游离出3~5 cm的坐骨神经干,尽量将神经干周围的组织剔除干净,神经干脊柱端和足端用棉线结扎。然后将制备好的标本浸入任氏液中孵育10 min[9]。
1.4 观察指标分别将制备好的坐骨神经干标本置于神经屏蔽盒的电极上,中枢段接刺激电极,外周端接引导电极,测定加药前动作电位的阈强度、振幅、传导速度及不应期。保持神经干在电极上放置的位置不动,在刺激电极和引导电极之间的神经干上滴入相应浓度的SSd溶液,盖上神经屏蔽盒盖子以防止水分蒸发和电磁波干扰,用BL-420F生物机能实验系统每隔5 min检测动作电位的相关值,分别检测药物作用后5、10、15、20 min的4个时间点。
1.4.1 神经干动作电位阈强度测定 选择BL-420F生物机能实验系统实验项目菜单下肌肉神经实验栏中“阈强度与动作电位的关系”,设置起始刺激强度为0.25 V,刺激强度增量为0.01 V,刺激间隔为1 s,程控记录第1个动作电位出现时的刺激强度即为阈强度。
1.4.2 神经干动作电位幅度的测定 调整刺激强度为1.5 V,刺激脉冲宽度为0.3 ms,单刺激,由一对引导电极引导出复合动作电位,输入BL-420生物信息采集及处理系统,采用系统的区间测量工具分别测量动作电位上相顶点和下相最低点之间的幅度(mV)。
1.4.3 神经干动作电位传导速度的测定 测量第1对引导电极所测出的动作电位上相顶点到第2对引导电极所测出的动作电位上相顶点的时间(ms),同时直尺测量神经屏蔽盒中第1对引导电极中点与第2对引导电极中点之间的距离(mm),据此计算动作电位的传导速度(m/s)。
1.4.4 神经干动作电位不应期的测定 选择BL-420F生物机能实验系统实验项目菜单下肌肉神经栏中“神经干不应期的测定”。设置程控,双刺激,启示波间隔为10 ms,刺激逐渐减量,记录每两个连续刺激中第2个动作电位正相波消失时的波间隔时间为不应期。
1.5 统计学方法采用SPSS 19.0进行数据录入和管理分析,计量资料以±s表示,采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 神经干动作电位阈强度3种浓度的SSd处理后均使得蟾蜍离体坐骨神经干复合动作电位的阈强度不断减小。与加药前比较,18 μmol/L组在加药后10 min出现统计学差异(P<0.05),36 μmol/L组和72 μmol/L组在加药后5 min即出现统计学差异(P<0.05),并且随着SSd作用时间的延长,差异性愈加显著(P<0.01);而任氏液组随作用时间的延长并未出现统计学差异(P>0.05)。表明不同浓度的SSd溶液均能使蟾蜍离体坐骨神经干复合动作电位的阈强度减小,且药物浓度越大,对动作电位阈强度产生的影响越大;同时提示SSd对动作电位阈强度的作用效果与作用时间存在明显的正相关关系。见表1。
表1 各组蟾蜍离体坐骨神经干动作电位阈强度比较(±s) mV

表1 各组蟾蜍离体坐骨神经干动作电位阈强度比较(±s) mV
注:与同组加药前比较,*表示P<0.05,**表示P<0.01
?
2.2 神经干动作电位幅度3种浓度的SSd处理后均使得蟾蜍离体坐骨神经干复合动作电位的幅度不断增大。与加药前相比,18 μmol/L组和36 μmol/L组在加药后5 min出现统计学差异(P<0.05),72 μmol/L组在加药后5 min即出现显著性差异(P<0.01),并且随着SSd作用时间的延长,各实验组数据比较差异有统计学意义(P<0.01或P<0.001);而任氏液组随作用时间的延长并未出现统计学差异(P>0.05)。表明不同浓度的位SSd溶液均能使蟾蜍离体坐骨神经干复合动作电的幅度增大,并且药物浓度越大,对动作电位幅度产生的影响越大;同时提示SSd对动作电位幅度的作用效果与作用时间存在明显的正相关关系。见表2。
表2 各组蟾蜍离体坐骨神经干动作电位幅度比较(±s) mV
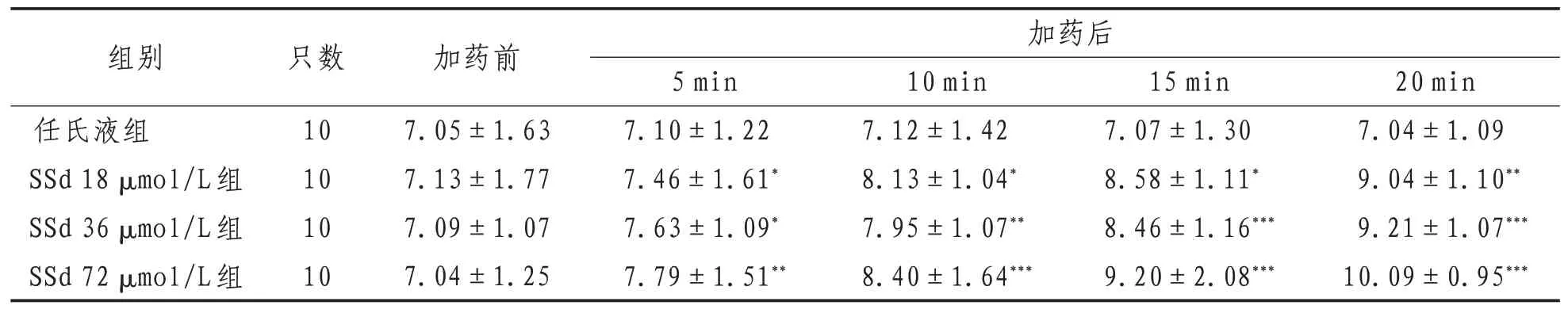
表2 各组蟾蜍离体坐骨神经干动作电位幅度比较(±s) mV
注:与同组加药前比较,*表示P<0.05,**表示P<0.01,***表示P<0.001
?
2.3 神经干动作电位传导速度3种浓度的SSd处理后均使得蟾蜍离体坐骨神经干复合动作电位的传导速度不断增大。与加药前相比,18 μmol/L组在加药后20 min出现统计学差异(P<0.05),36 μmol/L组在加药后10 min出现统计学差异(P<0.05),72 μmol/L组在加药后10 min即出现统计学差异(P<0.01),并且随着SSd作用时间的延长,各实验组数据比较差异有统计学意义(P<0.01或P<0.001);而任氏液组随作用时间的延长并未出现统计学差异(P>0.05)。表明不同浓度的SSd溶液均能使蟾蜍离体坐骨神经干复合动作电位的传导速度增大,并且药物浓度越大,对动作电位传导速度产生的影响越大;同时提示SSd对动作电位传导速度的作用效果与作用时间存在明显的正相关关系。见表3。
表3 各组蟾蜍离体坐骨神经干动作电位传导速度比较(±s) m/s
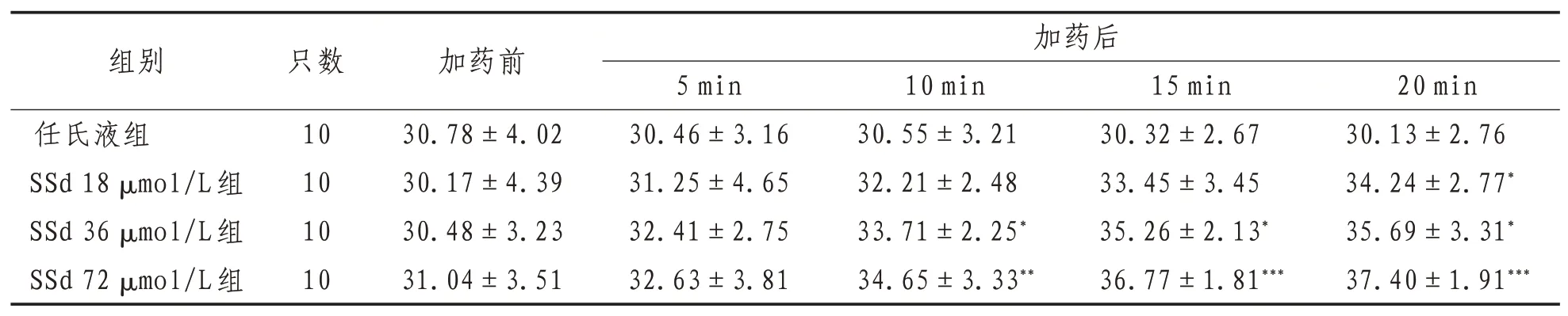
表3 各组蟾蜍离体坐骨神经干动作电位传导速度比较(±s) m/s
注:与同组加药前比较,*表示P<0.05,**表示P<0.01,***表示P<0.001
?
2.4 神经干动作电位不应期3种浓度的SSd处理后蟾蜍离体坐骨神经干复合动作电位的不应期相较于加药前有小幅度的缩短,但差异无统计学意义(P>0.05);任氏液组随作用时间的延长,与给药前比较,差异均无统计学意义(P>0.05)。见表4。
表4 各组蟾蜍离体坐骨神经干动作电位不应期比较(±s) m
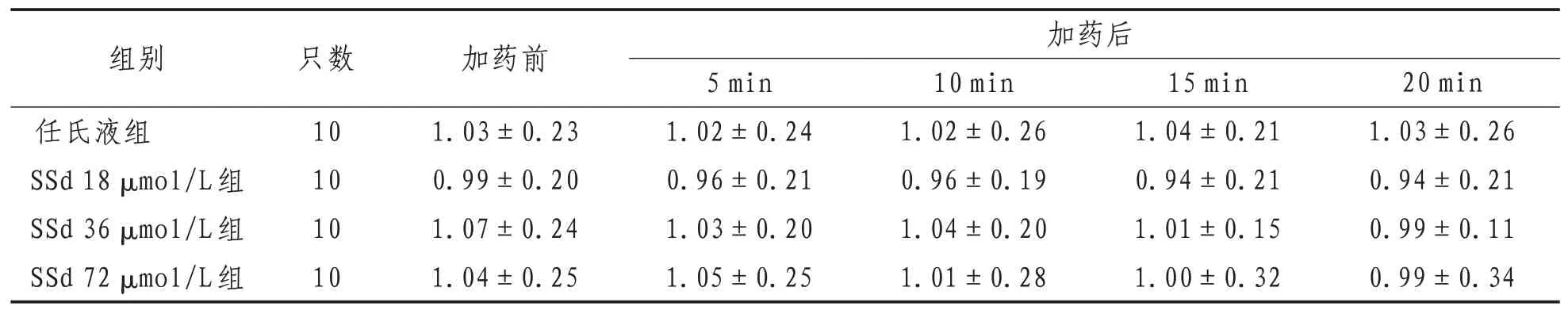
表4 各组蟾蜍离体坐骨神经干动作电位不应期比较(±s) m
?
3 讨论
近年来越来越多的国内外学者投身于SSd的研究,SSd的抗脂质过氧化、抗肿瘤、调节免疫等作用被逐渐发掘,涉及领域也不断扩展[10]。但柴胡皂苷对坐骨神经干的药理作用尚无报道,因此本研究就SSd对蟾蜍离体坐骨神经干动作电位的影响进行了探讨。神经细胞兴奋的标志是产生动作电位,动作电位一旦爆发即以一定的幅值迅速沿细胞膜向周围扩布[11]。而动作电位形成的离子基础主要是Na+和K+,神经细胞在静息电位基础上接受有效刺激后,Na+通道的通透性增大,Na+瞬间大量内流,出现去极化,当去极化达到阈电位水平时,膜发生的去极化与Na+电导之间形成正反馈,使膜电位出现爆发性去极化,形成动作电位陡峭的升支,随后K+通道开放,大量K+外流出现复极化,形成动作电位的降支,两者共同形成尖峰状的峰电位。峰电位是动作电位的主要部分,被视作动作电位的标志。因此神经细胞产生动作电位的能力与阈电位的水平有着必然联系,而影响阈电位水平的主要因素是电压门控钠通道在细胞膜中的分布密度、功能状态以及细胞外的Ca2+水平[12]。
本实验结果表明,用SSd处理后的蟾蜍离体坐骨神经干其阈强度相较加药前明显减小,而且呈明显的剂量依赖性。在实验中,本课题组严格控制实验变量,选取来自同一总体的蟾蜍,在实验过程中均采用标准任氏液,实验结果显示任氏液作用于坐骨神经干后并未引起统计学差异,而细胞膜上钠通道的分布密度在短时间内变化不大,因此可以认为钠通道的分布密度和细胞外的Ca2+水平的变化均无统计学意义,SSd仅通过作用于细胞膜钠通道的功能状态从而影响动作电位的形成。故本研究结果推测SSd有可能通过与神经细胞膜上多个靶点结合而改变细胞膜Na+通道的性状,使Na+通道处于高敏状态,细胞膜对Na+的通透性增大,故引起动作电位的刺激阈强度降低。同时Na+通道处于高敏状态时,Na+内流量也会增加,从而导致动作电位幅度增加[13],这与本实验的实验结果也是相符的。神经纤维上,动作电位是以神经冲动的方式进行传导的。动作电位的幅度增大后,兴奋区与未兴奋区形成的局部电流增强,神经冲动在神经纤维上的传导加快[14],这与SSd作用后使坐骨神经干传导速度加快的实验结果也是一致的。SSd的浓度越高,浸泡的时间越长,Na+通道处于高敏状态的数量就越多,以上现象也更明显,这与实验所表现出的浓度依赖性和时间依赖性一致。
神经细胞一次兴奋后要经过一定时间的(绝对不应期)恢复,才能爆发新的兴奋。此恢复时间的长短不仅取决于Na+-K+泵的转运时间,而且与电压门控Na+,K+通道的开放速度和开放时的电导率有关[15]。实验结果表明,运用SSd作用于坐骨神经干后能小幅度的缩短动作电位的不应期,但没有统计学意义,说明SSd可能不具备对上述途径的药理作用,亦可能是限于设备精度原因,本课题组无法精确测量动作电位不应期的变化,出现了假阴性结果。
综上所述,笔者认为SSd减小蟾蜍离体坐骨神经干动作电位的阈强度,增大其动作电位幅度,加快神经干的传导速度可能是通过与神经细胞膜上多个靶点结合而改变细胞膜Na+通道的性状,使Na+通道处于高敏状态,增大了细胞膜对Na+的通透性有关,但其具体机制仍有待于更进一步研究。

