恩格列净通过miR-497-3p/GPLD1通路调控高糖诱人肾小球微血管内皮细胞增殖凋亡的机制研究
高瑞超, 李 敏, 金朋然, 刘 旋, 冯 雪, 檀增桓
(河北省邯郸市中心医院, 河北 邯郸 056000)
恩格列净(Empagliflozin,EMPA)是钠-葡萄糖共转运蛋白2(Sodium glucose cotransporter,SGLT2)的选择性抑制剂,通过增加肾脏顶膜的葡萄糖排泄降低糖尿病患者的血糖[1]。恩格列净可改善糖尿病患者的糖化血红蛋白水平,并可在不增加心率的情况下减轻体重和降低血压,其在欧盟、美国和日本以及世界其他地区被批准用于治疗Ⅱ型糖尿病(T2D),为一种良好的抗高血糖药物[2,3]。但是其产生抗高血糖作用的机制尚未十分清楚。糖尿病肾病在多种糖尿病并发症中最常见,给患者带来的健康危害最严重。EMPA对糖尿病患者的治疗作用虽得到很多患者的认可,但是其发挥作用的机制仍存在疑惑。微小RNA(miRNA)是一种长度在18-25个核苷酸之间的内源性非编码保守的单链RNA,通过抑制靶基因的转录、翻译过程参与各种疾病的发生发展[4]。miR-497-3p是新发现的一种参与糖尿病病变的miRNA之一[5],其是否受恩格列净的调控尚未可知。糖基磷脂酰肌醇特异性磷脂酶D1(glycosylphosphatidylinositol -specifific phospholipase D1,GPLD1)在动物机体的血清中含量较高,其可作为类脂肪细胞合成分泌胰岛素的第二信使调控糖代谢过程。本研究旨在探究恩格列净在高糖环境下对肾小管微血管内皮细胞存活的调控机制与miR-497-3p、GPLD1之间的关系。
1 材料与方法
1.1材料:人肾小球微血管内皮细胞HRGEC购自中国(上海)科学研究院细胞库;恩格列净片(原国药准字J20171073;编号:S14202853284)购自德国勃林格殷格翰药业公司;CCK-8试剂盒购自日本同仁研究所;Annexin V-FITC/PI双染凋亡检测试剂盒购自大连TAKERA;RT-qPCR试剂盒购自上海碧云天研究所;双荧光素酶报告基因检测试剂盒购自北京康为世纪;RNA 结合蛋白免疫沉淀(RNA binding protein immunoprecipitation assay,RIP)实验试剂盒购自美国Thermo Fisher Scientific;兔抗GPLD1多抗、鼠抗PCNA单抗、兔抗P21多抗、兔抗Caspase-3多抗、兔抗Caspase-9多抗、辣根过氧化物酶标记的二抗均购自上海艾博抗。
1.2方 法
1.2.1细胞培养:用DMEM培养液(10%胎牛血清)培养HRGEC细胞,置于37℃、5% CO2的培养箱中常规培养,隔天更换培养液。
1.2.2分组与处理:将正常培养的HRGEC细胞用5、30mmoL/L的葡萄糖处理48h,标记为HG组、HG组。30mmoL/L的葡萄糖与恩格列净(250、500、1000nmoL/L)共同处理的HRGEC细胞标记为250、500、1000nmoL/L组,筛选最适浓度500nmoL/L。LipofectamineTM3000脂质体将miR-NC组(转染miR-NC)、miR-497-3p组(转染miR-497-3p)、si-NC组(转染si-NC)、si-GPLD1组(转染si-GPLD1)、EMPA+miR-497-3p+pcDNA组(共转染miR-497-3p和pcDNA)、EMPA+miR-497-3p+pcDNA-GPLD1组(共转染miR-497-3p和pcDNA-GPLD1)转染HRGEC细胞12h,更换培养液(混有500nmoL/L恩格列净或30mmoL/L的葡萄糖)培养48h,RT-qPCR法确认转染成功,用于后续研究。
1.2.3CCK-8实验:收集细胞,调为105个/mL,取100μL接种96孔板。加入20μL的CCK-8试剂液,震荡混匀,避光孵育15min。在490nm波长下检测细胞吸光度(A490值)。细胞增殖率(%)=A490实验组/A490对照组×100%。
1.2.4Annexin V-FITC/PI双染实验:收集细胞,用500μL的Binding Bμffer悬浮细胞。加入5μL的Annexin V- / FITC避光孵育20min,再加入5μL的PI避光孵育15min。尽快上流式细胞仪结束检测分析。总凋亡率(%)=早期凋亡率+晚期凋亡率。
1.2.5RT-qPCR实验:收集细胞,Trizol液提取其中总RNA,再用反转录试剂盒合成cDNA,作为模板。RT-qPCR试剂盒检测模板中miR-497-3p、GPLD1的表达。2-△△Ct法计算表达水平。95℃,3min;94℃,30s;60℃,30s;72℃,40s;进行45个循环;最后72℃保存10min。引物为:miR-497-3p,正向5′-AAGTGCAGGTCGGT-3′,反向5′-TAGCCTGCAGCACTGTGTG-3′;GPLD1正向5′-TGTTTCCAAGTTACAATGGTTC-3′,反向5′-AGCATGGTTTCTAATGAATGG-3′;内参U6、GAPDH所用为通用引物。
1.2.6WB实验:收集细胞,RIPA裂解液冰上裂解30min,提取细胞总蛋白。Bradford法蛋白定量,沸水浴变性,取上清上样。使用SDS-PAGE凝胶电泳试剂盒配置低浓度浓缩胶、高浓度分离胶,将蛋白聚集在凝胶。再用转膜仪将胶上的蛋白在0℃条件下转移至PVDF膜。取出膜,2.5%的脱脂奶粉37℃封闭2h。将膜浸入一抗溶液(兔抗GPLD1多抗,1∶1000;鼠抗PCNA单抗,1∶500;兔抗P21多抗,1∶2000;兔抗Caspase-3多抗,1∶2000;兔抗Caspase-9多抗,1∶2000),4℃孵育过夜。再转入二抗溶液(辣根过氧化物酶标记的二抗,1∶500),37℃孵育1.5h,最后进行ECL显色。β-actin为内参,蛋白灰度值与内参灰度值之比为蛋白表达情况。
1.2.7双荧光素酶报告基因检测实验:生物信息学靶向预测库Targetscan(http://www.targetscan.org)预测到miR-497-3p与GPLD1之间具有靶向关系。将化学合成的GPLD1 -WT(含GPLD1 3UTR片段)和GPLD1-MUT(含GPLD1 3UTR片段突变体)克隆到荧光载体,构建荧光素酶报告基因载体质粒。将其分别与miR-NC、miR-497-3p、anti-miR-NC、anti-miR-497-3p共转染细胞。最后按双荧光素酶报告基因检测试剂盒技术手册操作,检测分析细胞的荧光活性。
1.2.8RIP实验:收集需要检测的细胞,按照RIP实验试剂盒说明书要求操作,悬浮细胞,加入吸附Ago2抗体或IgG抗体的磁珠共孵育。充分洗涤磁珠,提取其中总RNA,进行RT-qPCR实验,分析其中GPLD1的相对表达量。

2 结 果

表1 恩格列净处理的高糖诱导HRGEC细胞的增殖率
2.1恩格列净调控高糖诱导HRGEC细胞增殖:与NG组相比,HG组、250、500nmoL/L组细胞增殖率显著降低;与HG组相比,500、1000nmoL/L组细胞增殖率显著升高(P<0.05)。见表1。
2.2恩格列净调控高糖诱导HRGEC细胞凋亡:与NG组相比,HG组、250、500、1000nmoL/L组细胞凋亡率显著升高;与HG组相比,500、1000nmoL/L组细胞凋亡率显著降低(P<0.05)。故选用500nmoL/L恩格列净处理的高糖诱导HRGEC细胞用于后续研究。见图1、表2。
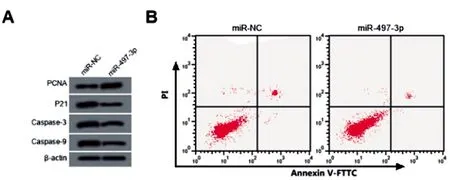
图1 恩格列净处理的高糖诱导HRGEC细胞凋亡

表2 恩格列净处理的高糖诱导HRGEC细胞凋亡率

图2 过表达miR-497-3p的高糖诱导HRGEC细胞PCNA、P21、Caspase-3、Caspase-9蛋白

表3 恩格列净处理的高糖诱导HRGEC中miR-497-3p表达
2.3恩格列净调控高糖诱导HRGEC细胞中miR-497-3p表达:与NG组相比,HG组、250、500nmoL/L组细胞miR-497-3p表达显著降低;与HG组相比,500、1000nmoL/L组细胞miR-497-3p表示显著升高(P<0.05)。见表3。
2.4过表达miR-497-3p调节高糖诱导HRGEC细胞增殖、凋亡:与miR-NC组相比,miR-497-3p组细胞miR-497-3p表达量显著升高,增殖率显著升高,凋亡率显著降低,PCNA蛋白表达显著升高,P21、Caspase-3、Caspase-9蛋白表达显著降低(P<0.05)。见图2、表4。
2.5miR-497-3p靶向GPLD1∶通过Targetscan(http://www.targetscan.org)预测到miR-497-3p与GPLD1之间存在连续的互补结合位点,如图3A。双荧光素酶报告基因检测实验结果如图3B,与miR-NC组相比,miR-497-3p组GPLD1-WT细胞的荧光活性显著降低(P<0.05);RIP实验结果如图3C,与miR-NC组相比,miR-497-3p组Ago2-GPLD1的相对表达量显著升高(P<0.05);与miR-NC组相比,miR-497-3p组细胞GPLD1蛋白表达量显著降低,与anti-miR-NC组相比,anti-miR-497-3p组细胞GPLD1蛋白表达量显著升高(P<0.05),见图3D、E。

表4 过表达miR-497-3p的高糖诱导HRGEC细胞增殖凋亡情况及相关蛋白表达量
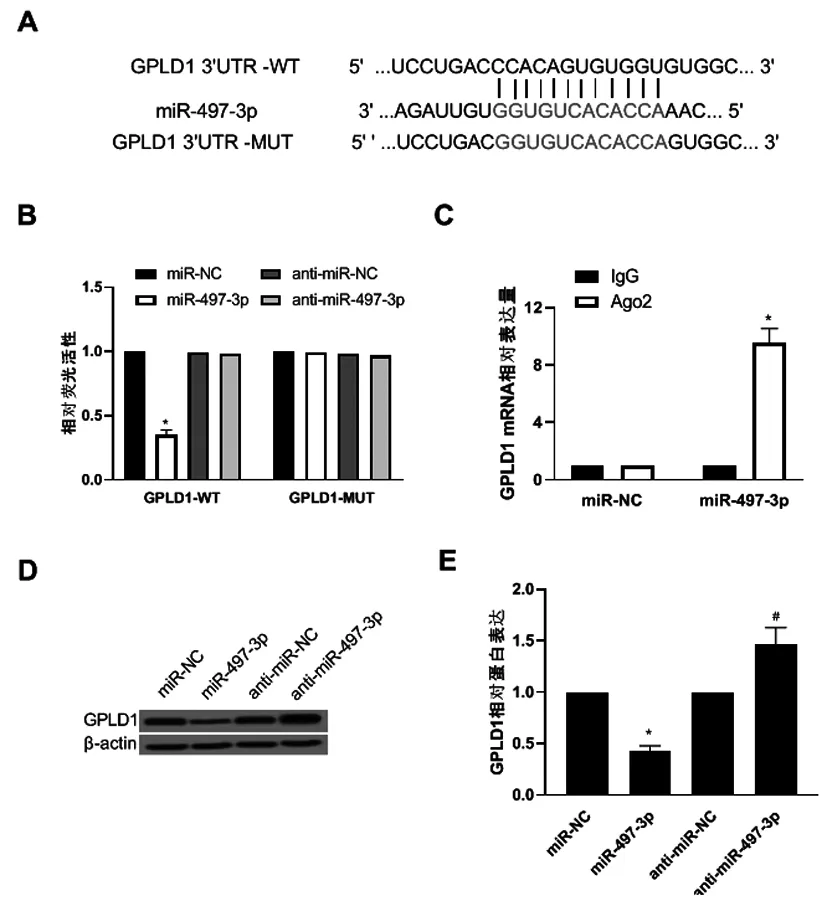
图3 miR-497-3p靶向调控GPLD1
2.6恩格列净调控高糖诱导HRGEC细胞中GPLD1的表达:与NG组相比,HG组、EMPA组细胞中GPLD1的mRNA和蛋白表达均显著升高,与HG组相比,EMPA组细胞中GPLD1的mRNA和蛋白表达均显著降低(P<0.05)。见图4和表5。

图4 GPLD1蛋白表达

表5 恩格列净处理的高糖诱导HRGEC细胞中GPLD1的表达
2.7敲减GPLD1调节高糖诱导HRGEC细胞增殖、凋亡:与si-NC组相比,si-GPLD1组细胞中GPLD1表达显著降低,增殖率显著升高,凋亡率显著降低,PCNA蛋白表达显著升高,P21、Caspase-3、Caspase-9蛋白表达显著降低(P<0.05)。见图5、表6。
2.8过表达GPLD1逆转过表达miR-497-3p和恩格列净对高糖诱导HRGEC细胞增殖、凋亡的调控作用:与EMPA+miR-NC组相比,EMPA+miR-497-3p组细胞miR-497-3p表达显著升高,增殖率显著升高,凋亡率显著降低,PCNA蛋白表达显著升高,P21、Caspase-3、Caspase-9蛋白表达显著降低;与EMPA+miR-497-3p+pcDNA组相比,EMPA+miR-497-3p+pcDNA-GPLD1组细胞上述指标均显著反向调控(P<0.05)。见图6、表7。

表6 敲减GPLD1调节高糖诱导HRGEC细胞增殖凋亡情况及相关蛋白表达量
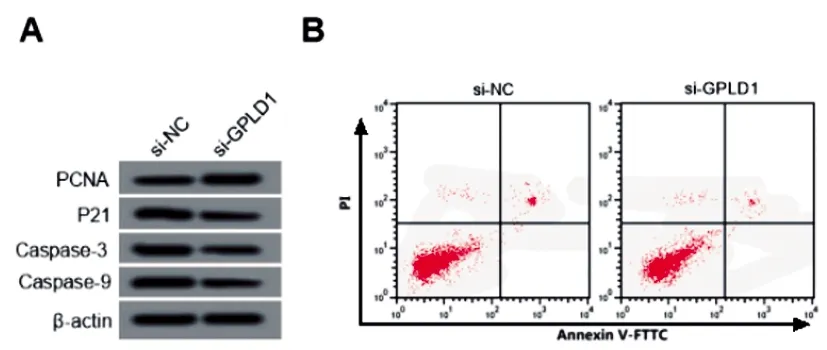
图5 敲减GPLD1调节高糖诱导HRGEC细胞PCNA、P21、Caspase-3、Caspase-9蛋白
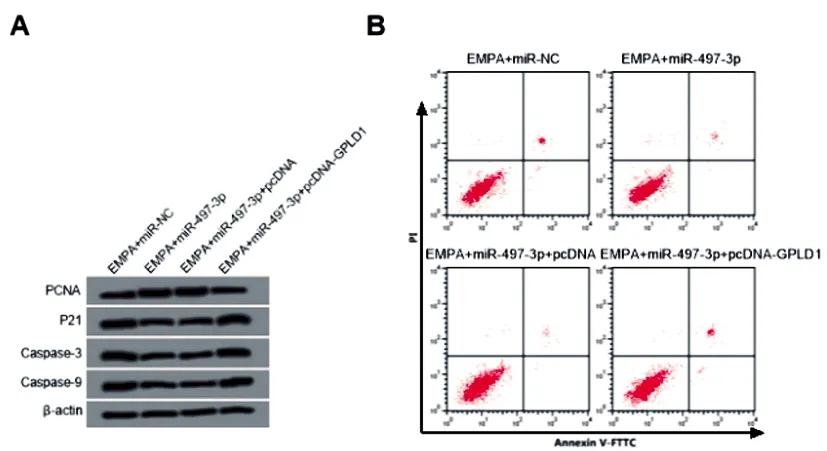
图6 PCNA、P21、Caspase-3、Caspase-9蛋白

表7 过表达GPLD1对miR-497-3p恩格列净调控高糖诱导HRGEC细胞增殖凋亡的影响
3 讨 论
最近很多研究发现,恩格列净可明显减少T2D患者的肾脏并发症和心血管疾病[6]。恩格列净有益于患者血流动力学改变、体重减轻、肾素分泌抑制、循环利钠肽浓度降低和肾单位重塑[7,8],但是这些有益作用在糖尿病并发症中的作用机制仍不清楚。Lee等[9]发现,恩格列净处理后,人肾小管近端上皮细胞线粒体活性氧生成减少,凋亡和纤维化蛋白表达减少,恢复高糖环境下细胞的AMP活化蛋白激酶-α磷酸化和AMP与ATP比率的标准化水平,并且还保护糖尿病小鼠肾脏的损伤。Nitin等[10]报道,恩格列净能够逆转SGLT2对高糖诱导的HK-2细胞的RECK抑制,其机制与调控氧化应激/TRAF3IP2/NF-κB和p38 MAPK/miR-21信号通路有关,减轻高糖环境下肾脏的炎症、纤维化等肾病。本研究发现,恩格列净呈浓度依赖性促进高糖诱导HRGEC细胞增殖,抑制凋亡,说明恩格列净能够促进肾小球微血管上皮细胞的存活,减高糖环境下肾脏的损伤。重要的是,恩格列净还上调高糖环境下HRGEC细胞中miR-497-3p的表达,也许miR-497-3p与恩格列净的抗糖尿病肾损伤有关。
miRNA在人类各种疾病中的功能已得到普遍认可,其中包括糖尿病[11]。miR-497-3p是新发现的一种调控糖尿病发展的miRNA。Ban等[12]研究发现,miR-497在糖尿病小鼠皮肤伤口中的表达下调,在伤口注射miR-497模拟物具有明显的促进伤口愈合作用,并且miR-497还可体外抑制促炎细胞因子的分泌,该研究揭示了miR-497在糖尿病中的抗炎和促伤口愈合作用,暗示其在治疗糖尿病中的巨大潜力。Wang等[13]报道,miR-497在糖尿病肾病组织、高糖处理的HK-2细胞中的表达均下调,过表达miR-497可抑制高糖诱导的乳酸脱氢酶(LDH)漏出、caspase-1激活以及IL-1β和IL-18的分泌,miR-497作为INK4基因座中反义非编码RNA(ANRIL)的吸附剂,靶向鱼硫氧还蛋白相互作用蛋白(TXNIP),参与糖尿病肾病的上睑下垂和肾损伤。本研究发现,miR-497-3p在高糖诱导hRMECs细胞中的表达显著降低,而恩格列净处理后,呈浓度依赖性上调miR-497-3p的表达水平,说明miR-497-3p受恩格列净的正向调控。过表达miR-497-3p明显促进高糖诱导hRMECs细胞增殖,抑制凋亡,并上调增值促进蛋白PCNA,抑制抗增殖蛋白P21、凋亡促进蛋白Caspase-3、Caspase-9,再次证实了miR-497-3p在糖尿病中的治疗价值。重要的是,该研究还通过双荧光素酶报告基因检测实验、RIP实验和WB实验验证了,miR-497-3p能够靶向负调控GPLD1,这也许可能与miR-497-3p的糖尿病治疗有关系。
据报道,糖尿病大鼠血清中GPLD1含量显著升高,运动训练后大鼠血糖明显降低,胰岛素水平明显升高,重要的是,GPLD1含量也显著降低,说明GPLD1参与糖尿病患者血糖的升高过程[14]。最新研究发现,GPC4在二型糖尿病患者、高胰岛素肥胖者、糖耐量低下肥胖者血清中的含量均显著升高,而GPLD1是GPC4的关键因子,与GPC4含量呈正相关,证明GPC4是受GPLD1调节的脂肪组织抵抗胰岛素的重要因子[15]。本研究发现,GPLD1在高糖诱导的hRMECs细胞中表达发生上调,且这种异常升高现象可被恩格列净十分显著的抑制。此研究还检测了敲减GPLD1的hRMECs细胞的增殖、凋亡情况发现,敲减GPLD1后,高糖诱导的hRMECs细胞的增殖率显著升高,凋亡率显著降低,PCNA发生升高,P21、Caspase-3、Caspase-9均明显降低,说明降低GPLD1有利于高糖环境下细胞的生存,暗示恩格列净、GPLD1抑制剂在糖尿病基因治疗中的潜力。深入研究,过表达GPLD1后发现,恩格列净联合过表达miR-497-3p对高糖诱导hRMECs细胞的增殖促进和凋亡抑制作用均可收到十分明显的削弱,说明GPLD1作为miR-497-3p的靶基因,还可逆转恩格列净、miR-497-3p对高糖环境下细胞存活的促进作用。
综上所述,恩格列净促进高糖诱导hRMECs细胞增殖,抑制凋亡,其作用机制为上调miR-497-3p进而抑制其下游靶基因GPLD1表达,为恩格列净用于临床治疗糖尿病奠定理论基础。
——恩格贝

