LncRNA uc.48+通过激活P2X7R/NF-κB通路促进骨关节炎软骨组织的炎症
刘景新, 陈余兴, 王 贵
(海南省儋州市海南西部中心医院骨科, 海南 儋州 571700)
骨关节炎(OA,osteoarthritis)是最常见的关节炎类型,在65岁以上人群中患病率达1/3[1]。OA伴随着慢性疼痛、关节肿大、僵硬等症状,使患者长期忍受运动受限和疼痛,因此严重影响生活质量。目前,OA的治疗主要涉及缓解疼痛和减轻炎症,目的是恢复活动性并缓解症状,但是OA的治疗仍是一个医学难题[2],因此需要寻找更优的抗炎策略来治疗OA。白细胞介素(interleukin,IL)-1β是OA的关键诱导剂,IL-1β导致软骨细胞基质金属蛋白酶(matrix metalloproteinases,MMPs)增加导致代谢失衡。OA患者的软骨细胞会持续产生前列腺素(prostaglandin PG)E2,肿瘤坏死因子-α(tumor necrosis factor,TNF)-α,IL-1β等细胞因子。已知ATP门控的离子通道P2X7受体(ATP-gated ion channel P2X7 receptor,P2X7R)通过多种途径参与调节炎症和疼痛[3]。尽管P2X7R可能与OA炎症密切相关,但其在OA中的上下游调控机制仍有待研究。长链非编码RNA(Long non-coding RNA,LncRNA)通常是长度> 200个核苷酸的RNA转录物,其缺乏编码蛋白质的能力[4]。LncRNA可能通过诱导基因转录的变化和转录后修饰来在RNA表观遗传水平上调节软骨细胞增殖凋亡并参与OA进展[5]。目前发现LncRNAuc.48+在糖尿病大鼠颈神经节中被观察到与P2X7受体共表达[6]。另外,发现uc.48+的小干扰RNA(small interfering RNA,siRNA)通过体外P2X7R抑制糖尿病单吞噬细胞系统的炎性反应[7]。但是鲜见关于uc.48+在OA中的报道。本研究假设OA中LncRNAuc.48+可通过调控P2X7R及其下游通路介导OA的炎症反应。因此本文利用碘乙酸单钠(Monosodium iodoacetate,MIA)建立了OA大鼠模型,并探讨了LncRNAuc.48+在OA中的表达模式和对OA炎症的调节机制。
1 材料与方法
1.1试剂与耗材:LncRNA uc.48+过表达重组质粒(pcDNA3.1-LncRNA uc.48+,pc-LncRNA uc.48+)以及空载体(pcDNA3.1-null,pc-null)构建于上海吉玛公司。60只雄性SD成年大鼠(14周,293-411 g)购于海南医学院实验动物中心。MIA,P2X7R选择性拮抗剂(AZD9056)和NF-κB信号通路抑制剂(Helenalin)购自美国Sigma。兔抗P2X7R、MMP-13、SP、NF-κB P65(P65)、p-NF-κBP65(p-P65)、磷酸甘油醛脱氢酶(glyceraldehyde-phosphate dehydrogenase,GAPDH)的多克隆抗体和HRP偶连的山羊抗小鼠和抗兔抗体购于英国Abcam。PGE2,IL-1β、TNF-α的ELISA试剂盒购于上海碧云天生物公司。大鼠软骨细胞购于武汉普诺赛生物科技有限公司。其余未特殊说明的试剂均购买于美国Gibco公司。
1.2动物与分组:大鼠在12/12h的明暗循环下将每只大鼠单独饲养在鼠笼中。室温23±1.5℃和湿度为(50±10%)。食物和水可随意获得。每天对所有大鼠进行10min的测试环境适应,持续2w。所有动物研究均经我院伦理学审查通过,动物使用方法符合国际疼痛研究协会(International Assocaition For The Study Of Pain,IASP)发布的《动物疼痛行为守则》。将60只大鼠随机数字表法分为sham组(n=10)和MIA组(n=50)。MIA组用异氟烷(2%的O2)麻醉大鼠,MIA溶于无菌的0.9%盐水并进行MIA单次关节内注射(2 mg / 50μL)。从50只MIA中随机选40只,并随机分为4组:pc-LncRNA uc.48+组、pc-null组、pc-LncRNA uc.48++AZD9056组、pc-LncRNA uc.48++Helenalin组。具体而言,从MIA注射后第14天开始,每周2次关节内注射构建的pc-LncRNA uc.48+(2μg/ 50μL,pc-LncRNA uc.48+组),以及pc-null(2μg/ 50μL,pc-null组)。另外,MIA注射后第14天联合注射pc-LncRNA uc.48+(2μg/ 50μL)和AZD9056(5mg / 50μL)(pc-LncRNA uc.48++AZD9056组),每天两次;以及MIA注射后第14天联合注射pc-LncRNA uc.48+(2μg/ 50μL)和Helenalin(40μg/ 50μL)(pc-LncRNA uc.48++Helenalin组)。MIA注射21d为实验终点。所有结果测量均由对随机治疗不知情的实验人员进行。
1.3实时定量PCR:根据制造商的说明,使用Unizol试剂提取大鼠同侧膝关节软骨的总RNA。使用逆转录试剂盒,将每个样品中约5μgRNA用作cDNA合成的模板。PCR中使用等体积的cRNA产物。PCR条件包括94个变性循环40s,55℃退火30 s和72℃聚合30s的40个循环。将PCR产物在1.5%琼脂糖凝胶上电泳,并且通过溴乙锭染色将PCR片段可视化。每个基因的实时PCR实验重复3次。uc.48+引物序列正向:5'-GGCACUACUACUUGCAGAATT-3';反向:5'-UUCUGCAAGUAGUAGUGCCTT-3'。GAPDH用作内参基因。
1.4动物疼痛行为学:机械痛阈值(mechanical withdrawal threshold,MWT)和热缩足潜伏期(thermal withdrawal latency,PWTL)都参考文献报道中的方法进行检测。记录MIA注射的前1d(0d),注射后1d、3d、7d、21d的MWT和PWTL值,实验重复3次。
1.5评估膝盖关节的肿大程度:记录MIA注射的前1d(0d),注射后1d、3d、7d、21d的评估膝盖肿大程度。如前所述,使用校准的数字卡尺测量膝盖的直径,并通过同侧(MIA注射侧)的值减去对侧的值来确定关节之间的直径差异。
1.6ELISA细胞因子的测定:大鼠用1%甲戊酸钠麻醉。从收集软骨组织并进行匀浆[8],收集总蛋白溶液,并在3500g下离心15min。然后收集上清液,并保存于-80℃。根据制造商的说明,通过ELISA试剂盒分析了促炎细胞因子(IL-1β,PGE2和TNF-α)的水平。
1.7膝关节组织的SO染色:MIA后21d,安乐死大鼠,随后将膝关节制成标本,切成5μm切片。根据SO染色试剂盒的制造商的说明,对这些切片进行SO染色。
1.8大鼠软骨细胞体外培养和瞬时转染:大鼠软骨细胞系在补充有10%胎牛血清的RPMI-1640培养基中培养并传代(3d传代一次)。对所得构建体进行测序分析。将大鼠软骨细胞(1×108细胞/L)接种到24孔细胞培养板中。根据制造商的说明书,将Lipofectamine 2000加入无血清RPMI-1640培养基,并且每孔加入1μg pc-LncRNA uc.48+或pcDNA-null转染细胞。24h后将培养基更新为含10%胎牛血清的RPMI-1640培养基以终止转染。收集细胞,用来进行蛋白免疫印迹或qPCR实验。
1.9蛋白免疫印迹:MIA后21d,安乐死大鼠,将注射侧的膝关节软骨组织匀浆后,提取软骨组织的总蛋白,或者收集大鼠软骨细胞,超声裂解后提取总蛋白[9]。凝胶电泳(SDS-PAGE)凝胶,并通过转印将蛋白转移到聚偏二氟乙烯(PVDF)膜上。膜在37℃下用3%脱脂牛奶封闭1.5 h,然后与抗P2X7R(1∶800),MMP-13(1∶1000),SP(1∶1200),P65(1∶600),p-P65(1∶500)和GAPDH( 1∶2000)在4℃下孵育过夜。在室温下与HRP偶联的二抗孵育1.5 h后,使用western blot化学发光分析仪观察蛋白条带。以GAPDH作为内参蛋白。

2 结 果
2.1关节内注射MIA手术诱导OA:与MIA注射前比,在关节内注射MIA后3d,观察到MIA组膝关节的直径明显增加;膝关节注射侧的MWT和PWTL都降低,差异都有统计学意义(P<0.05,表1)。而且在21d 同样观察到关节炎大鼠的疼痛行为,并一直持续到研究终止(表1)。另外HE染色结果显示,与Sham组比,MIA组中炎性浸润明显增加,关节软骨层明显减少缺损(图1A)。另外,MIA组软骨中PGE2、TNF-α、IL-1β的水平也都高于sham组(P<0.05,图1B-1D)。以上结果说明成功构建了OA炎性模型。

表1 OA大鼠痛觉和关节肿胀
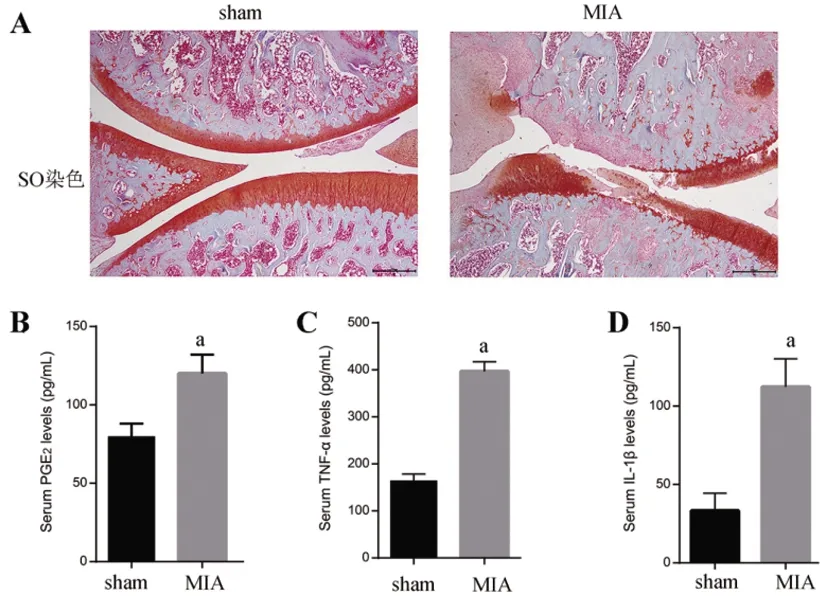
图1 OA大鼠的组织炎症检测
2.2OA大鼠中LncRNA uc.48+和P2X7R表达升高:通过qPCR分析OA大鼠软骨组织中LncRNA uc.48+的表达。,在MIA注射后1d、3d、7d,21d软骨组织LncRNA uc.48+的表达持续升高。另外,软骨组织P2X7R的表达同样在1d、3d、7d、21d上调,差异有统计学意义(P<0.05,图2A和2B)。
2.3软骨细胞中过表达LncRNA uc.48+促进P2X7R表达上调以及的NF-κB的激活:培养软骨细胞,在转染pc-LncRNA uc.48+组中,观察到LncRNA uc.48+表达高于pc-null组(t=22.796;P=0.013)。另外,软骨细胞pc-LncRNA uc.48+组中P2X7R、P65、p-P65的蛋白水平都明显高于pc-null组(t=18.366、26.112、19.984;P=0.009、0.019、0.002)。见图3、表2。

表2 LncRNA uc.48+过表达对P2X7R和NF-κB激活的影响
2.4过表达LncRNA uc.48+通过上调P2X7R/NF-κB信号通路促进软骨炎症因子表达:膝关节注射过表达质粒pc-LncRNA uc.48+,观察到pc-LncRNA uc.48+组软骨组织中P2X7R、P65、p-P65水平都高于pc-null组(t=19.260、17.524、20.069;P=0.008、0.013、0.002)。当pc-LncRNA uc.48+联合注射P2X7R的拮抗剂AZD9056(pc-LncRNA uc.48+AZD9056)或者联合NF-κB抑制剂Helenalin时(pc-LncRNA uc.48+Helenalin),pc-LncRNA uc.48+AZD9056组软骨组织中P65和p-P65水平较pc-LncRNA uc.48+组降低(t=12.559,22.581;P=0.016、0.003);而且,pc-LncRNA uc.48+Helenalin组的P2X7R表达与pc-LncRNA uc.48+组比较,差异无统计学意(t=1.152、0.172)。这说明OA中抑制P2X7R可调节NF-κB的激活。膝关节注射过表达质粒pc-LncRNA uc.48+,我们观察到pc-LncRNA uc.48+组的TNF-α、PGE2、IL-1β水平都高于pc-null组(t=15.669、22.631、16.918;P=0.002、0.001、0.005)。然而,pc-LncRNA uc.48+AZD9056组软骨中IL-1β,PGE2和TNF-α的浓度较pc-LncRNA uc.48+组降低(t=14.925、18.008、16.251;P=0.006、0.004、0.008);而且pc-LncRNA uc.48+Helenalin组软骨中IL-1β,PGE2和TNF-α的浓度较pc-LncRNA uc.48+组也同样降低(t=15.339、21.063、15.921;P=0.005、0.009、0.007)。见表3、图4。

表3 LncRNA uc.48+过表达对OA软骨组织P2X7R和NF-κB激活的影响
2.5过表达LncRNA uc.48+通过上调P2X7R/NF-κB信号通路促进SP和MMP-13表达:膝关节注射过表达质粒pc-LncRNA uc.48+,结果观察到pc-LncRNA uc.48+组的关节软骨组织SP和MMP-13水平都高于pc-null组(t=18.298、17.602;P=0.001、0.004)。pc-LncRNA uc.48+AZD9056组软骨组织中SP和MMP-13水平都较pc-LncRNA uc.48+组降低(t=17.086,20.063;P=0.005、0.014);而且,pc-LncRNA uc.48+Helenalin组的SP和MMP-13表达水平较pc-LncRNA uc.48+组降低,差异有统计学意(t=18.642、19.466;0.029、0.015)。
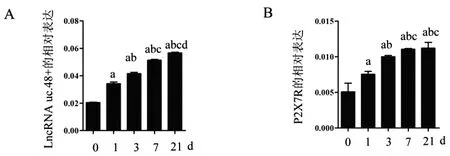
图2 OA大鼠中LncRNA uc.48+和P2X7R表达升高
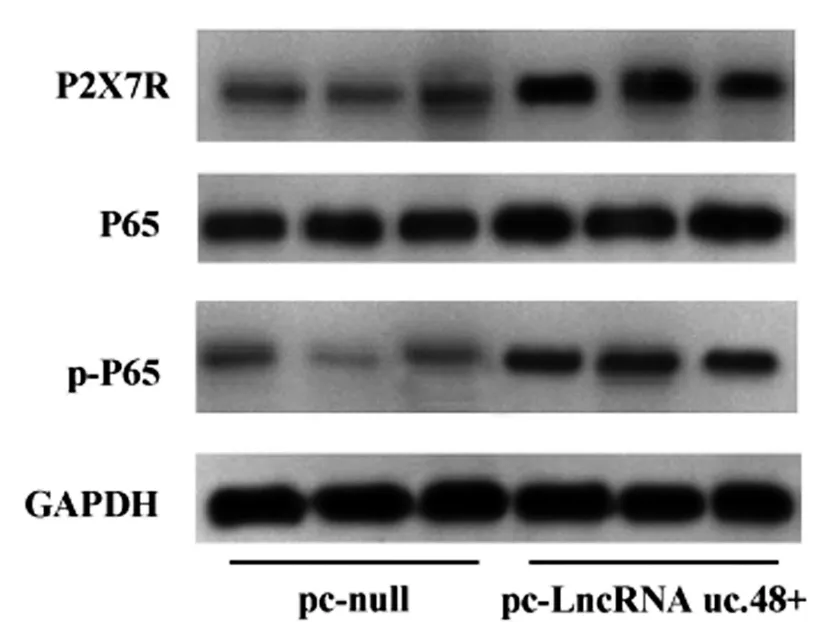
图3 大鼠软骨细胞转染pc-LncRNA uc.48+后对P2X7R和NF-κB激活的影响
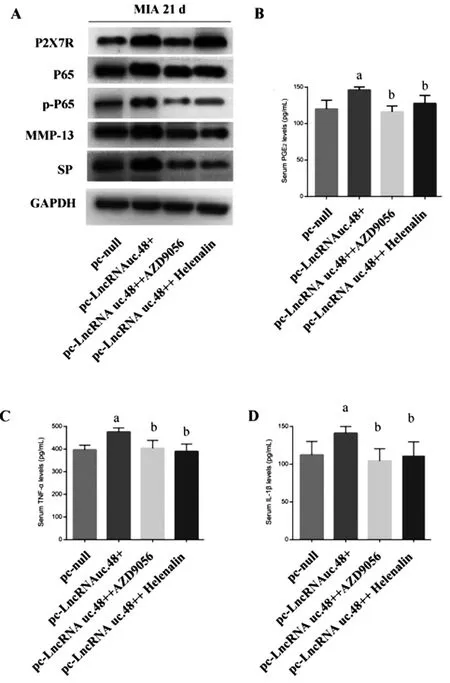
图4 过表达LncRNA uc.48+通过上调P2X7R/NF-κB信号通路促进OA的炎症
3 讨 论
本研究在MIA诱导的大鼠OA模型中观察到LncRNA uc.48+和P2X7R mRNA的表达增加。而且LncRNA uc.48+上调了软骨细胞中的P2X7R。使用P2X7R选择性拮抗剂AZD9056下调了由MIA或MIA联合LncRNA uc.48+引起软骨组织炎症因子IL-β,PGE2和TNF-α、MMP-13、SP的表达。另外,我们观察到LncRNA uc.48+激活了NF-κB信号。而且,NF-κB信号抑制剂Helenali也下调了由MIA或MIA联合LncRNA uc.48+引起软骨组织炎症因子IL-β,PGE2和TNF-α、MMP-13、SP的表达。本研究发现了LncRNA uc.48+MIA诱导的OA大鼠中具有加重OA炎症的作用。我们的研究结果表明LncRNA uc.48+可以调节OA炎症,通过上调P2X7R激活NF-κB信号通路可能是其关键机制之一。
LncRNA的差异表达具有重要的细胞调节功能[10]。本研究的qRT-PCR结果表明MIA组大鼠软骨组织中LncRNA uc.48+的表达水平明显高于sham组。而且本研究使用pcDNA3.1质粒过表达了LncRNA uc.48+,观察到MIA组大鼠的软骨组织炎症因子水平IL-β和TNF-α都明显上调。之前的研究结果也证实了LncRNA uc.48+的促炎作用,该研究证实注射siRNA沉默uc.48+后可以下调糖尿病小鼠IL-1β和TNF-α的表达水平[6]。表明LncRNA uc.48+可能是一种促炎基因,可作为缓解疾病炎症状态的重要候选靶点。
以往研究表明,使用LncRNA uc.48+siRNA沉默uc.48+可以调节RAW264.7巨噬细胞的免疫和炎症反应,从而影响这些作用的过程和结果,而且这些作用和结果由P2X7R介导[7]。在本研究中,通过体外软骨细胞过表达LncRNA uc.48+,我们也观察到了其对软骨细胞P2X7R表达水平的促进作用。AZD9056是一种选择性P2X7R拮抗剂。最近的证据表明,AZD9056具有抗炎特性并可以抑制临床疼痛。我们的数据证实,持续使用AZD9056可以起到消除MIA引起的炎症反应作用,此外,研究表明AZD9056药物作用可以抑制炎症因子,保护滑膜组织并防止RA哺乳动物的软骨基质降解[11]。Zheng L等[12]从OA患者获得的软骨细胞中观察到IL-1β,TNF-α,PGE2会主动产生,滑膜炎性介质也会扩散到软骨中。本研究结果显示MIA模型中LncRNA uc.48+过表达后IL-1β、TNF-α、PGE2的表达继续增加,而AZD9056可以阻止IL-1β、TNF-α、PGE2的上升。这些结果暗示LncRNA uc.48+通过调控P2X7R在炎症诱导的OA的调节中起重要作用。
MMP-13在人OA患者的软骨中特异性表达,但在正常的成人软骨中不存在,是OA软骨中的主要胶原酶。在OA过程中,MMP-13被认为是OA诱导的软骨变性的标志物[13]。本研究我们也证实了LncRNA uc.48+可以上调OA中的MMP-13。而且,通过在大鼠膝关节软骨内关节内注射AZD9056,抑制OA大鼠MMP-13的上调。另外,SP是OA中一个关键的促炎指标,将SP注射进入大鼠关节中可增加OA的炎症程度,本研究我们也证实了LncRNA uc.48+可以进一步上调OA软骨中的SP,而AZD9056同样抑制了OA大鼠软骨中SP的表达。
NF-κB途径是干预炎性疾病最有吸引力的靶标之一。当软骨细胞被IL-1β刺激时,NF-κB途径发生激活,而本研究观察到过表达LncRNA uc.48+与IL-1β具有类似的效果,可以使NF-κB途径发生激活。研究发现,P2X7R可以触发NF-κB信号通路,其激活与炎症性疾病密切相关[14]。使用NF-κB信号抑制剂Helenalin抑制过表达LncRNA uc.48+对MMP-13,SP,IL-1β,PGE2和TNF-α的促进作用,但是Helenalin并未抑制P2X7R,说明P2X7R处于NF-κB的上游。这符合以前研究中获得的结论[15]。我们的数据表明,LncRNA uc.48+上调P2X7R可能通过靶向NF-κB途径来调节OA的炎症反应。
综上所述,MIA诱导OA过程中LncRNA uc.48+的表达增加,并且LncRNA uc.48+可以通过P2X7R/NF-κB信号通路促进OA炎症,说明LncRNA uc.48+是一种关键的OA炎症诱导基因。因此,本研究提供为OA的诊断和治疗提供了新的分子靶点。

