ZLN005通过上调PGC-1α表达诱导巨噬细胞的M2型分化减轻脓毒症引起的急性肺损伤
张 昊, 谭 赟, 杨璐瑜
(湖北省武汉市第三医院, 湖北 武汉 430060)
脓毒症是一种由感染引起的潜在致命性的全身炎症反应综合征,是世界范围内的一个重要公共卫生问题[1]。而肺脏极易受到脓毒症的影响,其功能障碍最终可导致急性肺损伤(acute lung injury,ALI),甚至急性呼吸窘迫综合征[2]。尽管近年来抗菌药物和器官功能支持技术有了快速的发展,但脓毒症诱导ALI的死亡率仍然居高不下[3]。这可能与与脓毒症诱发的ALI的免疫紊乱与失衡炎症反应相关。巨噬细胞作为先天性免疫系统的重要组成部分,在炎症反应中起着关键作用。众所周知,巨噬细胞具有显著的异质性,其极化状态在ALI的发病进展中具有重要地位,如M1型巨噬细胞能促进自由基和促炎细胞因子的表达,诱导ALI进一步步加重,而M2型巨噬细胞的激活有助于缓解炎症[4]。因此,研究巨噬细胞的表型分化调控并促进其M2型极化对改善脓毒症诱导的ALI具有极大的应用价值。过氧化物酶体增殖物激活受体γ共激活因子-1α(Peroxisome proliferator-activated receptor-gamma coactivator-1α,PGC-1α)是调节细胞能量代谢的重要转录共激活因子,既往国内的研究均表明在脓毒症诱导的ALI中PGC-1α的表达呈异常降低现象,推测其可能参与ALI的发生进展[5]。巨噬细胞能量代谢的变化可能会导致其极化状态的改变,且在乳腺癌中,PGC-1α能通过增强线粒体功能促进肿瘤相关巨噬细胞的M2极化和M2型细胞因子的分泌。这提示PGC-1α可能通过影响线粒体功能参与调控巨噬细胞M2极化[6]。人工合成小分子化合物ZLN005,也被称为2-(4-叔丁基苯基)苯并咪挫,是PGC-1α的转录调控因子,据报道,ZLN005能够促进PGC-1α的表达。因此,本研究旨在通过体内外实验进行探究外源性给予ZLN005对脓毒症诱导的ALI的作用及其相关机制,以期为其作为临床治疗脓毒症ALI的潜在药物研发提供新的思路及依据。
1 材料与方法
1.1主要材料与试剂:6~8周龄SPF级雄性C57BL/6小鼠60只(武汉大学动物实验中心),体重20~25g。所有小鼠实验前在室温25~28℃,自由摄食及饮水的环境中适应性饲养一周。小鼠巨噬细胞系RAW264.7(中国细胞资源上海细胞库);胎牛血清(FBS)(美国Gibco公司);100U/mL与100μg/mL的青链霉素混合液、DMEM培养基(美国Hyclone公司);胎牛血清(FBS)(杭州四季青);兔抗PGC-1α、p-AMPK-α、AMPK-α抗体(美国Cell Signaling Techenology公司);兔抗NRF1、NRF2及mtTFA抗体(武汉三鹰生物技术有限公司);脂多糖(lipopolysaccharide,LPS)(美国Sigma公司);兔抗GAPDH抗体(美国Abcam公司);OPTI-MEM、TRIzol试剂、RNAiMAX(美国Invitrogen公司);SYBR Green RT-PCR试剂盒(美国Thermo公司);逆转录试剂盒(日本Takara公司);ZLN005(美国Selleck Chemicals公司);检测TNF-α、IL-1β及IL-6的ELISA试剂盒、ECL发光液(武汉博士德生物技术公司);辣根过氧化酶标记的山羊抗兔二抗、Alexa Fluor 647标记的山羊抗兔IgG(江苏碧云天生物科技股份有限公司);靶向沉默PGC-1α的siRNA及对照siRNA(si-PGC-1α与si-NC)(上海吉玛生物制药有限公司);HE试剂盒(南京建成生物科技有限公司);RT-PCR引物序列由上海生工合成。
1.2方 法
1.2.1ALI的小鼠模型构建及动物实验分组:使用盲肠结扎穿孔术(cecal ligation perforation)建立小鼠急性肺损伤模型。简述如下:1%戊巴比妥按50 mg/kg麻醉小鼠后置于加热毯上,对腹部手术区域常规备皮、消毒后,沿腹中线作一长约1 cm的纵行切口,充分暴露盲肠,在其2/3处用无菌5-0丝线结扎,然后再用18号针头贯穿结扎部位的盲肠组织,并挤出少量粪便,回纳肠管,5-0丝线逐层缝合关闭腹腔后立即腹腔予以注射37℃预热的无菌生理盐水0.5mL进行液体复苏。动物实验分组采用随机数字表法将ALI造模的小鼠分为4组,每组20只,其中假手术(Sham)组为只进行剖腹手术的小鼠,ZLN005组为依照文献方法[7]在假手术(仅开腹手术)后1h经腹腔注射(20mg/kg),CLP组为CLP术的小鼠,CLP+ZLN005组为CLP术后1h经腹腔注射(20mg/kg),并在Sham组与CLP组小鼠术后1h注射等体积的DMSO溶液(ZLN005溶剂);将实验小鼠置于笼中,自由摄食、饮水,观察并记录各组小鼠术后状态,并于造模后24h时处死一批小鼠(每组10只),其余小鼠继续饲养观察7d内的死亡情况。
1.2.2支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)的采集及肺组织湿/干(wet/dry,W/D)比重的检测:各组小鼠处死后进行颈部解剖,充分暴露气管并进行气管插管,0.5 mL预冷PBS溶液灌洗双肺,停留5~8 s后轻轻按摩胸腔,缓慢回抽BALF,上述操作重复3次。将收集的BALF于4℃、3000r/min离心20min,收集上清液保存于-20℃备用。取各组小鼠左肺组织,并用滤纸吸干肺表面水分后称量湿重(wet),然后将肺组织用锡纸包裹置于80℃恒温烤箱24h至恒重,称量干重(dry),并计算干湿比值(W/D)。
1.2.3ELISA检测炎症因子TNF-α、IL-1β、IL-6和IL-10:取方法1.3中收集的各组小鼠BALF,根据ELISA试剂盒说明书方法检测TNF-α、IL-1β、IL-6和IL-10的表达水平。实验单独重复3次。
1.2.4组织免疫荧光染色:取各组小鼠肺组织,4%的多聚甲醛溶液中浸泡24h后,石蜡包埋,切片至4μm左右,二甲苯脱蜡至水,梯度酒精脱水,抗原修复并使用PBST溶液充分洗涤后,2%的BSA于37℃下封闭1h,再次洗涤后滴加抗PGC-1α抗体(1∶500),4℃孵育过夜,次日施加Alexa Fluor 647标记的二抗(1∶100)37℃下封闭1h,使用DAPI试剂染核后,加入防荧光猝灭剂,最后使用荧光显微镜下观察拍照。实验单独重复3次。
1.2.5实时荧光定量PCR(RT-PCR):使用TRIzol法提取待测的组织或细胞中的总RNA,在Nanodrop 1000上检测RNA浓度后,使用逆转录试剂盒将RNA合成cDNA.在根据SYBR Green试剂盒说明书方法进行RT-PCR,其中引物序列见表1。以GAPDH为待测目标mRNA的内参,采用2-△△Ct方法分析进行定量分析。实验单独重复3次。

表1 RT-PCR引物序列
1.2.6细胞培养、转染与分组:RAW264.7细胞培养于含10%FBS与1%青链霉素的DMEM培养基中,并置于含37℃,5%CO2的恒温恒湿培养箱中。当细胞生长融合达80%时,常规消化细胞,调整细胞密度至5×104/mL,并接种至24孔板中,待细胞生长融合至50%时按RNAiMAX试剂盒说明书方法将10nM的si-PGC-1α与si-NC转染入RAW264.7细胞中,6h后更换为常规培养基,24h后使用Western blot与RT-PCR检测转染效率。按实验目的将细胞分为五组,对照组(negative control,NC),ZLN005组,使用4μM的ZLN005处理的RAW264.7细胞,LPS组,使用10μg/mL的LPS处理的RAW264.7细胞,LPS+ZLN005+si-NC与LPS+ZLN005+si-PGC-1α分别为联合使用4μM的ZLN005与10μg/mL的LPS处理的转染si-NC或si-PGC-1α的细胞。上述各组细胞置于37℃,5%CO2的恒温恒湿培养箱中培养24h后用于后续相关实验。
1.2.7Western blot实验:取待测组织或细胞,使用RIPA蛋白酶抑制剂溶液与于冰上进行提取细胞中总蛋白,4℃,12000 rpm/min 离心15 min后收集上清液,BCA法测定蛋白浓度,并置于沸水中进行加热变性,然后取等量的蛋白样品经SDS-PAGE凝胶分离并转移至PVDF膜上。室温下,5%BSA进行封闭膜1h后,加入一抗:PGC-1α(1∶800)、p-AMPK-α(1∶1000)、AMPK-α(1∶1000)、NRF1(1∶500)、NRF2(1∶500)和mtTFA(1∶500)、GAPDH(1∶1500),置于4℃摇床中孵育过夜,充分洗涤后,加入过氧化物酶标记的二抗(1∶5000),室温孵育1h,再次洗涤后,滴加ECL发光液进行曝光拍照,Image J软件检测目标蛋白条带的灰度值,并以GAPDH为内参检测其相对表达。以上实验重复3次。

2 结 果
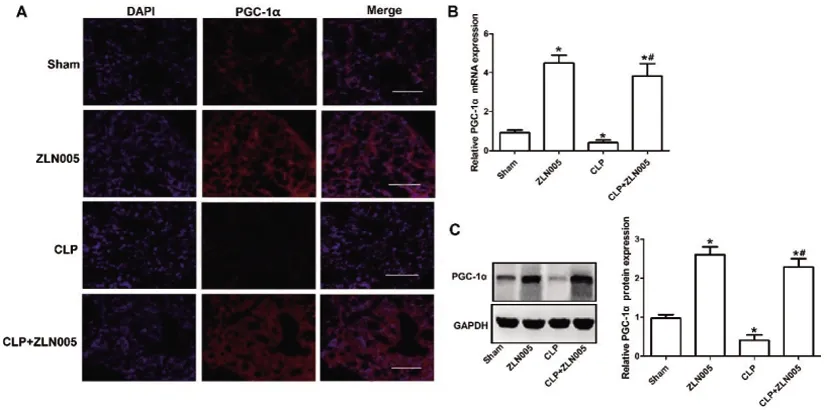
图1 ZLN005促进大鼠肺组织PGC-1α表达
2.1ZLN005对大鼠肺组织PGC-1α表达的影响:免疫荧光观察显示,与Sham组比较,ZLN005组与CLP+ZLN005组的大鼠肺组织中PGC-1α的荧光表达强度显著增加(P<0.05),CLP组明显降低(P<0.05),而与CLP组比较,CLP+ZLN005组中PGC-1α的荧光强度明显增强(P<0.05,图1A);RT-PCR和Western blot检测结果同样表明,与Sham组比较,ZLN005组与CLP+ZLN005组肺组织中PGC-1α的mRNA与蛋白表达水平均显著升高(P<0.05),CLP组中均明显降低(P<0.05);而与CLP组比较,CLP+ZLN005组中mRNA与蛋白表达水平均显著升高(P<0.05,图1B,C)。
2.2ZLN005上调PGC-1α表达调控脓毒症大鼠的炎症反应:ELISA结果显示,与Sham组或ZLN005组相比,CLP组和CLP+ZLN005组中促炎因子TNF-α、IL-1β和IL-6均明显升高(P<0.05),抑炎因子IL-10却显著降低(P<0.05),前两组BALF中上述炎症因子均无明显差异(P>0.05);其中与CLP组相比,CLP+ZLN005组中TNF-α、IL-1β和IL-6的表达水平明显降低(P<0.05),而IL-10显著升高(P<0.05),见表2。
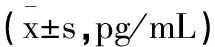
表2 ELISA各组大鼠BALF中TNF-α IL-1β IL-6和IL-10的浓度
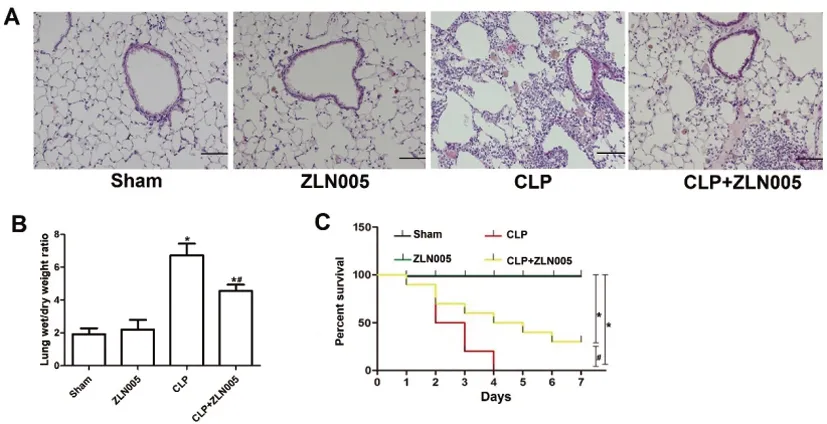
图2 ZLN005上调PGC-1α表达减轻脓毒症诱导的肺损伤
2.3ZLN005上调PGC-1α表达对脓毒症诱导的肺损伤影响:HE染色观察显示Sham组和ZLN005组大鼠肺组织结构正常,肺泡清晰完整,无渗出或炎性细胞浸润现象,而CLP组大鼠肺间质和肺泡腔内有大量炎性细胞浸润,肺泡壁增厚,肺泡内有液体渗出,且间隔断裂,肺泡呈融合或塌陷状,CLP+ZLN005组大鼠肺组织损伤介于上述两者之间(图2A);肺组织W/D比重分析结果显示,CLP组与CLP+ZLN005组比值较Sham组或ZLN005组明显增加(P<0.05),后两组差异无统计学意义(P<0.05)。且与CLP组相比,CLP+ZLN005组W/D比值显著降低(P<0.05,图2B);各组大鼠造模术后7d的生存率分析表明,Sham组与ZLN005组的存活率均为100%,而CLP组与CLP+ZLN005组大鼠生存率均显著降低(P<0.05),同时在CLP造模后6h,所有动物都出现嗜睡,毛发竖立,腹泻等临床症状。其中,CLP组术后第2d存活率为50%,第4d为0%,而CLP+ZLN005组大鼠术后第2d存活率为70%,第4d为50%,第7d为30%(图2C)。
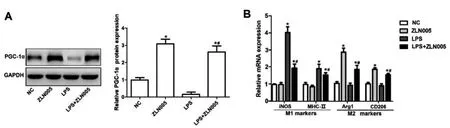
图3 ZLN005上调PGC-1α表达促进LPS刺激的巨噬细胞M2极化
2.4ZLN005上调PGC-1α表达对LPS处理的巨噬细胞极化的影响:Western blot检测各组RAW264.7巨噬细胞中PGC-1α的蛋白表达结果显示,与NC组相比,ZLN005组与LPS+ZLN005组明显升高(P<0.05),LPS组显著降低(P<0.05),其中与LPS组比较,LPS+ZLN005组中PGC-1α蛋白表达明显升高(P<0.05,图3A);RT-PCR检测显示,与NC组相比,LPS组与LPS+ZLN005组中M1型巨噬细胞标记物iNOS与MHC-Ⅱ的mRNA表达明显升高(P>0.05),而ZLN005组与LPS+ZLN005组中M2型巨噬细胞标记物Arg1与CD206的mRNA表达水平显著升高(P<0.05);其中较LPS组相比,LPS+ZLN005组中iNOS与MHC-Ⅱ表达明显降低(P<0.05),而Arg1与CD206表达水平显著升高(P<0.05,图3B)
2.5沉默PGC-1α对ZLN005作用下LPS处理的巨噬细胞极化的影响:RT-PCR与Western blot检测转染si-PGC-1α后RAW264.7巨噬细胞中PGC-1的mRNA结果表明,与NC细胞相比,转染si-PGC-1α的细胞中PGC-1 mRNA和蛋白表达水平显著降低(P<0.05),转染si-NC的巨噬细胞中无明显变化(P>0.05,图4A,B);同时,RT-PCR再次检测M1型巨噬细胞标记物iNOS与MHC-Ⅱ与M2型巨噬细胞标记物Arg1与CD206的mRNA表达水平的结果显示,与NC组相比,LPS组、ZLN005+LPS+si-NC组与ZLN005+LPS+si-PGC-1α组中iNOS与MHC-Ⅱ表达明显升高(P<0.05),且ZLN005+LPS+si-NC组的Arg1与CD206表达亦显著升高(P<0.05);而与ZLN005+LPS+si-NC组相比,LPS组与ZLN005+LPS+si-PGC-1α中iNOS与MHC-Ⅱ表达明显升高(P<0.05),Arg1与CD206表达显著降低(P<0.05),后两组无明显差异(P>0.05,图4C).

图4 沉默PGC-1α抑制ZLN005作用下LPS处理的巨噬细胞M2极化
2.6ZNL005通过AMPK信号通路促进线粒体生物发生影响LPS诱导的巨噬细胞极化:Western blot检测AMPK-α的磷酸化水平(p-AMPK-α/AMPK-α)及线粒体生物发生中关键蛋白NRF1、NRF2和mtTFA的结果显示,与NC组相比,ZNL005组AMPK-α的磷酸化水平和NRF1、NRF2和mtTFA蛋白表达均明显升高(P<0.05),而LPS组、LPS+ZLN005+si-NC与LPS+ZLN005+si-PGC-1α中上述检测指标均显著降低(P<0.05);其中与LPS+ZLN005+si-NC组相比,LPS组与LPS+ZLN005+si-PGC-1α中AMPK-α的磷酸化水平,NRF1、NRF2和mtTFA均明显降低(P<0.05),后两组无明显变化(P>0.05,图5)。
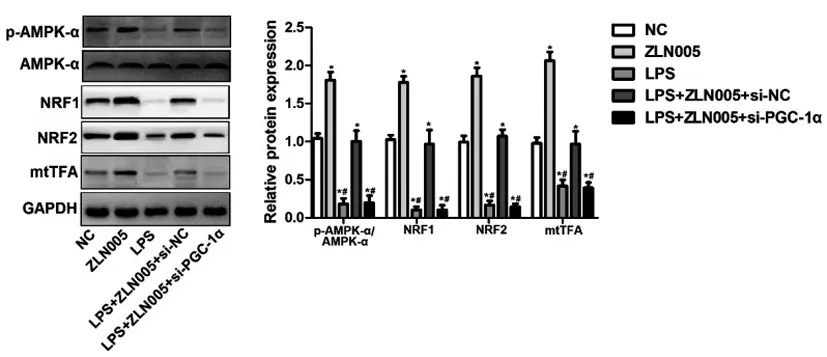
图5 PGC-1α通过促进AMPK信号通路调节LPS诱导的巨噬细胞极化
3 讨 论
本研究结果表明,ZLN005能够显著促进ALI小鼠模型肺组织中PGC-1α的mRNA及蛋白表达,并通过降低炎症反应来改善小鼠肺组织病理损伤,增加存活率,而这可能是通过促进促进巨噬细胞的M2型分化发挥作用。
ZLN005是能上调PGC-1α的转录并激活AMPK的激活进而促进及下游相关信号通路表达的小分子化合物。相关研究均表明ZLN005在疾病模型主要是通过促进PGC-1α的表达来保护线粒体功能,从而减轻组织或细胞的氧化应激损伤和炎症反应。如在脑缺血神经损伤的研究中,静脉予以缺血模型大鼠ZLN005能显著减少脑梗死面积并改善神经功能损伤,进一步的体外研究证实,ZLN005能通过促进神经细胞中PGC-1α的表达,从而保护线粒体功能,上调抗氧化剂因的转录,最终发挥神经保护作用[8]。在耐药性非小细胞肺癌中,联合应用ZLN005能通过诱导PGC-1α的表达调控肿瘤细胞中线粒体功能,从而影响ROS介导的代谢重编程,促进化疗药物的敏感性[9]。在本研究中,脓毒症模型建立后腹腔给予ZLN005后组织免疫荧光检测发现小鼠肺组织中PGC-1α的表达显著增加,且肺组织病理损伤及水肿程度均明显改善,BALF中M1型巨噬细胞炎症因子TNF-α、IL-1β、IL-6均显著降低,而M2型细胞因子IL-10的表达却明显升高,进一步通过体外细胞实验显示,ZLN005能通过上调中M2型巨噬细胞基因CD206、Arg1的表达,并降低M1型iNOS、MHC-Ⅱ表达,而上述作用能被沉默PGC-1α的siRNA所消除。这表明,ZLN005对巨噬细胞极化的调控作用是通过促进PGC-1α表达而发挥的。
脓毒症是一种严重的感染并发症,其中,免疫功能障碍被认为是脓毒症发生发展的重要因素。同时,越来越多的证据表明免疫细胞如巨噬细胞的能量代谢障碍导致其免疫功能受损或异常与脓毒症的发生发展密切相关。而线粒体是能量代谢的主要细胞器,其功能障碍直接参与了免疫细胞的异常反应[10,11]。研究证实PGC-1α是细胞内能量代谢,增加呼吸功能与线粒体氧化磷酸化的重要转录共激活因子,同时PGC-1α下游的核呼吸因子-1与2(nuclear respiratory factor-1/2,NRF-1/2)和线粒体转录因子A(mitochondrial transcription factor A,mtTFA)蛋白是调控线粒体基因转录和线粒体DNA复制的关键调控因子,其表达上调常被用来指示是线粒体生物发生和线粒体功能的增强[12]。此外,PGC-1α在炎症反应与M2巨噬细胞极化中均具有重要地位。如在肝组织炎症反应的体外研究中外源性促进PGC-1α的表达能显著抑制炎症因子TNF-α、IL-1β与IL-6的表达,而应用siRNA干扰PGC-1α的表达后其炎症抑制的作用消失;而在运动损伤的小鼠模型中促进PGC-1α的表达能通过募集巨噬细胞的迁移并诱导其M2型极化,从而更快速高效低消除炎症与坏死,从而促进肌纤维的再生[13]。此外,靳鑫等学者在乳腺癌的体外研究中发现,PGC-1α参与了乳腺癌肿瘤相关巨噬细胞的M2极化过程,其可能是通过促进PGC-1α依赖的线粒体功能,促使细胞向M2分化,并产生大量M2形细胞因子,如转化生子因子-β1(transforming growth factor-β1,TGF-β1)、IL-10等,从而上调肿瘤细胞的侵袭、迁移能力,并提示PGC-1α的高表达是巨噬细胞M2极化状态维持及产生M2型细胞因子所必需的。而在脓毒症诱导的ALI中,PGC-1α在肺组织中的表达异常降低,而脂连素能通过激活内皮细胞中PGC-1α水平来增强线粒体生物发生功能而发挥保护作用[14]。在本实验中,外源性给予ZLN005同样萌购通过促进AMPK信号通路中AMPK-α的磷酸化水平来促进线粒体生物发生的关键蛋白NRF1、NRF2和mtTFA的表达来影响LPS诱导的巨噬细胞极化。这提示,ZLN005可能通过促进PGC-1α的表达参与巨噬细胞的表型转化抑制炎症反应来改善脓毒症诱导的肺损伤。
综上,本研究实验发现,ZLN005能促进PGC-1α的表达以促进M2巨噬细胞的极化来保护脓毒症引起的肺损伤,而其相关作用机制可能与ZLN005通过AMPK信号通路促进线粒体生物发生相关。因此,ZLN005有望成为治疗脓毒症诱导肺损伤的潜在应用药物。

