右美托咪定基于PI3K/AKT/CREB信号通路对肝脏缺血再灌注损伤大鼠干预作用研究
黄符香, 高长胜, 张 爽, 王文军, 宋 歌
(海南省儋州市人民医院麻醉科, 海南 儋州 571700)
肝缺血再灌注(ischemia/reperfusion,I/R)损伤是肝切除或肝脏移植手术期间的常见并发症,已成为制约肝供体使用和肝切除术发展的瓶颈[1]。肝脏I/R损伤在发病过程中涉及的病理因素/途径包括无氧代谢、线粒体功能障碍、氧化应激损伤、细胞内钙超载损伤,以及细胞因子和趋化因子风暴等[2]。但目前尚缺乏有效的预防或治疗方法。已有大量文献报道了与肝脏I/R损伤相关的信号通路,包括磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K) /AKT/环磷腺苷效应元件结合蛋白(cAMP-response element binding protein,CREB)通路、Wnt/β-catenin信号通路、Toll样受体4(toll like receptor 4,TLR4)/NF-kB信号通路等,其中PI3K/Akt 通路是调控肝脏细胞在应对外界刺激后生存的关键信号转导通路[3]。本研究通过建立大鼠肝脏I/R模型,并给与不同剂量的右美托咪定,探讨其是否能够通过PI3K/AKT/CREB通路减轻肝脏I/R。
1 材料与方法
1.1实验动物:本研究使用SPF级雄性Sprague Dawley(SD)大鼠,体重为200±20g(8周龄),购自斯贝福(北京)实验动物科技有限公司,生产许可证号:(SCXK(京)2019-0004)。大鼠饲养于标准温湿度、光照(12h光照/12h黑暗)环境中,自由饮水取食,适应性喂养一周后进行试验。
1.2I/R损伤模型大鼠的建模及分组:大鼠腹腔注射戊巴比妥(40mg/kg)进行麻醉,然后常规手术备皮并用酒精消毒后,沿腹中线开腹,血管夹夹闭肝脏左侧和中侧门脉三合体(portaltriads)[4],造成70%的肝脏缺血,观察到肝正中叶和左侧叶颜色由红变灰白为缺血成功。缺血30min后取夹,分别再灌注6h或12h,至灰白的肝脏组织颜色变红。再灌注完成后,腹主动脉取血处死大鼠,收集血液和肝脏左侧或正中叶组织,保存于液氮或多聚甲醛固定后进行后续实验。采用随机数字法将80只SD大鼠分为8组(每组20只)为假手术组(Sham)、模型组(Model)、右美托咪定低剂量组(Dex-L)、右美托咪定高剂量组(Dex-H);每组再灌注6h和12h分别各处死10只。假手术组大鼠仅麻醉后开腹,不阻断肝脏血流,其余三组均建立I/R损伤模型。Dex-H组腹腔注射100μg/kg右美托咪定,Dex-L组腹腔注射50μg/kg右美托咪定,假手术组和模型组仅注射溶剂。
1.3大鼠血清ALT和AST的检测:再灌注结束后,麻醉大鼠,腹主动脉取血并获得血清。使用全自动血液生化分析仪检测大鼠血清谷丙转氨酶(Alanine aminotransferase,ALT)和谷草转氨酶(Aspartate aminotransferase,AST)水平。
1.4HE染色:中性多聚甲醛固定肝脏组织,并用石蜡包埋,酒精梯度脱水,二甲苯透明、浸蜡、包埋、切片。将切片进行粘片、烤片,再放入二甲苯中脱蜡,依次放在100%酒精(5min),95%酒精(5min),85%酒精(5min),75%酒精(5min),蒸馏水中复水(5min)。并用Harris苏木精液使细胞核着色,1%盐酸分色5s,清水浸洗,10min;后放入伊红溶液中5min染色使胞质着色。再次脱水、二甲苯透明、封片,于光学显微镜下观察肝脏组织病理形态学改变。
1.5氧化应激指标检测:检测大鼠血清氧化应激相关指标,包括谷胱甘肽(glutathione,GSH)、丙二醛(Malondialdehyde,MDA)及超氧化物歧化酶(Superoxide dismutase,SOD),检测试剂盒均购自南京建成公司,严格按照试剂盒说明书进行操作。
1.6Western Blot 检测:取适量大鼠肝脏左侧或正中叶组织,加入RIPA裂解液充分裂解组织制备蛋白均浆,BCA法测定蛋白浓度。加入5×SDS蛋白上样缓冲液,煮沸后备用进行聚丙烯酰胺凝胶电泳,浓缩胶电压100V,分离胶电压150V,后转至PVDF膜, 5%BSA封闭。加入特异性一抗PI3K(1∶1000,EPR18702,abcam,英国),pAKT(1∶1000,EP2109Y,abcam,英国),CREB(1∶1500,ab32515,abcam,英国),β-actin(1∶2000,ab8827,abcam,英国)于4℃冰箱过夜。TBST洗膜3次,加入山羊抗兔二抗(1∶2000),孵育1h。TBST洗膜3次,采用ECL化学发光液曝光显影,使用Image J软件系统进行半定量分析。
1.7qPCR检测方法:取不同时间点大鼠肝脏左侧或正中叶组织进行qPCR的检测。Trizol法提取肝脏总RNA,Nanodrop测定RNA浓度后按照反转录试剂盒说明合成cDNA。qPCR反应体系为20μL;上游和下游引物各(10μmoL/L),1.0μL,cDNA 2.0μL,SYBRTM Premix Dimer Eraser(2×)10μL,ddH2O 4.0μL。反应条件:95℃-10min,95℃-10s,55℃-20s,35个循环。熔解曲线:95℃ 1min,55℃ 1min,95℃ 10s,每个样品设3个技术重复,结果采用2-△△Ct法分析mRNA相对表达量,引物序列见表1。
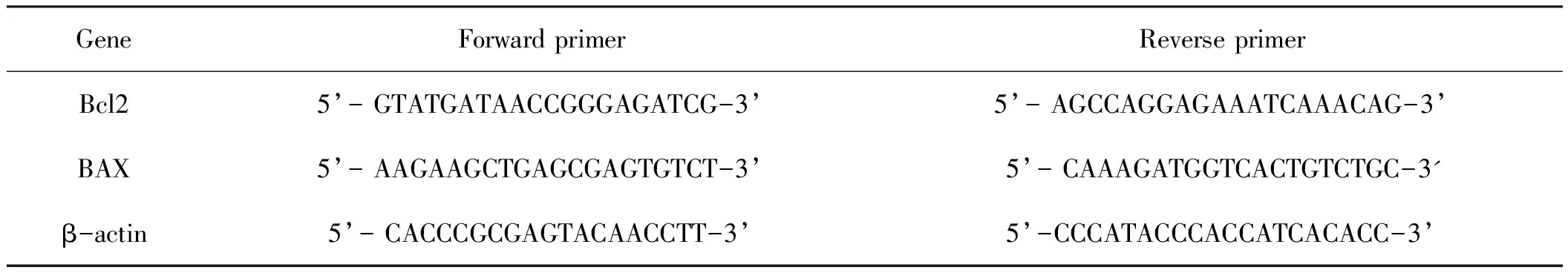
表1 qPCR引物

2 结 果
2.1不同时间点大鼠血清AST和ALT变化:不同时间点大鼠血清AST和ALT变化结果见表2。与Sham组比较,Model组大鼠血清AST和ALT水平在6h和12h均显著升高(P<0.05);与Model比较,不同剂量的右美托咪定给药后AST和ALT水平在6h和12h均显著降低(P<0.05);与Dex-L组相比,Dex-H组在6h和12h时,AST和ALT水平均更低,差异具有统计学意义(P<0.05)。组内比较,Model组AST和ALT水平12h较6h进一步升高(P<0.05),Dex-L组AST水平12h较6h升高(P<0.05),Dex-H组ALT水平12h较6h升高(P<0.05)。
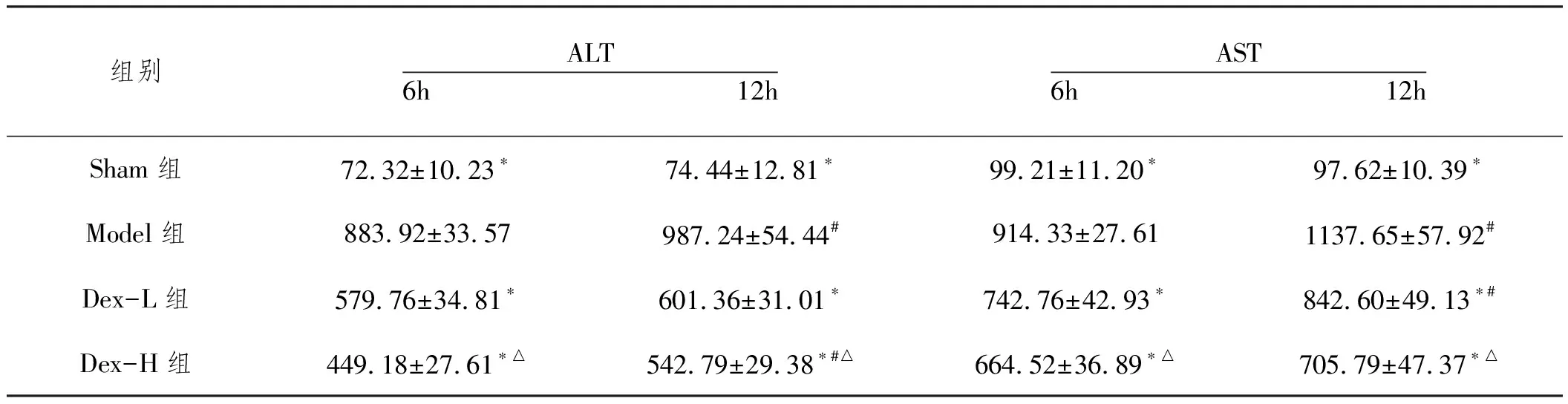
表2 不同组大鼠血清AST和ALT在6h和12h的水平(U/mL)
2.2大鼠心肌组织病理形态学变化:HE染色后不同组别大鼠的肝组织病理学特征见图1,结果显示不同时间点,Sham组大鼠肝脏组织结构完全保持有序,小叶结构完整、清晰,肝细胞以中央静脉为中心呈放射状排列,形成肝细胞索,细胞结构正常;而Model组在6h观察到小叶结构紊乱,肝细胞呈现明显肿胀变性,坏死明显,多形核细胞浸润,小叶内可见炎性细胞散在或灶状浸润,血管充血明显,至12h肝细胞大片坏死,坏死区红细胞堆积、炎细胞浸润明显。不同剂量的右美托咪定给药后,在不同时间点均明显缓解了肝小叶结构的紊乱、肝细胞的肿胀变性及炎细胞浸润等病理改变。
2.3不同时间点大鼠肝脏氧化应激指标变化:不同时间点大鼠肝脏氧化应激指标变化如表2。与Sham组相比,在不同时间点,Model组的SOD和GSH水平显著降低(P<0.05),MDA水平升高,差异有统计学意义(P<0.05)。与Model组相比,不同剂量右美托咪定干预后大鼠肝脏的SOD和GSH水平显著升高(P<0.05),MDA水平显著降低(P<0.05)。与Dex-L组比较,Dex-H组MDA在各个时间点均更低(P<0.05),SOD在各个时间点更高(P<0.05)。组内比较,在12h时,Model大鼠肝脏中的GSH水平较6h时显著降低(P<0.05),MDA水平升高(P<0.05);不同剂量右美托定组大鼠GSH水平,12h较6h时显著升高(P<0.05),MDA显著降低(P<0.05)。
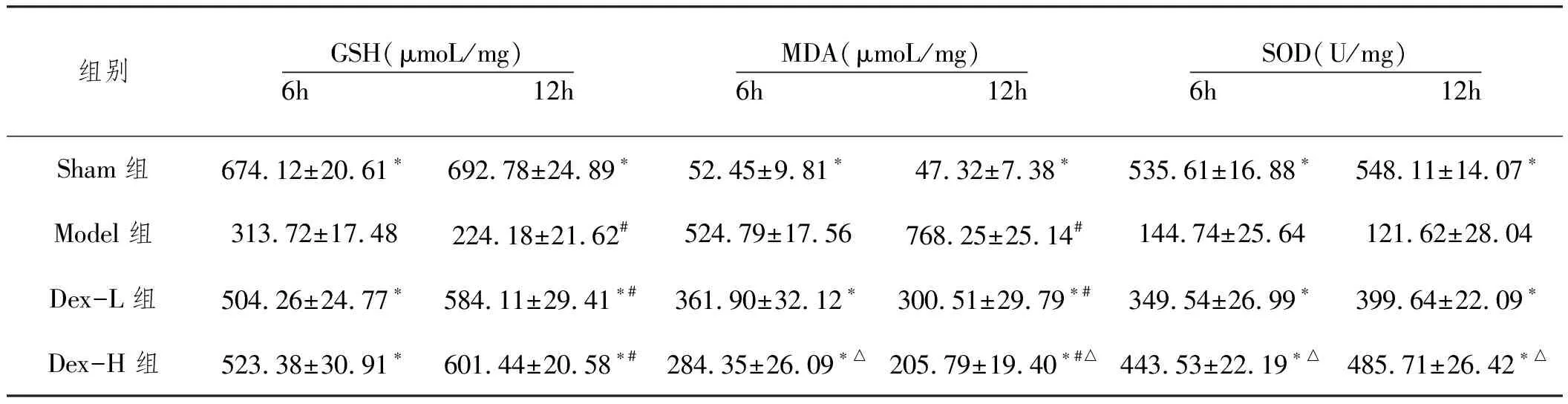
表2 各组大鼠GSH MDA SOD的对比
2.4大鼠肝脏PI3K/AKT/CREB信号通路比较:Western Blot检测不同组别大鼠的肝组织PI3K/AKT/CREB蛋白水平见图2,结果表明Model组6h时,PI3K蛋白量较Sham组显著增高( P<0.05),12h时PI3K,pAKT和CREB蛋白水平均显著增高( P<0.05)。与Model组比较,6h和12h时,不同剂量右美托咪定干预后PI3K,pAKT和CREB蛋白水平均显著增高( P<0.05)。与Dex-L组比较,Dex-H组的PI3K蛋白量12h时更高( P<0.05);pAkt和CREB蛋白量在6h和12h均显著增高( P<0.05)。
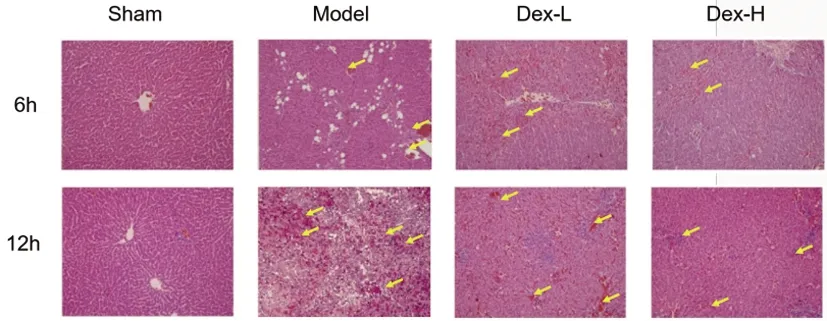
图1 各组大鼠肝脏HE染色(200×)
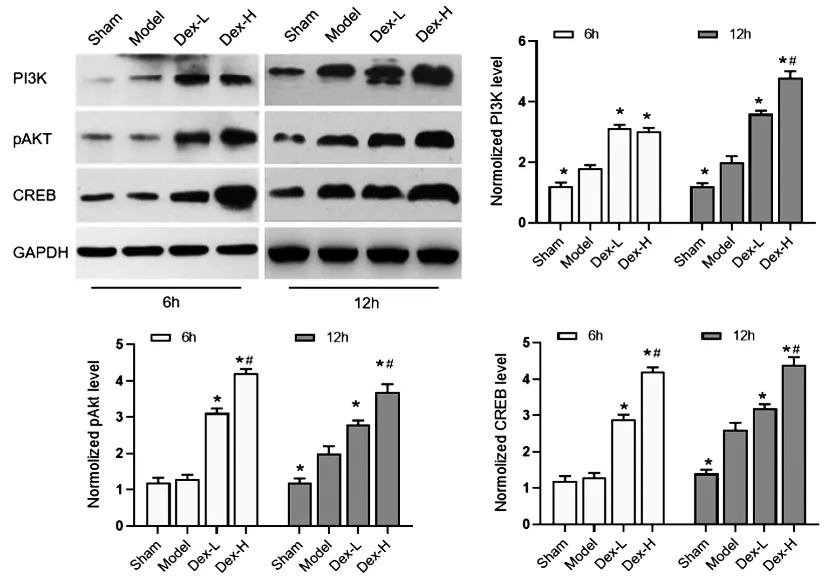
图2 各组大鼠肝脏PI3K/AKT/CREB信号通路比较
2.5大鼠BAX、Bcl2相对表达量比较:PCR检测大鼠肝脏组织BAX、Bcl2相对表达量,结果如图3。与Sham组相比,模型组BAX和Bcl2的表达量明显升高,差异有统计学意义(P<0.05)。与Model组相比,不同剂量右美托咪定干预后BAX表达量明显降低,Bcl2表达量明显升高,差异有统计学意义(P<0.05)。Dex-H组与Dex-L组比较,6h时,Dex-H组 Bcl2表达量较高(P<0.05);12h时,Dex-H组BAX表达量较低,Bcl2表达量较高,差异有统计学意义(P<0.05)。

图3 各组大鼠BAX、Bcl2相对表达量比较
3 讨 论
肝I/R损伤是肝切除术或肝移植中的一种常见并发症,与术后肝脏无功能、肝衰竭发病率,以及死亡率密切[1]。由于肝I/R损伤导致的不良结局一直是临床实践中一个未解决的难题,严重制约了肝移植和肝切除术的发展。肝I/R损伤可分为三个不同的病理时间节点,首先是缺血阶段:肝细胞的损伤程度在此阶段不断累及扩大;其次是再灌注阶段:当供体恢复血液循环,甚至暴露于常氧条件下可迅速发生,此阶段炎性因子及过氧化物大量释放进一步加重肝细胞损伤;最后是后损伤阶段:在此阶段发生原位巨噬细胞激活及循环炎细胞浸润,加剧了肝脏的炎症反应及凋亡[5]。
右美托咪定是一种高度选择性α2-肾上腺素受体激动剂,主要用于麻醉后监护室和神经重症监护室的镇静和镇痛[6]。右美托咪定对几种重要器官,如肝脏、心脏、大脑和肾脏的缺血再灌注损伤均具有保护作用[7]。近来的研究表明,在肝脏I/R损伤中,右美托咪定可以降低炎性因子水平,上调Bcl2表达抑制肝细胞凋亡[8]。本研究通过建立大鼠肝脏I/R损伤模型观察右美托咪定的干预作用,结果表明I/R损伤6h时既出现小叶结构紊乱,肝细胞明显坏死;随着时间的推移,肝脏病理程度逐渐加重,而使用不同剂量的右美托咪定干预后,肝脏病理特征在不同时间点均有所改善;此外右美托咪定也可以降低大鼠血清中ALT、AST的水平,以上结果从病理学和血清学两个方面证明了右美托咪定对肝脏I/R损伤的保护作用。
文献报道了右美托咪定可以通过α2-肾上腺素受体激活PI3K/Akt通路,降低靶器官的氧化应激水平,抑制细胞凋亡,参与缺血/再灌注的保护过程[9]。本研究结果显示右美托咪定干预后显著降低了大鼠血清中的氧化应激相关指标,但其保护肝脏I/R损伤是否通过PI3K/Akt通路尚不明确,因此本研究检测了PI3K和Akt的蛋白磷酸化水平,结果表明右美托咪定干预不同时间点后,PI3K和Akt的蛋白磷酸化水平显著升高,证明了PI3K/Akt通路的激活。PI3K/Akt 通路是参与调节细胞存活、增殖和分化的最重要通路之一,可被包括生长因子、激素、药物等所激活,CREB是PI3K/Akt通路的下游靶点,也是调控氧化应激水平和细胞凋亡的关键转录因子[10]。以往的数据表明,Akt是参与肝脏I/R损伤的关键分子,通过药物干预PI3K/Akt通路可以在一定程度上缓解肝脏I/R的病理表现[11]。本研究结果表明,右美托咪定干预不同时间点后CREB的蛋白水平均有不同程度的升高。此外,本研究进一步检测了凋亡信号标记物BAX,Bcl2的基因表达水平,结果表明右美托咪定干预不同时间点BAX mRNA水平显著降低,Bcl2 mRNA水平显著升高,说明凋亡信号受到了抑制。
综上所述,右美托咪定可显著改善肝脏I/R损伤模型大鼠的肝脏病理学和血清学指标,抑制氧化应激反应和凋亡标记物,其作用机制可能与激活PI3K/AKT/CREB信号通路有关。本研究为肝脏I/R损伤的机制研究和临床治疗提供了药理学依据,但肝脏I/R损伤参与的通路众多,还有待进一步研究。

