ATP敏感性钾通道型先天性高胰岛素血症患儿临床及遗传学特征
惠培培 徐子迪 张琳 曾俏 刘敏 闫洁 吴玉筠 桑艳梅 朱逞 倪桂臣 李荣敏 王杰英
1徐州医科大学附属医院儿科,徐州 221000;2国家儿童医学中心,首都医科大学附属北京儿童医院内分泌遗传代谢科,北京 100045;3北京儿童医院保定医院内分泌科,保定市儿童医院,儿童呼吸消化疾病研究重点实验室,保定 071000
先天性高胰岛素血症(congenital hypein-sulinism, CHI)是一种遗传异质性疾病,是婴幼儿和儿童时期顽固性、持久性低血糖的主要原因,其特点是顽固性低血糖及与血糖水平不相称的高胰岛素血症。随着研究的不断进展,迄今已发现了至少14种基因突变与CHI有关,相应地构成13种遗传学类型[1-3]。ATP敏感性钾通道型先天性高胰岛素血症(adenosine triphosphate-sensitive potassium channel hyperinsulinism, KATP-HI)是CHI最主要和常见的类型,由编码磺脲受体 1(sulfonylurea receptor 1, SUR1)的ABCC8基因和编码内向整流钾通道蛋白6.2(inward rectifying potassium channel,Kir6.2)的KCNJ11 基因突变引起。本研究总结及分析45例中国KATP-HI患儿的临床特征及携带的致病基因,旨在提高临床医师对该类型CHI的认识。
资料与方法
一、研究对象
选取2002年2月至2018年12月间首都医科大学附属北京儿童医院内分泌科收治的45例经遗传学确诊为KATP-HI的患儿及其家系为研究对象。本研究经医院伦理委员会批准,所有患儿父母均签署知情同意书。
二、诊疗过程
入院后45例患儿均确诊为CHI。CHI的诊断标准[4]包括高胰岛素血症(血浆胰岛素>2 mU/L)、低脂肪酸血症(血浆游离脂肪酸<1.5 mmol/L)、低酮血症(血浆β-羟丁酸<2.0 mmol/L)、1 mg静脉胰高血糖素试验反应血糖变化>0.3 g/L。
39例患儿应用二氮嗪进行试验性治疗,以5 mg·kg-1·d-1为起始剂量,每日2~3次口服,根据患儿病情逐渐增加剂量,最大剂量为15 mg·kg-1·d-1,疗程7~10 d。同时加用氢氯噻嗪利尿1~2 mg·kg-1·d-1,每日2~3次口服,以防止二氮嗪导致的水钠潴留,并予10%氯化钾1~2 ml·kg-1·d-1,每日3次口服,以防止氢氯噻嗪导致的低钾血症。二氮嗪治疗有效的判断标准[3,5]:患儿禁食12~18 h后血糖水平仍可维持在70 mg/dl(3.9 mmol/L)以上,或者血糖水平降至50 mg/dl(2.8 mmol/L)之前出现高酮血症(血浆β-羟丁酸>2.0 mmol/L)。如果应用二氮嗪最大剂量治疗5 d仍不能满足上述标准,则考虑为二氮嗪治疗无效[6]。二氮嗪治疗无效或疗效不确定的患儿中,18例进一步应用奥曲肽治疗,以5 μg·kg-1·d-1为初始剂量,间隔6 h或8 h皮下注射1次,根据患儿病情逐渐增加剂量,最大推荐剂量为20 μg·kg-1·d-1。奥曲肽疗效的判断标准同二氮嗪。部分内科治疗无效的患儿,通过胰腺切除术进一步控制血糖水平。
三、遗传学分析
1.血液DNA提取:留取患儿及其父母的乙二胺四乙酸钠抗凝静脉血3 ml,使用BloodGen Midi Kit(CWBIO,中国) 提取血中全基因组DNA,操作按照试剂盒说明书进行。
2.二代测序:采用IDT公司xGen Exome Research Panel v1.0捕获芯片。首先进行文库制备。(1)基因组片段化,Cavoris仪打断DNA片段至200 bp左右;(2)末端补平修复,片段化DNA经Klenow Fragment、T4 DNA polymerase和T4 PNK携带进行补平修复;(3)3′端腺苷化,应用聚合酶体系在补平修复产物的3′末端加上A碱基;(4)加接头,应用T4 DNA连接酶反应体系,在Thermo mixer中室温反应一定时间将dadpter连接到加“A”的产物;(5)扩增,连接产物经4~6轮PCR扩增;(6)杂交,PCR扩增产物与探针混于杂交体系,置65℃杂交60~68 h;(7)洗涤磁珠和洗脱DNA,杂交样本加入链霉素磁珠,孵育后用洗脱液洗脱;(8)洗脱产物扩增,洗脱产物经10轮LM-PCR扩增。然后进行Illumina平台测序。扩增产物经Illumina hisep xten平台标准化测序操作获取图像原始数据,通过Illumina官方baseball分析软件BclToFastq进行数据分析,并对突变假阳性进行过滤。
3.一代测序(Sanger法)验证:二代测序发现患儿携带ABCC8或KCNJ11基因突变,根据基因所验证位点序列设计引物,采用PCR方法进行扩增,用ABI 3730XL测序仪测序,测序引物采用原PCR引物;采用DNASTAR软件进行基因序列分析和比对。参照单核苷酸多态性数据库(dsSNP)和千人组基因库排除非致病性变异,并通过搜索在线人类孟德尔遗传数据库(OMIM)、人类基因突变数据库(The Human Gene Mutation Database)、NCBI数据库等明确该突变是否曾经报道过。根据人类基因组变异软件Provean、SIFT预测基因突变对蛋白结构的影响。
四、随访情况
对45例患儿进行6个月~10年的长期随访,主要随访内容包括患儿药物治疗、药物不良反应、术后转归、低血糖发作、空腹血糖及餐后2 h血糖、自行缓解等情况。CHI自行缓解的判断标准[7]:采用二氮嗪治疗的患儿停止口服二氮嗪至少5 d,空腹18~48 h(依年龄而定),血糖水平可维持在70 mg/dl(3.88 mmol/L),或者出现高酮血症(血浆β-羟丁酸>2.0 mmol/L)。
结 果
一、临床特征
45例KATP-HI患儿中男性26例,女性19例。出生体重1.8~5.0 kg,其中正常体重儿22例(48.9%),巨大儿22例(48.9%),低出生体重儿1例。发病年龄为出生当日~ 2岁,其中新生儿期发病34例(75.6%),1~6个月发病8例,>6个月发病3例。21例首发症状为抽搐,13例为反应弱,2例为多汗,1例为肌张力低,1例为面色青紫,7例无明显临床症状。1例患儿有低血糖家族史,其姐姐5岁时出现低血糖症状,后诊断为CHI。
二、诊疗效果
39例应用二氮嗪治疗的KATP-HI患儿中,12例(30.8%)治疗有效,16例(41.0%)治疗无效,另外11例患儿因二氮嗪治疗出现严重不良反应(血小板降低、严重的水钠潴留、不能耐受的胃肠道反应等)或家庭因素而终止二氮嗪治疗,故对二氮嗪疗效不明确。
二氮嗪治疗无效或疗效不确定而奥曲肽治疗应用的18例患儿,其中13例(72.2%)治疗有效,3例(16.7%)治疗无效,2例疗效不明确。
内科治疗无效的10例患儿行手术治疗,其中8例术前行18氟-左旋多巴正电子发射计算机断层扫描(18F-DOPA-PET)确定为局灶型病变的患儿行胰腺部分切除术;2例术前未行18F-DOPA PET扫描的患儿行次全胰腺切除术,术后病理检查结果显示1例为弥散型病变,1例为局灶型病变。
三、遗传学分析结果
45例KATP-HI患儿共发现52种ABCC8突变及2种KCNJ11突变,且经蛋白结构预测均可能有害或生物学危害性较高。10例携带ABCC8复合杂合突变(表1),34例只携带ABCC8或KCNJ11单基因突变(表2);1例男性新生儿出生后1 d发病,出生体重3.8 kg,血糖2.2 mmol/L,同时携带ABCC8基因(c.1775T>G)和KCNJ11基因(c.374T>C)突变,二氮嗪治疗有效。
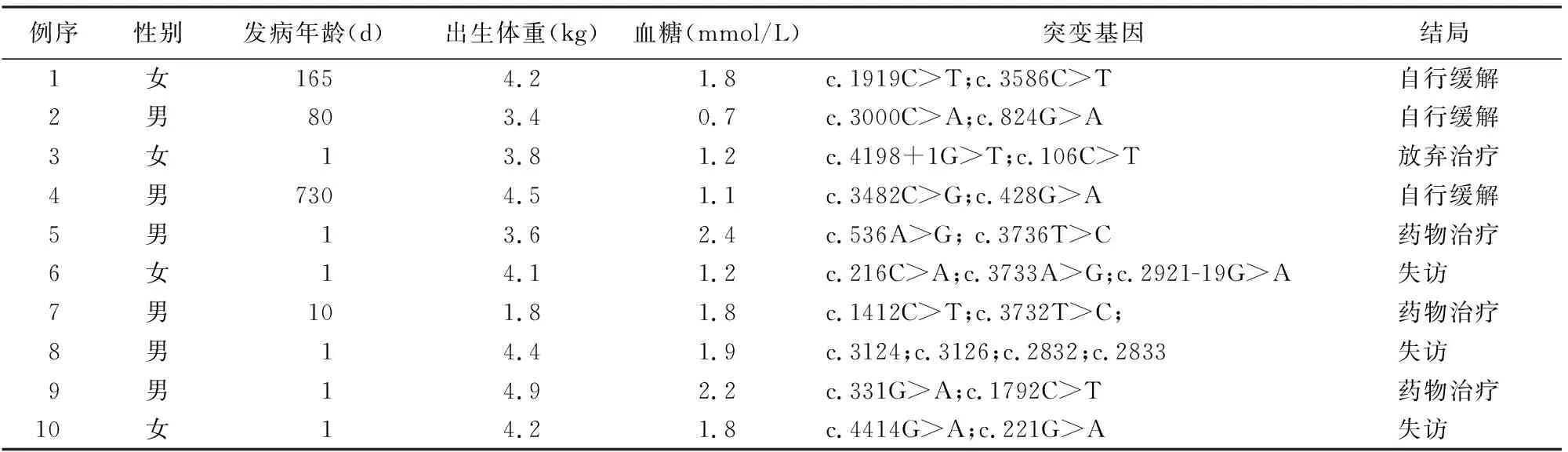
表1 10例ABCC8复合杂合突变的KATP-HI患儿临床特征及预后
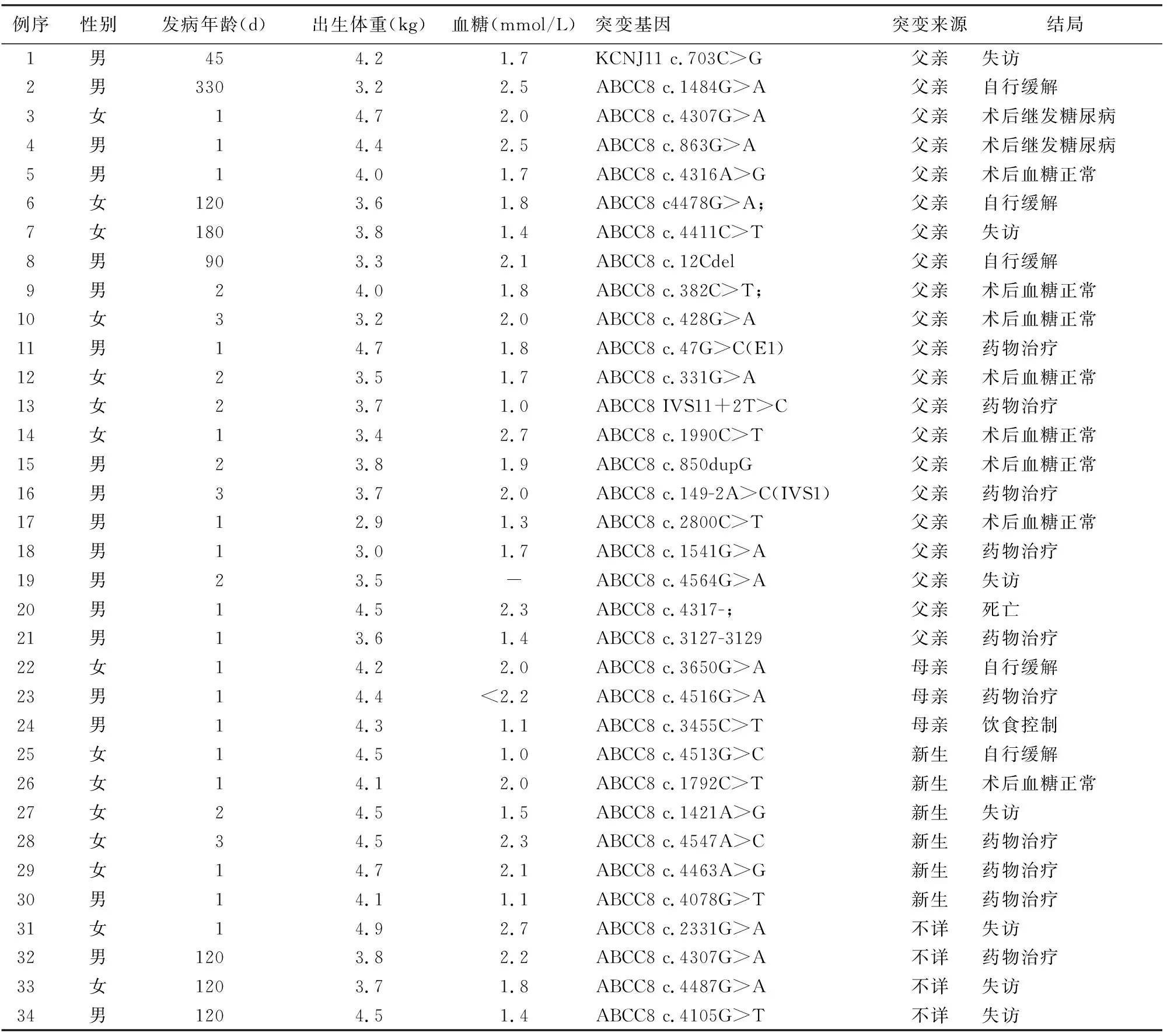
表2 34例ABCC8或KCNJ11基因单突变的KATP-HI患儿临床特征及预后
34例携带单个基因突变的患儿中21例突变来自于父亲,其中18例应用二氮嗪治疗,1例有效,7例无效,10例疗效不明确;3例突变来自于母亲,其中2例应用二氮嗪治疗,均有效,1例饮食控制血糖正常;新生突变6例,均应用二氮嗪治疗,3例有效,3例无效;4例突变来源不详。
四、随访结果
经长期随访,45例KATP-HI患儿中13例继续药物(二氮嗪或奥曲肽)治疗;8例自行缓解,缓解时间6个月~2岁,均为ABCC8突变,其中6例为单基因突变,2例为复合杂合突变;8例行胰腺部分切除治疗的KATP-HI患儿,术后血糖恢复正常;2例行次全胰腺切除术的患儿分别于术后第3年、第4年并发1型糖尿病;1例频繁喂养下未出现频繁低血糖;1例放弃治疗;11例失访;1例因呼吸道感染死亡。
讨 论
KATP-HI是CHI最常见类型,是由于ABCC8及KCNJ11基因缺失性突变导致的。KATP-HI患儿发病较早,多见于新生儿期。既往文献报道,新生儿期发病者约占83%[8],本研究45例KATP-HI患儿中新生儿期发病者占75.6%,与文献报道基本一致。KATP-HI患儿中巨大儿占比较高,本研究的巨大儿约占48.9%,与文献报道的45.3%接近[8]。
二氮嗪是CHI的一线治疗药物,该药为钾通道开放剂,能与KATP敏感性钾通道的SUR1亚单位结合,使钾通道处于开放状态,从而抑制胰岛素的分泌。研究资料显示,二氮嗪治疗对多数KATP-HI患儿无效(62.0%~86.8%),机制与KATP-HI编码钾通道的基因出现不同程度的功能缺失性突变有关[8-9]。本组39例患儿曾予二氮嗪治疗,无效率高达41.0%,稍低于文献报道,考虑与部分患儿疗效尚未明确有关。绝大多数二氮嗪治疗无效的CHI患儿奥曲肽治疗效果较好。本组对二氮嗪无效或疗效不确定的18例患儿进一步选择奥曲肽治疗,有效率高达72.2%,与既往文献报道一致。
对内科治疗无效的CHI患者可考虑行胰腺切除术。国外文献建议的手术指征为内科治疗无效的CHI患儿或经18F-DOPA-PET确定为局灶型病变的患儿[10]。2019年美国的一项研究报道246例行胰腺部分切除术治疗的局灶型CHI患儿,97%术后获得治愈,仅7例仍需要通过药物控制低血糖。本组8例行胰腺部分切除术的患儿均获得治愈,说明局灶型CHI行胰腺部分切除术有较高的临床治愈率。次全胰腺切除术的常见并发症主要有反复低血糖、糖尿病和外分泌功能不全,本组2例行次全胰腺切除术的患儿均继发糖尿病,表明术前明确病理类型对手术方式的选择及预后评估极为重要。
研究显示, CHI 患儿随着年龄的增长及其对胰岛素需要量的增加,其低血糖症状可有所减轻,部分患儿可自愈。国外研究报道,约48%CHI患儿的低血糖可自行缓解,且自行缓解的时间跨度为3个月~8岁,自行缓解的患儿中约15%是KATP-HI,4%分别为其他类型基因突变[11]。本组8例患儿自行缓解,时间跨度为6个月~2岁。说明应适当延长 CHI 患者的随访时间,对二氮嗪治疗无效的 CHI 患者应谨慎选择手术治疗,从而尽可能减少手术并发症的发生。
随着研究的进展,迄今已发现448种ABCC8突变,66种KCNJ11基因突变[12]。携带ABCC8基因复合杂合突变的KATP-HI患儿发病时间多较早,组织学类型均为弥散型病变[1],少数患儿对二氮嗪治疗有效,绝大多数对奥曲肽治疗有效[13-14]。本组10例携带复合杂合突变的KATP-HI患儿中9例曾应用二氮嗪治疗,仅3例有效,5例无效患儿进一步应用奥曲肽治疗,其中4例有效。提示携带ABCC8复合杂合突变的CHI患者多对二氮嗪无效,与文献报道一致[13,15]。研究发现,94%携带ABCC8或KCNJ11基因单一杂合隐性突变患儿的胰腺组织学病变为局灶型,如果突变遗传自父亲,则病变类型为局灶型的可能性上升至98%[16]。隐性遗传的KATP-HI患儿临床低血糖症状多较重,且多对二氮嗪治疗无反应。携带ABCC8或KCNJ11基因单一杂合显性遗传患儿的胰腺组织学类型多为弥散型,临床症状较隐性遗传者轻,且绝大多数二氮嗪治疗有效,这与显性遗传的ATP敏感性钾通道有部分功能相关[16]。本组7例携带ABCC8父系遗传的患儿均为局灶型,均对二氮嗪治疗无效,后行胰腺部分切除术,术后随访,在无药物治疗下血糖均正常。根据患儿的临床表现、二氮嗪治疗情况及组织学类型考虑这7例患儿为常染色体隐性遗传,但因未对胰腺病灶进行微卫星标记分析,暂不能证实母系11p15.1染色体等位基因的缺失。
既往研究发现,母系遗传的携带单个ABCC8或KCNJ11基因突变的CHI患者中巨大儿多见,主要于婴儿期发病,临床症状较父系遗传的隐性突变的CHI患儿轻,多对二氮嗪治疗有效,对二氮嗪试验性治疗无反应者可给予奥曲肽,均治疗有效,迄今尚未见此类患者行手术治疗。文献报道此类患者遗传方式多为常染色体显性遗传,组织学类型多为弥散型[16-17]。本研究的3例母系遗传患儿均为巨大儿,其中2例应用二氮嗪治疗,均有效,1例饮食控制血糖正常,符合文献报道的母系遗传KATP-HI的临床特征。
新生突变所致的KATP-HI遗传方式为常染色体显性遗传,组织学类型多为弥散型,部分对二氮嗪治疗无效[13,17]。本研究6例新生突变,均应用二氮嗪进行治疗,其中3例有效,3例无效。无效患儿中1例曾行18F-DOPA PET,结果显示为局灶型,后行胰腺部分切除术治愈,1例予以奥曲肽治疗后血糖稳定,1例失访,提示新生突变所致的KATP-HI临床症状轻重不一,局灶型CHI可能有着更为复杂的遗传学机制。
Rozenkova等[18]曾报道1例同时携带ABBC8(p.Tyr1293Asp)及KCNJ11(p.Arg50Trp)突变的患儿,突变基因分别来自其父亲和母亲,足月顺产,出生体重4 kg,生后第1天发病,临床症状较轻,对二氮嗪无效但对奥曲肽治疗有效,并于2岁半时自行缓解。本研究也发现1例同时携带ABBC8(p.L592R)及KCNJ11(p.I125T)突变的患儿,足月顺产,出生体重3.8 kg,出生后第1天发病,对二氮嗪治疗有效。患儿现5岁,仍口服二氮嗪治疗,血糖可维持在正常范围内,提示同时携带ABBC8及KCNJ11基因突变的CHI患者发病均较早,临床症状较轻,且均对药物治疗有效。
综上所述,KATP-HI患者发病多较早,临床症状轻重不一,多数对二氮嗪的治疗无效,而奥曲肽的疗效较好。局灶型病变患者行胰腺部分切除术治疗具有较高的治愈率,次全胰腺切除术有继发糖尿病的风险,故术前明确患者的胰腺组织学类型极为重要。部分KATP-HI患儿有自行缓解的可能,故可以适当延长随访时间,谨慎选择手术治疗。携带ABCC8基因复合杂合突变的KATP-HI患儿发病时间早,均为弥散型病变。携带ABCC8或KCNJ11单个基因突变的父系遗传的KATP-HI患儿,隐性遗传者的胰腺组织学类型多为局灶型,临床低血糖症状较重,多对二氮嗪治疗无反应;显性遗传者的胰腺组织学类型多为弥散型,临床症状较轻,绝大多数对二氮嗪治疗有效,这可能与显性遗传的ATP敏感的钾离子通道有部分功能相关。
利益冲突所有作者声明无利益冲突
作者贡献声明惠培培:论文撰写、统计分析;徐子迪、张琳、 曾俏:采集数据、数据整理;刘敏、闫洁、吴玉筠:分析数据;朱逞、倪桂臣:获取材料支持;桑艳梅:研究指导、论文修改

