B细胞异位基因2在胰腺癌组织中的表达及临床意义
袁中电 吴红伟 沈丰 孙少华 武伦 高嘉良 刘一魁 周文波
1锦州医科大学国药东风总医院研究生规培基地肝胆胰外科 ,十堰 442000;2湖北医药学院附属国药东风医院肝胆胰外科,十堰 442000
B细胞异位基因(B cell translocation gene)家族,即BTG家族,作为公认的抑癌基因,被发现于上世纪90年代,BTG2是该家族中首个被鉴定并定位的抑癌基因[1]。BTG2的N-末端结构域包含两个保守的基因系列,被命名为A盒基因序列和B盒基因序列,其中A盒具有抗增殖的作用,将细胞捕获在G1/S期[2],而B盒则可以与许多靶分子结合,参与细胞分裂、DNA修复、转录调控和信使RNA的稳定性等过程[3-4]。BTG2在人体组织中广泛表达,在胰腺、前列腺、肺等器官中高表达。近几年研究证实,BTG2在肝癌[5]、前列腺癌[6]等多种肿瘤组织中表达下调,其作为一种抑癌基因在肿瘤细胞的增殖、分化以及DNA损伤修复中起重要作用。但其是否参与胰腺癌的发生和发展鲜有报道。本研究通过检测BTG2在胰腺癌组织中的表达情况,探讨其在胰腺癌中的作用机制及临床意义。
资料与方法
一、一般资料
收集2015年6月至2020年12月间湖北医药学院附属东风总医院病理科石蜡封存的46例胰腺癌组织、对应的癌旁组织及肝胆胰外科9例行手术切除的新鲜胰腺癌组织、对应的癌旁组织(距肿瘤边缘2 cm以上),记录患者的年龄、性别、CA19-9水平、肿瘤大小、肿瘤位置、分化程度、是否血管侵犯及淋巴结转移等。
二、胰腺癌及癌旁组织BTG2蛋白表达检测
采用免疫组织化学染色法检测石蜡封存的胰腺癌组织及癌旁组织BTG2表达情况。将46例胰腺癌组织石蜡标本制成厚度为4 μm切片,按照试剂盒说明书进行操作。兔抗人 BTG2抗体购自英国abcam公司,工作浓度1∶50,山羊抗兔IgG二抗购自上海碧云天生物技术有限公司,工作浓度1∶200。由两名病理科医师盲法独立阅片,胞质中出现棕黄色或者褐色颗粒定为BTG2表达阳性细胞。根据BTG2染色深度及阳性细胞百分比进行评分:无染色计0分,浅黄色计1分,棕黄色计2分,棕褐色计3分;阳性细胞比例<10%计1分,10%~50%计2分,51%~75%计3分,>75%计4分。两者得分相乘,积分≥4分为高表达,<4分为低表达[7]。依据BTG2表达水平,将46例胰腺癌组织及癌旁组织分为高表达组和低表达组。
三、胰腺癌及癌旁组织BTG2基因表达量检测
采用荧光定量PCR法检测9例新鲜胰腺癌组织及癌旁组织BTG2的表达量。取9例液氮冻存胰腺癌及癌旁组织,解冻后用Trizol提取组织总RNA,紫外线分光光度仪测定RNA纯度及浓度。先将RNA逆转录成cDNA,按反转录试剂盒说明书操作,荧光定量试剂盒购自英国abcam公司。BTG2正向引物序列为5′-CATCATCAGCAGGGTGGC-3′,反向引物序列为5′-CCCAATGCGGTAGGACAC-3′;内参GADPH正向引物序列为5′-CCGGGAAACTGTGGCGTGATGG-3′,反向引物序列为5′-AGGTGGAGGAGTGGGTGTCGCTGTT-3′。所有引物由上海生工生物工程股份有限公司设计并合成。RT-PCR反应条件: 50℃ 2 min、95℃ 2 min,95℃ 15 s、60℃ 15 s、72℃ 59 s,40个循环。通过PCR仪器自带软件获取扩增产物的Ct值,采用公式2-ΔΔCt计算组织BTG2相对表达量。每个样本重复实验3次,取平均值。
四、随访
患者出院后通过来院复查随访或进行电话随访。随访截至 2020年12月31日,随访时间为75~835 d,中位随访时间为387 d。
五、统计学处理
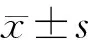
结 果
一、胰腺癌及癌旁组织BTG2表达
BTG2蛋白在胰腺癌组织及癌旁组织中均为弥散性胞质表达(图1)。46例胰腺癌组织中BTG2高表达29例(63.04%),低表达17例(36.96%);对应癌旁组织中BTG2高表达38例(82.61%),低表达8例(17.39%),癌旁组织BTG2高表达率显著高于癌组织,差异有统计学意义(χ2=4.45,P=0.035)。

图1 BTG2蛋白在胰腺癌组织(1A)和癌旁组织(1B)中的表达 (免疫组织化学 ×200)
9例胰腺癌组织中3例为高分化,6例为中低分化。高分化胰腺癌组织BTG2表达量显著高于中低分化癌组织(0.66±0.07比0.24±0.18),癌旁组织表达量显著高于癌组织(1.00±0.00比0.38±0.30),差异均有统计学意义(t值分别为5.15、-7.32,P值均<0.001)。
二、BTG2蛋白表达水平与胰腺癌患者临床病理特征的关系
46例胰腺癌组织BTG2阳性表达率与肿瘤分化程度、血管侵犯有关,而与肿瘤位置、肿瘤长径、CA19-9水平、淋巴结转移、术后肝转移无关(表1)。
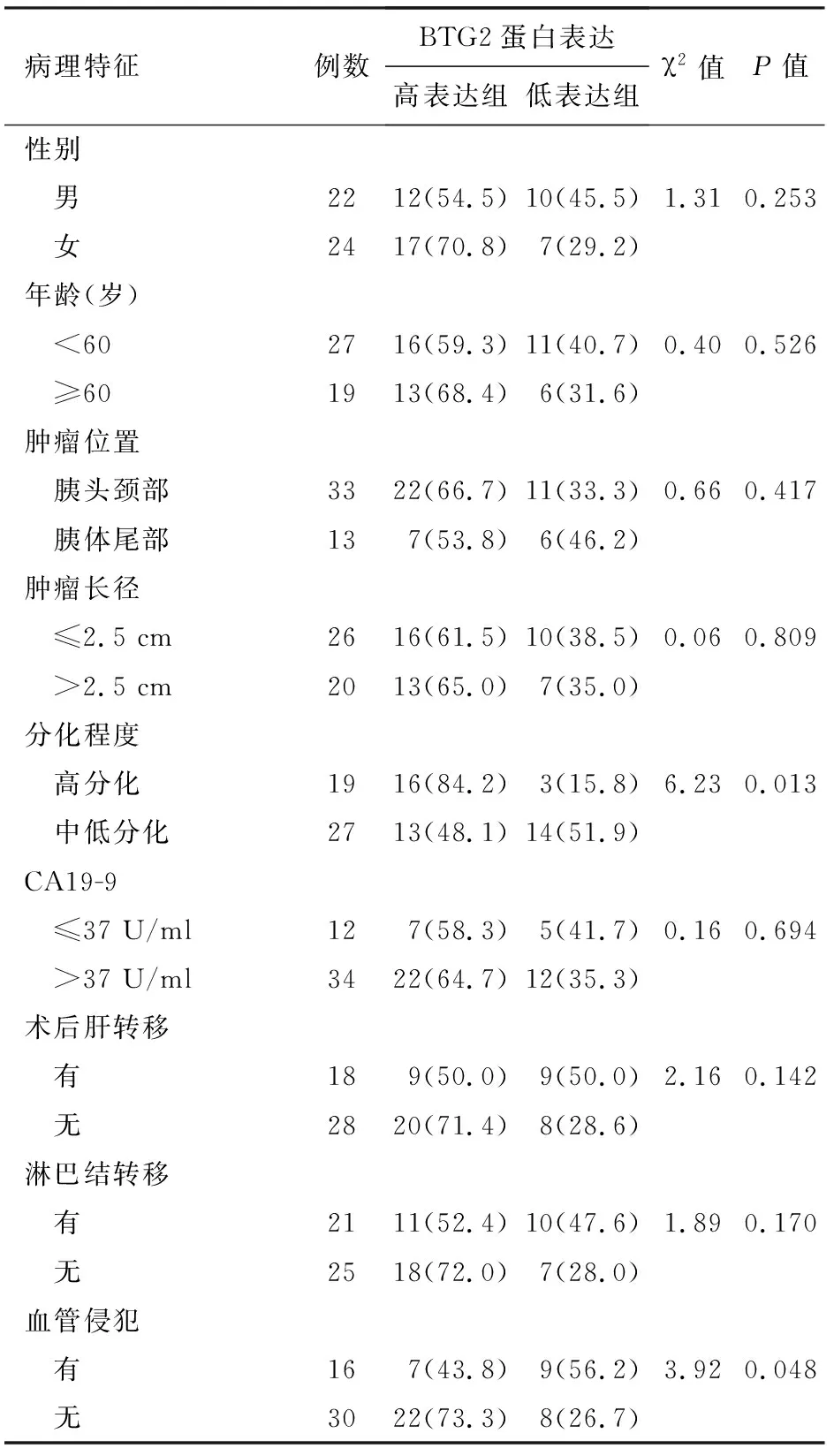
表1 46例胰腺癌组织BTG2蛋白表达水平与临床病理特征的关系[例(%)]
三、BTG2蛋白表达水平与胰腺癌患者预后的关系
BTG2高表达组中位生存期为525 d,BTG2低表达组中位生存期为266 d,差异有统计学意义(P<0.001,图2)。死亡风险曲线图显示,生存<300 d患者BTG2高表达组与低表达组生存时间差异无统计学意义[(179±69)d比(160±72)d,t=0.58,P=0.571];生存≥300 d患者BTG2高表达组生存时间显著长于BTG2低表达组[(616±135)d比(426±113)d],差异有统计学意义(t=3.50,P<0.001,图3)。单因素分析结果显示,肿瘤分化程度、CA19-9水平、血管侵犯、术后肝转移、BTG2表达水平是影响胰腺癌患者预后的因素;多因素Cox模型分析结果显示,BTG2表达水平、血管侵犯、术后肝转移是影响胰腺癌患者预后的独立危险因素(表2)。
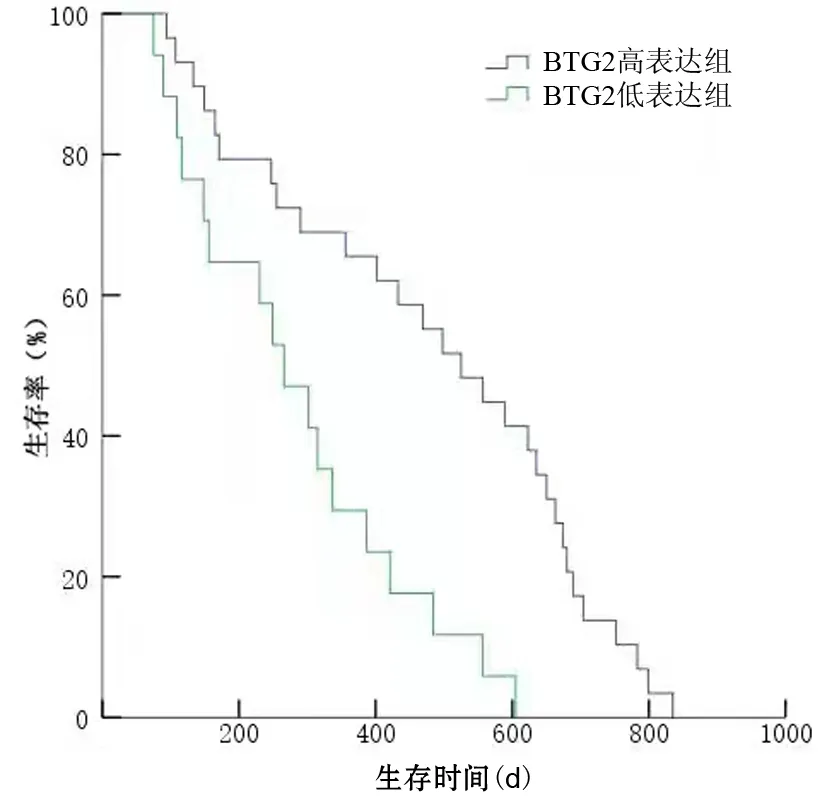
图2 BTG2蛋白表达水平与胰腺癌患者生存时间的关系
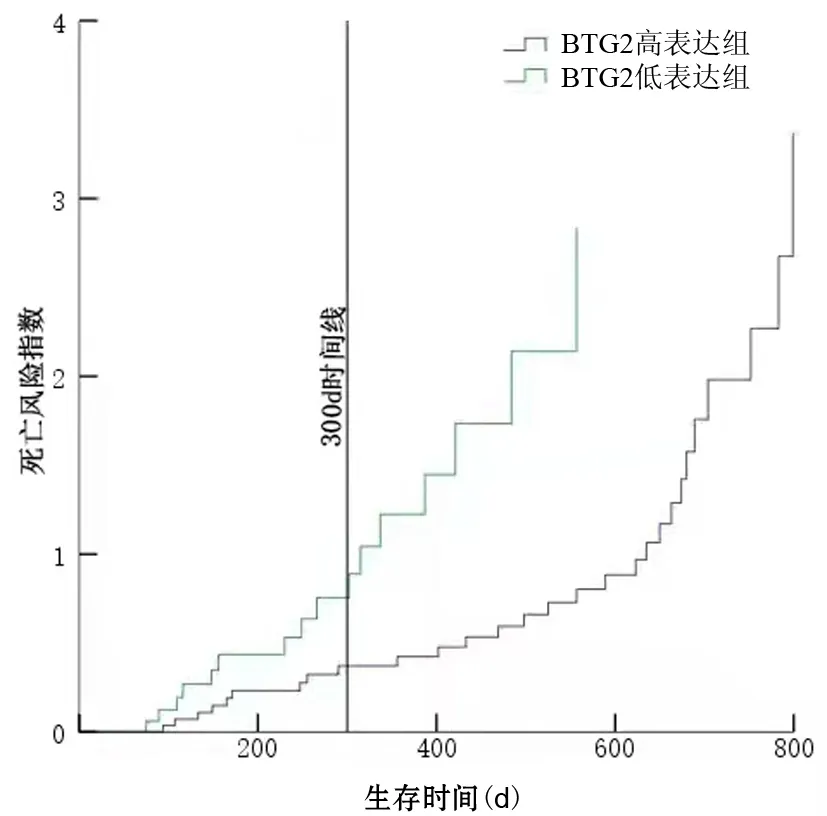
图3 不同BTG2蛋白表达水平胰腺癌患者的死亡风险曲线
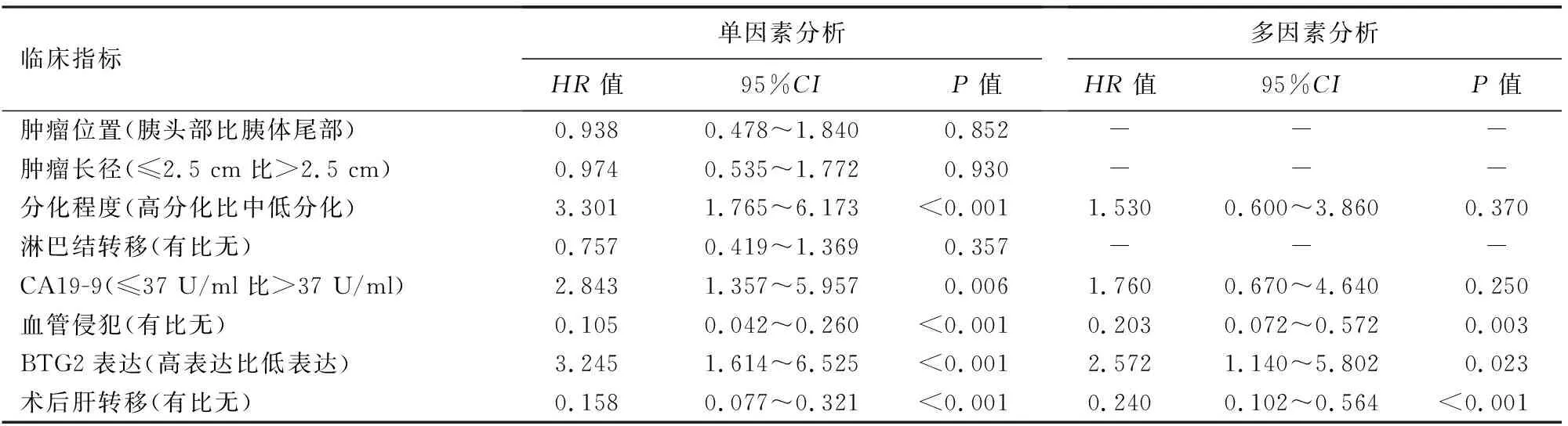
表2 46例胰腺癌患者预后的单因素及多因素分析
讨 论
BTG2位于1号染色体长臂的3区2带上,共编码158个氨基酸,最初被鉴定为p53诱导基因,其表达受p53依赖机制的调控[8]。此外,BTG2也可以抑制cyclin E的表达,并在无p53、Rb和cyclin D1参与下抑制细胞G1/S期的跃迁[9]。研究证实,肺癌[10]、喉癌[11]、乳腺癌[12]等多种肿瘤组织BTG2表达均明显下调,并通过多种途径参与肿瘤细胞的增殖、转移。本研究结果显示,胰腺癌组织BTG2表达阳性率及相对表达量显著低于癌旁组织,高分化胰腺癌组织表达量显著高于中低分化组织,提示胰腺癌BTG2表达明显下调,低表达是胰腺组织恶性表型的重要征象之一。
Devanand等[12]发现,BTG2可以通过抑制癌细胞的侵袭和转移,也可以通过表观遗传学沉默减缓肿瘤向周围组织浸润性生长,是治疗碱性螺旋-环-螺旋转录因子1高表达的转移性肿瘤的潜在靶标。本研究结果显示,BTG2低表达与肿瘤分化程度低、血管侵犯有关,提示BTG2可能是抗衡胰腺癌侵袭性的潜在靶点,与BTG2在骨肉瘤[13]、宫颈癌[14]的相关研究结果一致。
Zubair等[11]报道,实体肿瘤中BTG1或BTG2的表达降低通常与恶性细胞行为和不良治疗结果相关,其基因产物的表达情况可作为疾病进展的生物标记。文献报道,BTG2蛋白的表达水平可作为多种癌症的预后生物标志物,比如三阴性乳腺癌[15-16]、喉癌[17]、肝癌[18]。Wang等[19]报道,BTG2表达水平是影响食管鳞状细胞癌患者预后的独立危险因素,BTG2的下调可用作鉴定和预测食管癌进展和放射敏感性的分子标志物。本研究结果显示,BTG2高表达组中位生存期显著长于BTG2低表达组,提示BTG2高表达能显著改善患者预后,术后300 d后BTG2低表达组患者死亡风险随生存时间延长显著高于高表达组,说明BTG2对胰腺癌预后的影响主要发生在远期。单因素分析结果显示,肿瘤分化程度、CA19-9水平、血管侵犯、术后肝转移以及BTG2表达水平均与预后有关。多因素分析结果显示,血管侵犯、术后肝转移、BTG2表达水平为影响胰腺癌患者预后的独立危险因素,即BTG2低表达提示预后较差。
综上所述,BTG2在胰腺癌组织中表达下调,与胰腺癌的恶性生物学行为相关,BTG2表达水平是影响胰腺癌患者预后的独立危险因素,其影响主要发生在远期。但本研究纳入BTG2定量分析例数较少,且缺乏表观遗传学研究,尚需大样本以及纳入更多因素的研究予以进一步验证。
利益冲突所有作者声明无利益冲突
作者贡献声明袁中电:实验设计、实验操作、数据统计、论文撰写;吴红伟、孙少华、沈丰:实验指导、统计学分析;高嘉良、刘一魁:数据统计;周文波、武伦:研究指导、论文修改、经费支持

