TMAO通过CD147/MMPs通路诱导巨噬细胞活化
刘奇林, 薛 毅, 赖晓辉, 杜大勇, 柳 杨, 张 涛, 李运田,*
(1)南方医科大学第二临床医学院, 广州 510000;2)中国人民解放军第三O五医院心脏中心, 北京 100010)
在动脉粥样硬化(atherosclerosis, AS)进展过程中,例如斑块发生破裂,出现其内容物的释放、血栓的形成将导致血管急性堵塞,引起心肌梗死等严重后果。在临床上,稳定斑块、延缓斑块进展也是预防心血管事件发生的基础治疗,在临床治疗上具有重要地位[1]。斑块稳定性目前认为主要与以下因素相关:较大的脂质核心、较薄的纤维帽、斑块微钙化、斑块内新生血管及出血、斑块内炎症因子的表达、斑块表面血栓形成等[2,3],涉及多种细胞包括巨噬细胞、中性粒细胞等多种细胞的相互影响[4]。巨噬细胞可在炎症、氧化应激等多个方面参与AS进程并促进斑块进展[5,6],在斑块稳定性方面,其也具有重要调控作用。活化的巨噬细胞能够通过分泌基质金属蛋白酶(matrix metalloproteinases, MMPs)降解斑块纤维帽主要成分——胶原蛋白,使得纤维帽变薄,较薄的纤维帽则更容易在剪切力的作用下发生破裂[7],导致心血管不良事件的发生。MMPs与其上游调控因子金属蛋白酶诱导因子(extracellular matrix metalloproteinase inducer, CD147),也被认为是能够有效的调控胶原蛋白的合成及降解的重要通路[8]。
如今越来越多的研究发现,肠道菌群在心血管疾病中扮演重要角色[9],氧化三甲胺(trimethylamine N-oxide, TMAO)作为肠道菌群代谢产物,可通过多种途径促进AS的进展[10-12]。近来在临床研究中发现,急性心肌梗死患者血浆TMAO浓度显著高于正常人[13];通过光学相干断层扫描观察斑块也发现,高血浆TMAO患者较正常水平患者更容易发生斑块破裂[14]。以上研究均提示,TMAO与斑块不稳定可能存在密切联系。
而参阅相关文献发现,针对TMAO对斑块稳定性的研究目前主要集中在临床研究,对其分子机制却探讨较少。本文通过建立小鼠巨噬细胞RAW264.7细胞模型,研究TMAO对巨噬细胞分泌斑块稳定性相关因子CD147、MMP2、MMP9的影响及其机制。
1 材料与方法
1.1 材料
小鼠白血病巨噬细胞RAW264.7,引自中科院上海细胞生物研究所细胞库。胎牛血清(fetal bovine serum, FBS)购自Gibco公司,β-肌动蛋白抗体购自中杉金桥,CD147抗体、基质金属蛋白酶2抗体、基质金属蛋白酶9抗体购自Abcam公司,Lipofectamine RNAiMAX siRNA转染试剂盒、CD147 siRNA(含阴性对照siRNA)购自Thermo公司,TMAO购自Merck公司,RT-qPCR试剂盒、RNAiso PLUS购自TaKaRa公司。其他生化试剂均为中科迈晨公司提供或国产分析纯。
1.2 小鼠巨噬细胞RAW264.7培养
RAW264.7细胞在含10%胎牛血清、双抗(青霉素100 U/mL、链霉素100 U/mL)的DMEM中,37 ℃、5% CO2培养箱常规培养,定期观察细胞状态及细胞密度,镜下观察RAW264.7细胞铺满培养瓶瓶底时,进行细胞换液传代。
1.3 MTT检测细胞活性
取对数期生长良好的RAW264.7细胞接种于96孔板中,每孔加入含血清的细胞悬液100 μL,细胞数量约2×104细胞/孔,空白对照孔用无血清培养基填充。将TMAO按预设浓度剂量加入各孔,使得实验孔的终浓度分别为150 μmol/L、300 μmol/L,并设置零孔,设3复孔。将细胞置于37 ℃、5% CO2培养箱中孵育6 h。随后,往各孔中加入20 μL MTT溶液,继续于培养箱中孵育4 h,吸取孔内培养液。后往,各孔内加入150 μL二甲基亚砜,置摇床上低速震荡30 s,使结晶溶解充分。最后,在酶标仪中测试各孔在560 nm处吸光值。
1.4 siRNA转染
将RAW264.7细胞接种至6孔板内,待细胞铺满孔内约70%时,根据Thermo公司Lipofectamine RNAiMAX试剂盒说明书方法,将CD147 siRNA(siCD147)与转染试剂混匀后加入6孔板内,孵育5 min。继续于孵箱中培养24 h,对细胞进行相应检测。同时设立阴性转染组和细胞对照组。
1.5 RT-qPCR
应用RNAiso PLUS分离试剂总RNA,用分光光度计检测260 nm~280 nm处A值,确定提取RNA纯度及浓度。所提取的RNA按日本TaKaRa公司生产的RT-qPCR试剂盒说明书操作进行扩增,并以β肌动蛋白作为内参,采用相对定量法计算结果,引物序列见Table 1。CD147、MMP2、MMP9、β-肌动蛋白参考有关文献,由上海生工公司合成(Table 1)。
1.6 Western印迹
使用RIPA裂解液提取各组细胞总蛋白质,用BCA蛋白质定量试剂盒进行蛋白质定量检测。加5%脱脂奶粉室温孵育1 h,与CD147、MMP2、MMP9、β-肌动蛋白等一抗置4 ℃冰箱过夜,抗体滴度参考说明书。经TBST漂洗后加入辣根过氧化物标记二抗(山羊抗小鼠IgG)并于室温下孵育1 h,ECL化学发光显影,在凝胶发光仪中拍照并测目的蛋白质和内参β-肌动蛋白灰度值,以目的蛋白质与β肌动蛋白灰度值的比值为目的蛋白质的相对表达量。
1.7 统计学方法

2 结果
2.1 氧化三甲胺(TMAO)对巨噬细胞存活率的影响
根据相关文献报道,高浓度TMAO可能对巨噬细胞有毒性作用。因此,首先证实研究设置浓度的TMAO是否对于细胞活性有影响。实验用0 μmol/L、150 μmol/L、300 μmol/L的TMAO处理RAW264.7细胞24 h,使用MTT法检测细胞活性。结果显示,与0 μmol/L相比较,经150 μmol/L、300 μmol/L的TMAO刺激后,细胞存活率无显著差异。因此,TMAO浓度在300 μmol/L以下时,对细胞的活性未见明显的影响(Fig.1)。
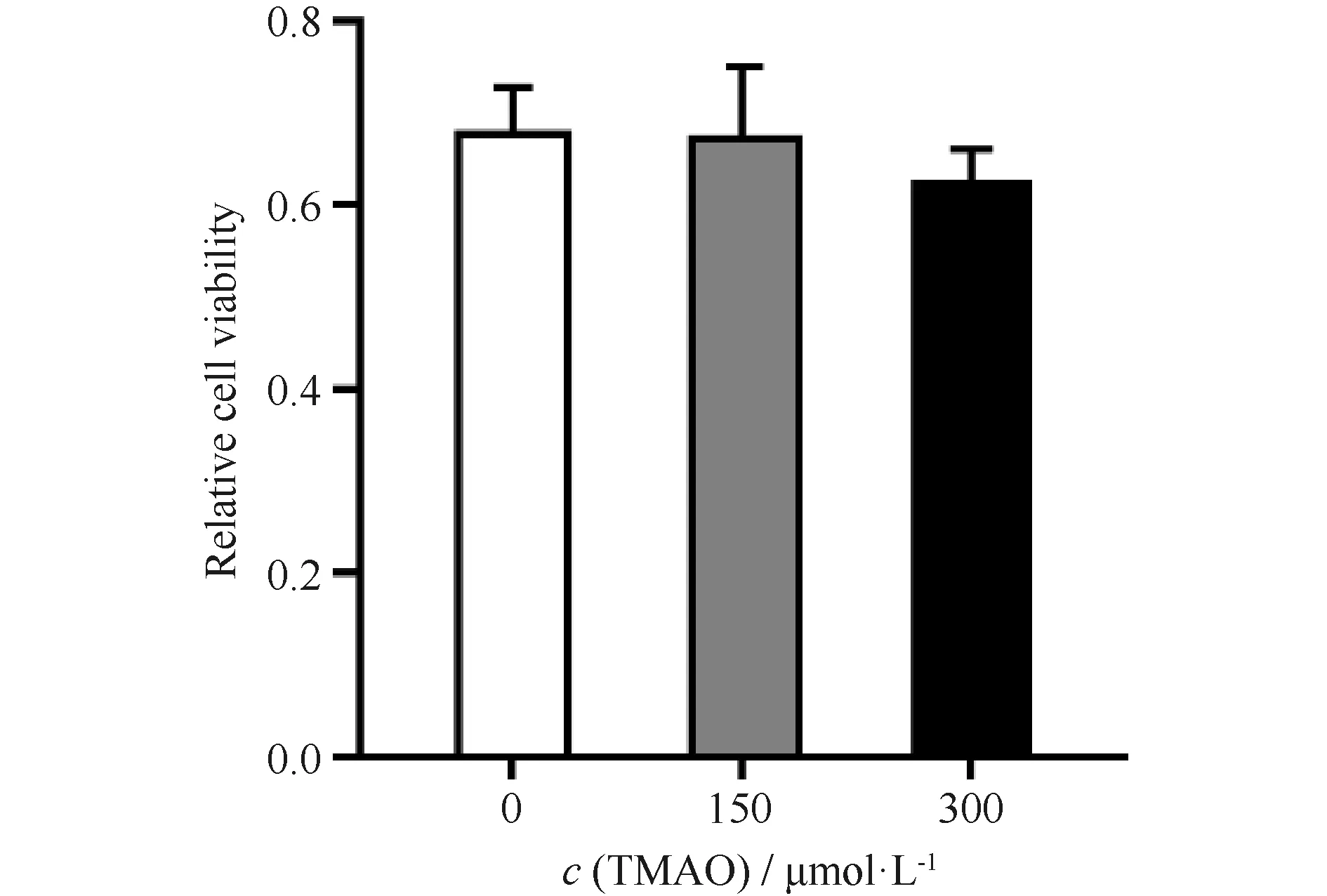
Fig.1 TMAO concentration below 500 μmol/L did not affect cell activity The activity of RAW264.7 cells treated with different TMAO (0 μmol/L, 150 μmol/L, 300 μmol/L) was detected by the MMT experiment. Data are expressed as mean ± SD (n=3). *P<0.05 vs TMAO-free group
2.2 经氧化三甲胺诱导后CD147、基质金属蛋白酶2、基质金属蛋白酶9的表达增强
观察通过TMAO刺激后,RAW264.7细胞表达斑块稳定性相关因子的表达情况。通过参阅相关文献资料,将TMAO浓度梯度定为0、150、300 μmol/L,运用RT-qPCR及Western印迹技术,检测CD147、MMP2、MMP9的表达。结果显示,通过与TMAO共培育24 h,MMP2、MMP9的mRNA表达呈显著增加,并呈现一定剂量依赖关系,而CD147在mRNA水平上并未出现明显变化(Fig.2)。在蛋白质水平上,CD147、MMP2、MMP9表达则均显著增强(Fig.3)。该结果提示,TMAO能够促进RAW264.7细胞表达MMP2和MMP9,并可能在转录后水平增加CD147的表达。

Fig.2 TMAO upregulates the expression of MMP2 and MMP9 mRNA in RAW264.7 cells (A, B, C) RT-qPCR was used to detect the mRNA expressions of CD147, MMP2, and MMP9 in RAW264.7 cells stimulated by different concentrations of TMAO (0 μmol/L, 150 μmol/L, 300 μmol/L). Data are expressed as mean ± SD (n=3). *P<0.05 vs TMAO-free group

Fig.3 The protein expression level of CD147, MMP2, and MMP9 has increased in TMAO-induced RAW264.7 cells (A, B) RAW264.7 cells were stimulated with TMAO (0 μmol/L, 150 μmol/L, 300 μmol/L) for 24 hours and Western blotting was used to detect the expression. Data are expressed as mean ± SD (n=3). *P<0.05 vs TMAO-free group
2.3 氧化三甲胺通过CD147参与了基质金属蛋白酶2、基质金属蛋白酶9的调控
为了进一步研究CD147是否作为上游调控分子参与了TMAO诱导巨噬细胞表达调控斑块稳定性相关因子MMP2与MMP9,本研究使用siCD147转染RAW264.7细胞,探讨CD147/MMPs在细胞表达中的机制。研究使用siCD147转染RAW264.7细胞,设置阴性对照组,运用RT-qPCR验证其转染效率(Table 2)。随后,将转染模型分别与TMAO(浓度为0、150、300 μmol/L)共培育24 h,并设置对照组(经TMAO浓度为300 μmol/L刺激的RAW264.7细胞),分析其表达情况。结果显示,经siCD147转染处理后,无论从mRNA还是从蛋白质水平,CD147、MMP2、MMP9表达均被显著抑制(Fig.4)。结果提示,TMAO在巨噬细胞中,上调MMP2、MMP9的作用可能部分是通过CD147/MMPs通路实现的。

Table 2 RAW264.7 cells were effectively transfected by siCD147
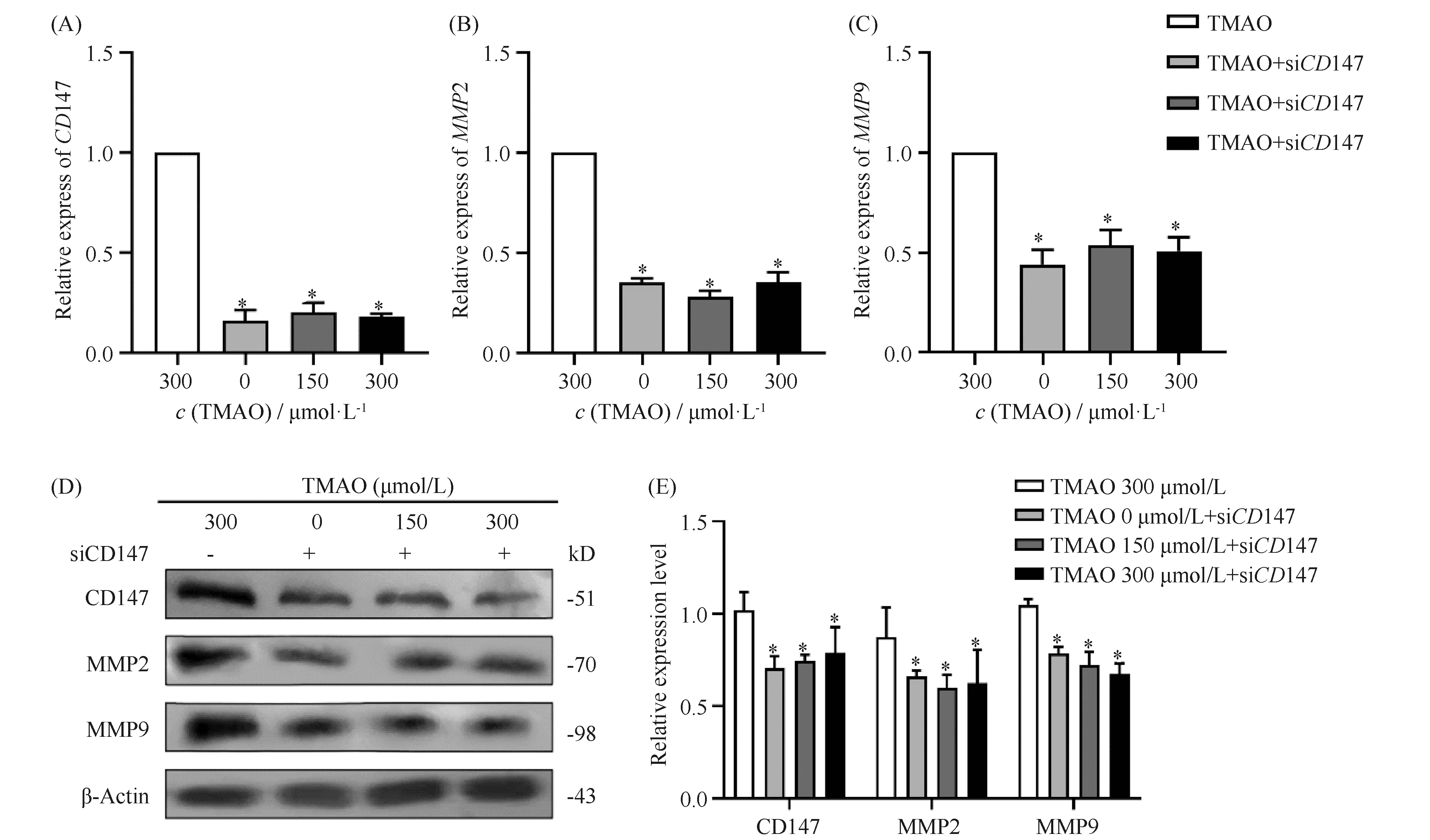
Fig.4 The silencing of CD147 inhibited the expression of MMP2 and MMP9 in RAW264.7 cells (A-C) After RAW264.7 cells were treated with different concentrations of TMAO (0 μmol/L, 150 μmol/L, 300 μmol/L) for 24 hours, the mRNA expressions of CD147, MMP2 and MMP9 were detected by RT-qPCR. (D, E) Western blotting assays were used to detect the protein levels of CD147, MMP2, and MMP9 after treatment with different concentrations of TMAO (0 μmol/L, 150 μmol/L, 300 μmol/L) in RAW264.7 cells. Data are expressed as mean ± SD (n=3). *P<0.05, compared with the group of TMAO 300 μmol/L without siCD147 treatment
3 讨论
易损斑块的形成是多种细胞相互作用的结果,而巨噬细胞在斑块稳定性中发挥重要作用,其可通过分泌炎症因子、细胞黏附因子等维持炎症微环境以及MMPs等促进易损斑块的形成[15,16],最终导致心源性猝死等心血管不良事件的发生。因此,各种因素导致巨噬细胞的活化是促进斑块进展的关键所在,研究其作用机制对于AS的防治具有重要价值。
肠道菌群现被认为积极参与了心血管疾病,其代谢产物TMAO能够积极促进AS疾病的进展[17]。近期研究发现,TMAO能够诱导炎症反应的发生,引起包括白介素1-β、肿瘤坏死因子-α等促炎因子表达[18],进而促进单核细胞迁移转化为巨噬细胞;此外,TMAO还能通过上调巨噬细胞清道夫受体(CD36、SR-A1)加速其向泡沫细胞转化的进程[19],这提示TMAO可作为影响物质直接参与了动脉粥样硬化进程。同时,在临床研究中也发现,TMAO与斑块稳定性存在密切联系[20,21],但对其分子机制却探讨较少。本文首先通过使用TMAO与小鼠巨噬细胞共培养后发现,经TMAO刺激后,RAW264.7细胞在基因与蛋白质水平上增加了MMP2、MMP9的表达,而对于CD147,TMAO仅在蛋白质水平上调,但在基因水平上未见明显影响。这表明,TMAO可诱导巨噬细胞表达MMP2、MMP9,但可能在转录后水平增加了CD147的表达。以上结果提示,经TMAO刺激后,巨噬细胞表达MMPs增加,进而可能导致了斑块纤维帽变薄促进斑块朝不稳定方向发展。
进一步研究发现,将RAW264.7细胞经CD147 siRNA转染处理,再与TMAO共培育24 h,小鼠巨噬细胞表达CD147、MMP2、MMP9均受到抑制。表明TMAO上调巨噬细胞表达MMP2、MMP9可能部分通过诱导CD147的表达实现。这也提示,TMAO可以通过调节CD147/MMPs的表达参与调控细胞外基质的降解。
综上结果可推测,TMAO能够在基因及蛋白质水平上促进巨噬细胞分泌MMP2、MMP9,进而促进斑块不稳定化,并且该作用可能部分是通过CD147/MMPs这一通路实现的,但其是否通过其它信号通路途径对斑块稳定性有影响仍有待进一步研究。鉴于TMAO在AS的重要作用,抑制其生成可能在AS及相关疾病中发挥预防和治疗的作用,具有潜在的临床应用前景,这也要求我们有必要对其分子机制进行深入研究。

