核定位信号肽修饰的抗肿瘤纳米载药体系
李若瑾, 吴晓雪, 王 澈,2)*
(1)辽宁师范大学化学化工学院,辽宁 大连 116029;2)辽宁省生物技术与分子药物研发重点实验室, 辽宁 大连 116081)
肿瘤是威胁人类健康的重大疾病,提高抗肿瘤药物靶向性始终是抗肿瘤药物研发领域的热点[1]。功能化纳米载药体系的构建为解决这一难题提供了有力的工具。肿瘤治疗的效果在很大程度上取决于治疗药物向其细胞内最终靶标部位的递送效率。已经证明,肿瘤细胞核是化疗药物、基因治疗、自由基治疗和光热治疗等大多数抗肿瘤治疗策略的主要作用靶点[2]。传统的病毒载体尽管能够靶向细胞核,但使用病毒载体可能会导致病毒基因插入原癌细胞[3],破坏肿瘤抑制因子的表达或改变原癌基因的表达,对细胞的代谢活动产生影响,其生物安全性面临巨大挑战。近年来,核定位信号(nuclear localization signal,NLS)肽,作为一类能够识别并定位于细胞核的功能化多肽,由于其能够穿透生物膜并靶向细胞核,引起人们的广泛关注。NLS肽修饰的纳米载药体系作为一种非病毒药物载体,有望为新型细胞核靶向性抗肿瘤药物递送体系的构建提供新的思路。
1 核定位信号纳米载药体系的构建与组成
纳米载药体系作为一种药物载体,在炎症、神经保护和抗肿瘤等领域具有广阔的应用前景。它能作为抗肿瘤物质(例如化疗药物、寡核苷酸、光敏剂等)的运输工具,有效保护抗肿瘤物质在肿瘤细胞中不被降解[4]。应用纳米载药体系改善抗肿瘤药物疗效是当前纳米医学领域的热点。其中,用NLS肽修饰的功能化纳米载药体系,由于其独特的核靶向功能,可以将抗肿瘤物质直接递送至细胞核,从而极大提高抗肿瘤药物的疗效。NLS肽修饰的功能化纳米载药体系由NLS多肽、基本纳米粒子骨架以及抗肿瘤物质(化疗药物、小干扰RNA、DNA、活性氧等)组成。其构建策略也因其材料的不同而千差万别,其基本过程为,将需要装载的抗肿瘤物质利用动力学原理(例如吸附作用和渗透作用等)装载于纳米粒子表面或内部,通过共价键或离子键的方式将NLS肽与之组装构成一个复合物。
1.1 NLS纳米载药体系的构建
将NLS肽与纳米粒子骨架缀合通常采用的方法有自组装、静电作用和化学官能团连接等方法,从稳定性角度考虑,化学官能团连接是目前比较稳定而有效的方法[5-6]。多糖是一种良好偶联剂,其反应基团能偶联多肽,Han及其同事采用多糖作为交联剂,将谷氨酸、甘氨酸缀合于透明质酸胶束上,提高了载药体系在血清中的稳定性[7]。某些氨基酸具有特殊的官能团,对现有的NLS肽进行氨基酸改造会使NLS肽与材料连接。例如,目前许多实验室对现有的NLS肽进行半胱氨酸改造,通过二硫键将其缀合于材料表面来获得可以靶向细胞核的药物载体;另外,还能对现有的NLS肽进行组氨酸改造,利用组氨酸上的咪唑基与金属阳离子(例如Fe2+、Ni3+)形成配位化合物,也是一种可行的策略。这种带有NLS肽的纳米载药体系能较好地将以细胞核为主要作用靶点的抗肿瘤物质(例如放线菌素D、小干扰RNA、DNA及伊立替康等)递送至细胞核[8,9]。
1.2 NLS纳米载药体系的组成
1.2.1 核定位信号肽(NLS肽) 具有NLS序列且能通过与核膜上的NLS受体识别,定位于核区的多肽称为NLS肽。NLS序列分为经典核定位信号序列(classical NLS,cNLS)和非经典核定位信号序列(non-classical NLS, ncNLS)。cNLS是指含有1组或2组碱性氨基酸的序列,通常是富含赖氨酸K和精氨酸R的K-(K/R)-X-(K/R)序列,其介导的入核过程,通常需要输入蛋白-α/β(importin-α/β)的共同参与;而ncNLS不具备上述序列特征,并且其入核主要通过与importin-β家族受体的直接识别,不需要importin-α的参与。cNLS常见序列如Table 1[10-15]所示。

Table 1 Classical NLS
1.2.2 用于纳米载药体系构建的基本骨架 用于纳米载药体系构建的基本骨架有化学相对稳定的无机纳米材料(例如金、银、二氧化硅、金属氧化物等)和生物可降解的有机分子(例如高分子、壳聚糖、脂质体等)[6-9]。纳米载药体系的基本骨架的形式也多种多样,有胶束、囊泡、纳米凝胶、超支化高分子和实体纳米粒子和介孔纳米粒子等。通常要根据需要递送抗肿瘤物质的不同与细胞种属的不同来选择。
1.2.2.1 无机非金属纳米材料 无机非金属材料,例如介孔纳米二氧化硅(mesoporous silica nanoparticles,MSNs)、碳纳米管(carbon nanotubes,CNTs)具有比表面积大、表面改性大、吸附性强和易于修饰等特点,是作为药物载体骨架的优良材料[16,17],其多孔结构可装载化疗药物、核酸等抗肿瘤物质。例如,功能化的MSNs可装载抗肿瘤药物于其介孔中,Murugan及其同事将MSNs(比表面积390~561 cm2/g,孔径2.7 nm)微球作为纳米载药体系的基本骨架,用托泊替康(topotecan,TPT)对微球进行处理得到TPT-MSN,然后将TAT肽锚定在TPT-MSN上得到TPT-MSN-TAT,之后用带负电荷的聚丙烯酸(polyacrylic acid,PAA)-cRGD肽和柠檬酸酐(citric anhydride,CAH)-二甲双胍(metformin,MT)覆盖TPT-MSN-TAT的表面,在肿瘤细胞中溶酶体酸性环境的作用下MT释放到细胞质中,剩余的TPT-MSN-TAT则有效地靶向细胞核并递送TPT,使药物在细胞内实现了精准释放,并且HeLa细胞对不同粒径大小的TAT-MSN-TAT摄取情况为50> 67> 25> 105 nm[18]。CNTs是一种纳米级探针,其较大的比表面积为递送分子药物提供了机会,Serpell及其同事将NLS肽与CNTs缀合用以研究分子药物的入核机制[19]。
1.2.2.2 贵金属纳米材料 贵金属具有独特的光学和生物学等性能,被广泛用于抗肿瘤研究。例如,金纳米粒子(gold nanoparticles,GNPs)、银纳米粒子(silver nanoparticles,AgNPs)、铂纳米棒、金纳米笼和球形金纳米粒子可实现肿瘤细胞的光热消融[20-22]。基于贵金属材料可用于放射治疗,许多研究者提出了双靶向的纳米粒子-肽复合物的构建策略,将2个肽段偶联到金属纳米粒子上:1个肽段用于增强纳米粒子-肽复合物的细胞摄取,另1个肽段用来增强核的靶向传递,此方法提高了肿瘤细胞对贵金属放射治疗的反应性。Tkachenko及其同事以20 nm直径的GNPs为骨架,将牛血清白蛋白(bovine serum albumin,BSA)与NLS肽结合对GNPs进行修饰,制备出肽-BSA-GNPs复合物,在HepG2细胞中实现核靶向。为了确定肽-BSA-GNPs复合物被摄取后HepG2细胞的活力,他们进行了LDH比色毒性测定。结果表明,与对照组相比,HepG2细胞的存活率仅受到轻微损害(<5%)[23]。AgNPs可通过影响细胞的信号传导、细胞黏附、细胞代谢等功能来诱导细胞凋亡,NLS肽修饰于AgNPs可通过损伤肿瘤细胞DNA来诱导细胞凋亡,Austin及其同事研究出核靶向AgNPs通过使DNA双链断裂,进而使肿瘤细胞无法发生细胞分裂,最终导致细胞凋亡[24]。铂(Pt)类药物是许多恶性肿瘤的一线治疗药物,但其全身毒性限制了其临床应用[25]。NLS肽修饰Pt可进入细胞及细胞核,加剧Pt诱导的肿瘤细胞核损伤,在相同浓度下药效优于天然卡铂,增强了Pt(Ⅱ)治疗的效果并降低毒副反应[26]。
1.2.2.3 有机分子纳米材料 与无机物相比,有机质构成的纳米载药体系具有更好的生物相容性,且更容易降解。在过去,有机高分子例如聚苯乙烯、聚甲基丙烯酸甲酯等常用来构成纳米载药体系骨架,但这类物质会引起炎症反应和慢性毒性等副作用问题,所以目前研究者们多选择更具生物相容性和生物可降解性的有机聚合物,例如聚乳酸、壳聚糖和葡聚糖等。在有机质构成的纳米载药体系中,胶束、脂质体和具有高度支化树枝状结构的有机纳米粒子,在药物递送研究中发挥越来越重要作用,例如壳聚糖形成水凝胶纳米粒子,由于其高水含量具有较好的柔韧性和较高可塑性,脂质体具有高细胞相容性和包封率。众多研究表明,葡聚糖、姜黄素、紫杉醇等特性药物可联合聚乙烯亚胺(polyethylenimine,PEI)、聚酰胺基胺等树枝状聚合物,由共沉淀法制成胶束纳米粒以作为载药骨架[27]。
1.2.2.4 复合纳米材料 与单一纳米材料相比,复合纳米材料通常具有更好的溶解性和生物相容性,复合纳米材料结合了有机材料和无机材料的特点。有机质载药骨架的理化性质不稳定,通常在到达目标位置之前就会被降解。研究者们提出了有机质与无机质通过带有官能团的交联剂结合构成纳米载药体系的策略[28]。例如,透明质酸-氧化锌复合材料可诱导肺癌肿瘤细胞核发生形态变化,以达到抗肿瘤的作用[29]。使用有机聚合物包封的磁性颗粒、GNPs、介孔纳米颗粒和金属氧化物等无机纳米材料,在递送抗肿瘤物质的同时能够防止潜在核毒性物质的浸出,提高纳米载药体系的生物相容性和靶向性[30]。
1.2.3 纳米载药体系装载的抗肿瘤物质
1.2.3.1 化疗药物 化疗药物是一种能作用于肿瘤细胞不同生长繁殖期间,以杀死肿瘤细胞的抗肿瘤药物。其中,阿霉素(Doxorubicin,DOX)是一种常见抗肿瘤药物,以细胞核作为作用靶点。将DOX装载于纳米载药系统中,会在一定程度上避免多药耐药蛋白对DOX的外排,从而提高疗效。除此之外,常用于构建纳米载药体系的化疗药物还有培美曲塞、柔红霉素和卡莫司汀等,这些化疗药物主要通过影响细胞有丝分裂间期必须物质的合成来抑制肿瘤细胞增长[31]。
1.2.3.2 核酸类物质 治疗基因的有效核积累是基因递送过程中最关键的步骤之一,将NLS肽与核酸共价缀合可以赋予核酸进入细胞核的能力,发挥其抗肿瘤作用。核酸类药物主要分为具有不同功能的寡聚核糖核苷酸(RNA)和寡聚脱氧核糖(DNA),例如质粒、小干扰RNA、质粒DNA、转染DNA等具有干扰效应的物质[32,33]。Hao及其同事选择TAT肽(PKKKRKV)作为穿膜载体,将具有靶向内皮细胞的REDV肽与该TAT肽整合,在细胞中孵育1 h后荧光共定位相关系数为98.2 %,孵育4 h和12 h荧光共定位相关系数分别为85.7%和73.8%,说明该体系是具有内皮细胞特异性和细胞核积累能力的高效基因递送系统[34]。

1.2.3.4 其他物质 其他可被纳米载药体系装载的抗肿瘤物质还有中医药物、激素类药物、免疫治疗相关药物和蛋白质类药物等。中医药物常见的有姜黄素、紫杉醇、三七素和香豆素等。激素类药物例如三苯氧胺、托瑞米芬、依西美坦、氨苯乙哌啶酮、来曲唑和戈舍瑞林等。免疫治疗相关药物例如干扰素、环孢素、长春新碱和泼尼松等,通过影响细胞的免疫能力来杀死肿瘤细胞。蛋白质类药物有利妥昔单抗、曲妥珠单抗和胸腺肽类等。
2 核定位信号纳米载药体系的入核方式
真核细胞核膜上的核孔复合物(nuclear pore complex,NPC)是细胞核内外进行物质交换的主要通道。分子量大于50 kD的物质只能通过主动运输进入细胞核,所以此类物质上必须有特殊的NLS序列以被相应的核转运蛋白识别。许多研究者利用NLS肽协助外源粒子进入细胞核,以提高纳米载药体系的核定位效率。
纳米载药体系要实现核靶向递送通常需要满足以下要求:(1)能够通过各种途径和机制进入细胞;(2)逃避细胞内体/溶酶体的清除;(3)具有NLS序列与NPC相互作用;(4)或具有足够小的尺寸(一般<30 nm)以穿过核膜。
NLS肽修饰的纳米载药体系入胞过程如Fig.1所示:带有正电荷的纳米载药体系与表面带有丰富负电荷的肿瘤细胞识别,与细胞膜识别后通过内吞作用进入细胞,内化后纳米载药体系就会定位在细胞器(例如内体、溶酶体),通过酶响应、pH响应等途径从这些细胞器逃逸到细胞质后,通过NLS肽与核转运分子(例如importin-α/β)结合,最后通过NPC进入核内。
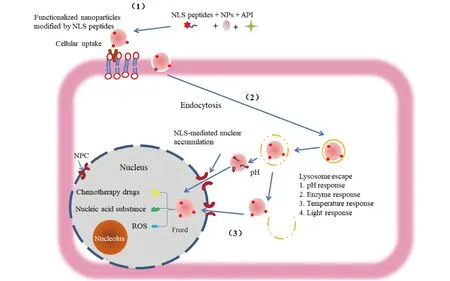
Fig.1 Nucleation process of functionalized nanoparticles modified by NLS peptides (1) The assembly of NLS peptide-modified functional nanoparticles. (2) The NLS peptide-modified functional nanoparticles are taken up by the cell and enter the cell through endocytosis. (3) NLS peptide-modified functional nanoparticles escape into the cytoplasm, The NLS peptide binds to nuclear transport molecules and finally enters the nucleus through NPC. NPs:nanoparticle. API:active pharmaceutical ingredient
3 影响纳米载药体系入核效率的因素
3.1 纳米载药体系的电荷与生物相容性
肿瘤细胞表面带有大量负电荷,诸多纳米载药体系无论是有机质还是无机质都要带有大量的正电荷与肿瘤细胞识别并为之摄取,通常会用含有大量伯胺阳离子的物质例如PEI、聚乙二醇(polyethylene glycol,PEG)、乳酸酐等来修饰无机纳米颗粒或合成胶束,这些富含阳离子的物质与NLS肽连接可提供大量正电荷,并且减少血管中物质对载药体系的排斥,提高生物相容性。
3.2 纳米载药体系的大小与形状
大量研究表明,虽然有机质纳米载药体系与生物质膜有较好的融合性更易被摄取,但粒径大小也不宜超过80 nm,其缺点是容易被降解稳定性较差。无机纳米载药体系一般不可超过50 nm,但由于其稳定性较好,常用于递送抗肿瘤物质。较大的纳米载药体系可在细胞分裂过程中定位于细胞核,它们可在M阶段的核膜破裂时进入细胞核,纳米载药体系的形状包括星型、球形和棒状等,其中棒状的入核效果较好[36,37]。
3.3 纳米载药体系上NLS肽的密度
有研究表明,随着纳米载药体系上NLS肽密度的增加,其核递送能力可能会增强,用NLS肽进行表面修饰可改善细胞对纳米载药体系的摄取,中等密度的NLS肽修饰可提高大粒径的纳米载药体系的核定位能力,但于较小粒径的纳米载药体系而言,NLS肽密度的增加反而会使其核靶向能力下降[38]。
综上所述,大多数纳米载药体系于细胞分裂M期定位于细胞核,在构建纳米载药体系时从抗肿瘤物质的抗肿瘤机制及其本身性质出发,选择合适的装载骨架,再修饰以NLS肽是一种普遍手法。例如金属氧化物为活性氧的良好载体,化疗药物等小分子物质多以多孔有高吸附能力的材料,例如介孔材料、顺铂等为载体,醇类物质多和支状有机物共沉淀为胶束纳米粒子,这为各类纳米载药体系构建提供了多样化的思路。
4 核定位信号纳米载药体系在活体肿瘤治疗中的研究现状
NLS纳米载药体系纳米材料与生物系统之间的相互作用,在增强纳米医学的功效和促进疾病诊断中发挥关键作用[39]。在过去的20年中,纳米医学取得了一定的进步,肿瘤周围的生理环境是开发生物响应性肿瘤纳米药物的基础。肿瘤自身的环境与其周围微环境有密切的关系,两者既相互依存又相互抗争,肿瘤细胞通过自身分泌以及促进旁分泌来改变环境,而全身以及局部组织也会通过免疫、内分泌以及代谢等限制和影响肿瘤的发展[40]。大多数肿瘤微环境都呈酸性,通过制备pH敏感型NLS纳米载药体系,可以使载药体系在肿瘤部位富集,然后进入肿瘤细胞,进一步靶向细胞核[41]。有些化学治疗剂例如鬼臼毒素的水溶性差且毒性高,不能用于活体肿瘤治疗。研究者们尝试将这类化学治疗剂与NLS肽和甲氧基聚乙二醇缀合,开发出一种复合物来降低其溶血性[42]。为了防止纳米载药体系与血液中的血清蛋白沉淀,研究者们通常用PEG等生物相容性较好的支状物去改善NLS纳米载药体系的血液相容性[41]。目前,关于核靶向功能化纳米载药体系的活体靶向研究尚处于起步阶段,关于这方面的报道鲜少,研究者们多从肿瘤微环境和肿瘤细胞膜受体入手来进行研究。
5 问题与展望
核靶向纳米载药体系的核内运输可通过与核孔复合物结合来触发,对纳米材料进行NLS肽功能化修饰不仅促进纳米材料进入肿瘤细胞,更重要的是可提高纳米载药体系的细胞核靶向性,进而提高药物抗肿瘤活性。此外,将具有特定生物学功效的活性NLS信号肽与化疗药物进行联合给药,还能表现出协同作用。因此,在递送药物、基因治疗等方面有非常广阔的前景,为抗肿瘤提供了新策略和更加高效的方法。然而,大多数核靶向纳米载体很难从实验转化到临床。目前,尚无FDA批准的核靶向纳米载药体系相关的药物,因为其复杂的制备和纯化过程阻碍了其大规模生产,且与已经上市的抗肿瘤药物相比,其疗效和生物相容性都有待提升[43]。人们需要继续对其入核机制进行深入的研究,开发出具有更高疗效,更低成本,更好生物相容性,更低毒性的纳米载药体系,并对其作用机制进行深入研究,为肿瘤治疗提供新思路。同时需要指出的是,目前功能化修饰的纳米载药体系,大多是单一化的功能修饰,例如通过多种靶向性配体例如叶酸、半乳糖衍生物、乳糖酸、RGD(arginine-glycine-aspartate)三肽以及转铁蛋白等修饰提高肿瘤靶向性,或通过NLS修饰提高细胞核靶向性,或通过装载小干扰RNA联合化疗药物克服肿瘤多药耐药。上述单一化的功能修饰通常不能同时兼顾肿瘤化疗的靶向性、核定位和多药耐药问题,而同时进行多种功能化修饰,工艺复杂且不同修饰策略之间可能会产生相互影响,干扰和降低功能化修饰的效果。因此,兼具肿瘤靶向性、细胞核定位和多药耐药逆转活性的多功能化NLS的发现,将会成为今后本领域研究的热点。

