骨调节蛋白作为潜在的胃癌预后标志物及免疫治疗新靶点
潘 凤, 彭红云, 聂佳琪, 张旭东, 李晓宁,崔海康, 杨 兰, 张文杰*
(1)石河子大学医学院病理系及第一附属医院病理科,新疆 石河子 832002;2)石河子大学医学院第一附属医院体检科,新疆 石河子 832002;3)石河子大学新疆地方与民族高发病教育部重点实验室,新疆 石河子 832002)
2019年,全球胃癌新发病例49 008例,年龄标准化发病率1.6/100 000,比1990年降低了30.9%。2019年,全球胃癌死亡病例27 895例,年龄标准化死亡率0.9/100 000,比1990年降低了46.8%[1]。胃癌发病率和死亡率降低取得这么可观的成就,无疑与3大因素有关:(1)健康教育的普及。使全社会对胃癌早诊早治的重要性提高了认识;(2)胃癌筛查新技术。胃镜筛查胃癌的敏感性高达88.6%[2],显著提高了胃癌的早诊;(3)胃癌治疗手段的提高。近年来,影像学技术指导下的外科手术、规范化的放化疗等都有了长足的进步,加上免疫治疗,例如免疫检查点调节剂、自然杀伤细胞免疫治疗和树突状细胞肿瘤疫苗等[3]。
过去的20年,尽管中国在胃癌的筛查和治疗上取得了很大进展,但中国胃癌年龄标化5年生存率在30%左右,远低于韩国和日本的60%左右[4]。5年生存率是指某种肿瘤经过各种综合治疗后,生存5年以上的比例。中国胃癌患者5年生存率低有2个主要原因:(1)早期诊断率较低。其原因是胃镜筛查技术要求高,价格贵,目前还难以在一级和二级医院作为大规模胃癌普查的手段。(2)胃癌早诊率低必然导致晚期癌患者多。而晚期癌患者多有远端转移,手术治疗效果不好,导致术后生存率低。迄今为止,晚期胃癌患者手术适应症无明确共识,目前也缺乏相关的大样本对照研究。如果将有远端癌转移而不适宜手术的患者进行手术治疗,那么,手术本身带来的巨大创伤以及可能的并发症,不但起不到治疗作用,反而可能使得患者因为晚期癌症以及手术创伤的“双重打击”而加速死亡。
因此,寻找一种能够在术前对晚期胃癌患者进行“术后”生存预后评估的方法和指标,从而为临床医生提供一种“手术适应症”作为参考。本课题组对小样本胃癌患者进行了初步研究,已经取得一些经验[5]。本研究借助基因表达公共数据库(GENE EXPRESSION OMNIBUS, GEO),对胃癌患者进行“术后”生存预后评估的方法和指标进行了大样本扩展研究,取得了2项主要成果:(1)首次发现骨调节蛋白(osteomodulin, OMD)在胃癌组织中高表达,且与胃癌患者术后不良预后密切相关。因为OMD可在术前进行检测,是术前评估胃癌患者术后生存的潜在生物标志物;(2)我们还发现,骨调节蛋白mRNA低表达组中静息状态下的树突状细胞浸润丰富,高表达组中嗜酸性粒细胞浸润丰富,且OMD与免疫增强剂ENTPD1及趋化因子CXCL12呈显著正相关。骨调节蛋白有望成为胃癌免疫治疗的一个新靶点。
骨调节蛋白是富含亮氨酸的小重复蛋白质,属于一个由17种分泌型细胞外基质蛋白质聚糖组成的家族[6]。一开始骨调节蛋白被认为是软骨细胞外基质中的丰富蛋白质,连接组织并分化成骨细胞[7]。细胞外基质是所有组织和器官的基本和核心组成部分,是多细胞生物存在的必要条件。从生物体发育的最初阶段直到死亡,它调节着身体的每个细胞的活动过程,例如生存、生长、迁移和分化,对维持正常的稳态至关重要[8]。胃癌多起源于黏膜上皮细胞,随着肿瘤的发生及发展,细胞外基质的组织也发生了重大变化,通常为维持上皮细胞的完整性提供了微环境。如果细胞外微环境维持正常,许多癌基因就不能引发肿瘤[9],这些研究进一步证明了细胞外基质中的蛋白质在胃癌发展中的重要性。最近,Papadaki 等[10]研究发现,OMD和富含脯氨酸/精氨酸的末端亮氨酸重复蛋白(recombinant proline arginine rich end leucine rich repeat protein, PRELP)在膀胱伞上皮细胞中选择性表达,并在膀胱癌中被抑制,OMD或PRELP敲除小鼠通过削弱细胞-细胞完整性和部分上皮间质转化的激活,从而导致伞状细胞层的破坏,早期膀胱癌样结构的形成,而OMD或PRELP高表达的膀胱癌细胞通过逆转上皮间质转化抑制了癌症的进展,这是由转化因子-β和表皮生长因子的抑制介导的,OMD和PRELP作为肿瘤抑制蛋白质通过抑制上皮间质转化发挥作用。然而,骨调节蛋白在胃癌中的作用至今仍未被报道。因此,本文通过多中心癌症公共数据库及在线网站挖掘胃癌中OMD的mRNA表达水平,及其与胃癌患者临床特征的相关性,评估了OMD的mRNA表达对于胃癌患者的潜在预后价值,探索OMD影响胃癌发生发展的机制。
1 材料与方法
1.1 数据集来源
从GEO数据库中筛选基因表达数据集,筛选标准:(1)必须为胃癌组织样本且数据类型必须为基因表达谱;(2)基因表达数据集的组织来源必须为人;(3)基因表达数据集的样本数量必须大于等于50例;(4)临床资料需有性别、年龄、临床分期、生存状况和生存时间等。基于以上筛选条件,最终筛选获到了3个基因表达数据集,编号分别为GSE26253、GSE26942和GSE13861,总计纳入31例正常样本和699例胃癌样本。胃癌样本中男性患者468(67.0%)例,女性患者231(33.0%)例;年龄23~83岁,平均年龄55.0(46.0, 63.0)岁。癌症发生于胃上部81(11.6%)例,胃中部233(33.3%)例,胃下部226(32.3%)例,混合部位159(22.8%)例;Lauren分型中弥漫型胃癌352(50.4%)例,类似肠上皮的肠型胃癌299(42.8%)例,混合型胃癌32(4.6%)例;美国癌症联合委员会(American Joint Committee on Cancer, AJCC)第六版分期中Ⅰ期131(18.7%)例,Ⅱ期215(30.8%)例,III期218(31.2%)例,IV期134(19.2%)例;死亡285(40.8%)例,生存414(59.2%)例,生存时间最长为167.6个月,平均生存时间为59.5个月。
1.2 与胃癌预后相关的基因筛选
首先,将编号分别为GSE26253、GSE26942、GSE13861平台文件和探针矩阵下载保存,因为平台文件中含有探针与基因名称的对应关系,所以根据平台文件将探针矩阵转变为基因矩阵。当1个基因对应多个探针时,通过取均值进行矫正。再依次将3个基因矩阵进行合并,形成新基因矩阵(简称为Merge)。最后,由于原来3个基因表达数据谱的平台文件不同,也就是说这3组数据谱来源于不同的实验室,研究过程中使用的仪器不同,实验人员的熟练程度也不同,甚至用到的实验试剂也不同,所以当本文得到新的基因矩阵后,通过“combat”包进行批次矫正来减少不必要的误差。再把基因矩阵与患者生存状态及生存时间等数据合并,通过Kaplan-Meier生存分析、Cox比例风险回归模型双重分析过滤筛选出与胃癌患者预后相关的基因。随后将基因矩阵与患者的临床信息,例如性别、年龄、Lauren分型、胃癌发生部位及临床分期等数据合并,利用R语言中的“survival”包过滤筛选出独立预后基因,最后再进行临床特征相关性过滤筛选。
1.3 qRT-PCR检测胃癌组织和癌旁组织中目的基因mRNA的表达量
收集2013年1月到2016年12月在石河子大学医学院第一附属医院行胃部肿瘤手术切除,经病理诊断为胃癌及癌旁正常组织(切缘距离癌灶边缘5 cm以外的正常组织)的石蜡包埋组织36对。每例胃癌和癌旁正常组织均进行复片(第二次诊断),且每例患者病理切片均经过至少2位病理学专家诊断。收集的所有胃癌石蜡包埋组织的患者术前均未进行放、化疗治疗,均为首次行胃部肿瘤切除术,术后胃癌组织切缘均未见癌细胞残留。采用TRIzol法提取总RNA,以GAPDH为参考基因,扩增目的基因。实验在96孔板中进行,每个样品3个复孔,并重复3次。引物序列如下:
OMDforward: 5′-AGGCTGTGTCAGTGAATGCTT-3′
OMDreverse: 5′-TGGGATAGTCTTGAGTTTGCGAT-3′
GAPDHforward: 5′-ACAACTTTGGTATCGTGGAAGG-3′
GAPDHreverse: 5′-GCCATCACGCCACAGTTTC-3′
1.4 Western印迹检测胃癌组织和癌旁组织中目的基因的蛋白质表达量
新鲜的胃癌和癌旁正常组织取自于2021年在石河子大学附属第一医院病理科明确诊断为胃癌,并接受胃癌根治术病例的术后病理标本。胃癌组织取材于术中胃癌癌灶组织,癌旁取材于距癌灶边缘至少 5 cm 以上的正常胃粘膜组织。将获得样本匀浆,使用强效RIPA裂解液(北京索莱宝公司)提取总蛋白质,使用美国NanoDrop分光光度计测定蛋白质浓度。再进行SDS-PAGE凝胶电泳,并将蛋白质转至PVDF膜上,使用含5%脱脂奶粉的TBST封闭液在室温下封闭2 h。将内参和目的条带分离后分别置于OMD(Abcam,稀释度1∶1 000)和β-肌动蛋白(β-actin)(北京中杉金桥生物技术有限公司,稀释度1∶2 000)一抗中4 ℃孵育过夜,吸净一抗并用TBST清洗,5 min × 6次。加入HRP标记的山羊抗兔IgG二抗 (北京中杉金桥生物技术有限公司,稀释度1∶10 000),室温孵育2 h,吸净二抗并用TBST清洗,5 min × 6次。最后用超敏ECL发光试剂盒(苏州宇恒公司)和化学发光成像系统(BioRad)进行曝光分析。以上均获得石河子大学医学院第一附属医院机构委员会批准,并获得患者知情同意。
1.5 基因集富集分析
进行基因集富集分析 (Gene Set Enrichment Analysis, GSEA)以鉴定目的基因潜在的生物学功能。根据目的基因在699例胃癌样本中的表达中位值将其分为高、低表达组,在于JAVA 8.0平台上进行GSEA软件分析(3.0版本,http://www.gsea-msigdb.org/gsea/ downloads. jsp)。从分子特征数据库(MSigDB)获得的注释的基因组gseaftp.broadinstitute. org://pub/gsea/gene_sets_final/c5.go.v7.2.symbols.gmt被选择作为计算富集分数(es)的参考组,该富集分数的估计来自先前定义的基因组的基因,是在每个复发相关基因的高、低表达组中富集还是随机分布。排列数设置成1 000,排除小于15或大于500的基因,当标准化P< 0.05,FDR < 25%,基因组被视为富集组。
1.6 免疫微环境分析
通过CIBERSORT (https://cibersortx.stanford.edu/)计算出699例胃癌样本中22种免疫细胞(初始B细胞、记忆性B细胞、浆细胞、CD8+T细胞、CD4+的初始T细胞、静息的CD4+的记忆T细胞、CD4+的记忆T细胞、滤泡辅助T细胞、调节T细胞、γδ+T细胞、静息的NK细胞、活化的NK细胞、单核细胞、M0单核细胞、M1单核细胞、M2单核细胞、静息的树突状细胞、活化的树突状细胞、活化的肥大细胞、静息的肥大细胞、嗜酸性粒细胞和中性粒细胞)浸润情况,重复计算10 000次,按照P< 0.05的标准筛选出免疫细胞浸润结果准确性较高的样本。TISIDB(http://cis.hku.hk/TISIDB/index.php)是一个用于肿瘤和免疫系统交互的门户网站,用Spearman相关性分析目的基因的mRNA表达量在胃癌中与免疫调节剂及趋化因子的mRNA表达量之间的相关性。
1.7 统计学方法
统计分析采用IBM SPSS 22软件进行统计,目的基因在胃癌组织及癌旁正常组织中mRNA及蛋白质的表达量的比较采用秩和检验。目的基因的mRNA高、低表达分组采取中位水平裁剪分组(以中位数为节点分别向左和向右剔除相同人数的病例,防止由于检查误差导致结果出现偏差),生存分析研究采用Kaplan-Meier法,P< 0.05差异有统计学意义。
2 结果
2.1 查找与胃癌预后相关的基因
结果正如Table 1所示,OMD、AHI1、COMP、ACSM3、HOXB2、MEOX2为本文筛选出来的独立预后基因,而OMD的mRNA表达水平在不同性别(P= 0.027)、年龄(P= 0.034)、癌症发生部位(P< 0.001)、Lauren分型(P< 0.001)和临床分期(P= 0.001)中具有显著的差异,符合本文的筛选要求。本文还比较了胃癌组织和正常组织中OMD的mRNA表达量,胃癌组织中OMD的mRNA表达量显著高于正常组织(P= 0.015) (Fig. 1A)。最后,本文以OMD转录水平的中位水平裁剪分成高、低表达组进行Kaplan-Meier生存分析发现,OMD的mRNA高表达组的预后明显差于低表达组(P< 0.001) (Fig. 1A),这说明OMD对胃癌的发生及发展可能发挥促进作用,且具有成为胃癌预后标志物的潜力。
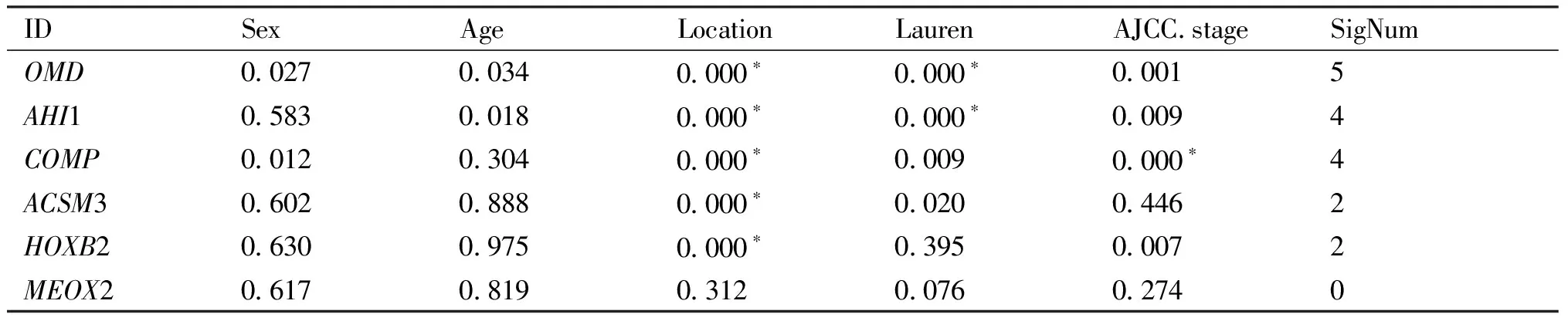
Table 1 Correlation analysis between prognostic genes and clinical characteristics in gastric cancers
2.2 骨调节蛋白的mRNA表达量、年龄和临床分期是影响胃癌患者生存预后的独立危险因素
单因素和多因素Cox回归分析结果见Table 2:OMD的mRNA表达量 (P< 0.001, hazard ratio[HR]= 7.645(95% CI[3.371-17.340])、年龄(P= 0.010, hazard ratio[HR]= 1.015 (95% CI[1.004-1.027])和临床分期(P< 0.001, hazard ratio[HR]= 2.043 (95% CI[1.801-2.317])是影响胃癌患者生存和预后的独立危险因素,这再次证明OMD的mRNA表达量增加与胃癌患者预后差有关。
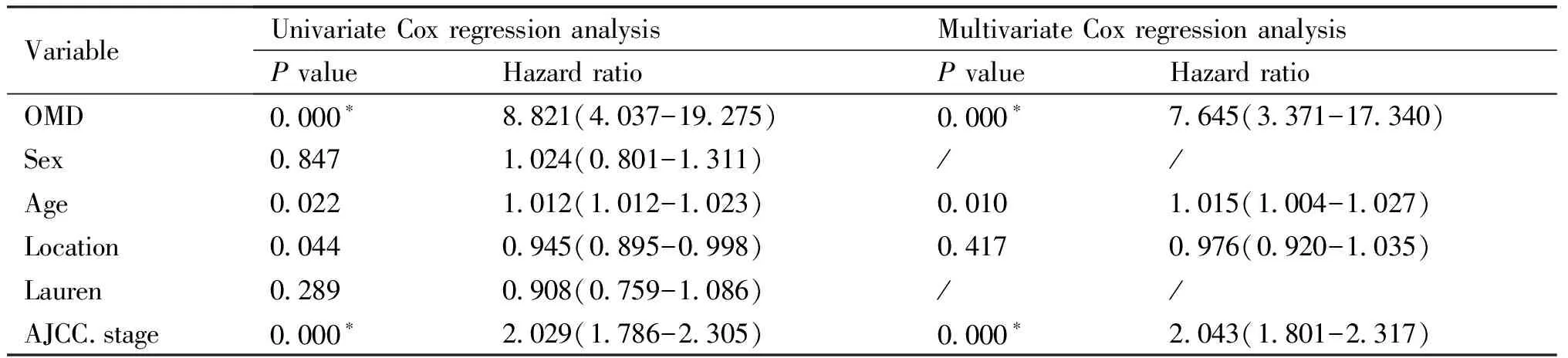
Table 2 OMD, Sex, Age, Location, Lauren and AICC. stage are independent risk factors for survival prognosis in patients with gastric cancer
2.3 骨调节蛋白的mRNA表达与胃癌患者临床性状的相关性
结果正如Fig. 1C所示,OMD的mRNA表达在不同性别、年龄、Lauren分型、AJCC分期及肿瘤发生部位中具有显著差异。其中,女性患者体内OMD的mRNA表达比男性患者多(P= 0.013);随着年龄的增加,OMD的mRNA表达也呈递减趋势且每个分组间的差别具有统计学意义;在Lauren分型中,弥漫型胃癌与肠型胃癌中的OMD的mRNA表达量具有差异(P< 0.001);弥漫型胃癌与混合型胃癌中的OMD的mRNA表达量具有差异(P< 0.001);而在肠型胃癌与混合型胃癌中,OMD的mRNA表达量的差异不大(P= 0.580)。在临床分期中, 随着癌症的进展,OMD的mRNA表达量也随之增加。因此,Ⅱ、Ⅲ、Ⅳ期患者体内OMD的mRNA表达量明显高于Ⅰ期(P= 0.042、P= 0.001、P= 0.006);在胃癌发生部位中,发现胃上部与胃中部OMD的mRNA表达量具有差异性(P= 0.002),胃中部与胃下部及混合部位中OMD的mRNA表达量具有差异性((P< 0.001,P< 0.001),胃下部与混合部位中OMD的mRNA表达量具有差异性(P= 0.018)。
2.4 骨调节蛋白的mRNA表达、预后及与临床性状相关性的验证
通过肿瘤基因组图谱计划 (the cancer genome atlas program, TCGA) 数据库和基因型-组织表达数据库(genotype-tissue expression project, GTEx)验证,在正常组织及胃癌肿瘤组织中,OMD的mRNA表达,结果正如Fig. 1B所示,在206个正常胃组织中OMD的mRNA表达水平显著低于375个胃癌组织(P< 0.001),在TCGA数据库中再次证明OMD的mRNA高表达组的预后明显差于低表达组(P< 0.001)。结果正如Fig. 1D所示,在TCGA数据库中,男性与女性体内OMD的mRNA表达未见差异(P= 0.520);胃癌发生部位之间OMD的mRNA表达也未见差异;而年龄中只有41~60岁之间的患者体内OMD的mRNA表达量与81~100岁之间具有差异(P= 0.036);Lauren和AJCC分期的结果与Merge数据库的结果一致,弥漫型胃癌与肠型胃癌中OMD的mRNA表达量具有差异(P< 0.001);Ⅰ期与Ⅱ、III、IV期患者体内OMD的mRNA表达量具有差异 (P< 0.001、P< 0.001、P= 0.001)。本研究还利用收集的36对胃癌及癌旁正常组织进行实时荧光定量PCR检测,结果正如Fig. 2A显示胃癌组织中OMD的mRNA显著高于癌旁正常组织(P< 0.001),符合生物信息学分析的结果。除此之外,本文还通过Western印迹检测了3组新鲜的胃癌及癌旁正常组织中OMD蛋白表达量。结果见Fig. 2B,与生物信息学分析结果及qRT-PCR结果一致,胃癌组织中OMD蛋白表达量明显高于癌旁正常组织(P< 0.01)。
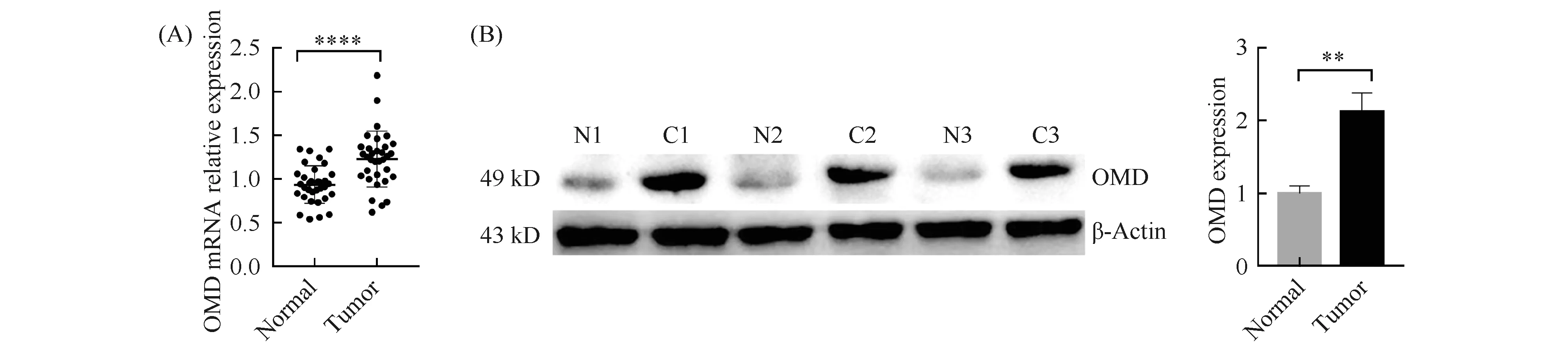
Fig.2 The expression of OMD in gastric cancer and normal tissues was verified by qRT-PCR and Western blotting (A) The expression of OMD mRNA in gastric cancer and adjacent normal tissues detected by qRT-PCR (**** P < 0.001). (B) The expression of OMD in gastric cancer and adjacent normal tissues detected by Western blotting (** P < 0.01)
2.5 骨调节潜在生物学功能分析
OMD潜在生物学功能分析结果见Fig. 3所示。在Merge数据库中,本文发现了OMD的mRNA高表达样本富集了细胞外基质、调控白细胞分化过程和参与细胞信号转导的细胞表面受体信号通路等。同样,在TCGA数据库中,也发现了OMD的mRNA高表达样本富集了细胞外基质受体相互作用通路、白细胞转移和迁移和趋化因子信号通路等。因此,说明OMD可能通过上述信号通路影响着胃癌的发生发展。

Fig.3 The potential biological function of OMD (A) GSEA results for OMD in the Merge. (B) GSEA results for OMD in the TCGA
2.6 免疫微环境分析
209例符合筛选条件的胃癌样本中OMD的mRNA高表达组共127例,低表达组共82例。结果正如Fig. 4A中的柱状图所示,横坐标为胃癌样本名称,前82个为OMD的mRNA低表达组,后127个为OMD的mRNA高表达组。纵坐标为免疫细胞在每个胃癌样本中的百分率,所有免疫细胞的百分率之和为100%。不同颜色分别代表了22种不同的免疫细胞,不同颜色柱的长度代表了不同的免疫细胞在胃癌样本中的含量,某颜色的柱越长代表某免疫细胞在该胃癌样本中的含量越高。其中可以发现,OMD的mRNA高表达组中嗜酸性粒细胞和中性粒细胞的含量高于OMD的mRNA低表达组,而记忆B细胞、树突状细胞和肥大细胞的含量低于OMD的mRNA低表达组。在Fig. 4B,横坐标中玫红色为OMD的mRNA高表达组,天蓝色为OMD的mRNA低表达组,纵坐标为22种不同免疫细胞。热图中,每个格子代表免疫细胞在每个胃癌样本中的含量,颜色越红代表免疫细胞在胃癌样本中的含量越高,颜色越绿代表免疫细胞在胃癌样本中的含量越低。结果发现,酸性粒细胞、中性粒细胞、记忆B细胞、树突状细胞和肥大细胞的含量在OMD的mRNA高、低表达组中存在差异。209例胃癌样本中,22种免疫细胞浸润程度的相关性如Fig. 4C所示,活化的CD4+ T细胞与调节T细胞呈正相关(r=0.720),活化的树突状细胞与M2型巨噬细胞呈正相关(r=0.700)。Fig. 4F的小提琴图更直观的显示OMD的mRNA低表达组中记忆B细胞、静息状态下的树突状细胞和肥大细胞的含量高于OMD的mRNA高表达组(P= 0.040、P= 0.047、P= 0.026),而OMD的mRNA高表达患者中嗜酸性粒细胞和中性粒细胞的含量则高于OMD的mRNA低表达患者(P= 0.013、P= 0.045)。为了打破单个数据库的局限性,进一步提高免疫细胞浸润的比例分析的可信度,本文采用TCGA数据再次进行独立分析,结果正如Fig. 4 G所示,OMD的mRNA低表达组中单核细胞、M2型巨噬细胞、静息状态下的树突状细胞和肥大细胞的含量高于OMD的mRNA高表达组(P= 0.003、P< 0.001、P= 0.002、P< 0.001),而OMD的mRNA高表达患者中浆细胞、滤泡辅助T细胞、NK细胞、M0型巨噬细胞、活化状态下的树突状细胞、活化状态下的肥大细胞和嗜酸性粒细胞含量则高于OMD的mRNA低表达患者(P= 0.003、P= 0.004、P= 0.026、P= 0.002、P= 0.002、P= 0.002、P= 0.024)。综上所述,OMD的mRNA高表达组中,嗜酸性粒细胞浸润丰富,而低表达组中静息状态下的树突状细胞浸润丰富。TISIDB网站分析的结果正如Fig. 4D-E所示,OMD的mRNA表达量与免疫增强剂ENTPD1的mRNA表达量(rho=0.634,P< 0.001)具有正相关性,与趋化因子CXCL12的mRNA表达量(rho=0.625,P< 0.001)呈正相关。

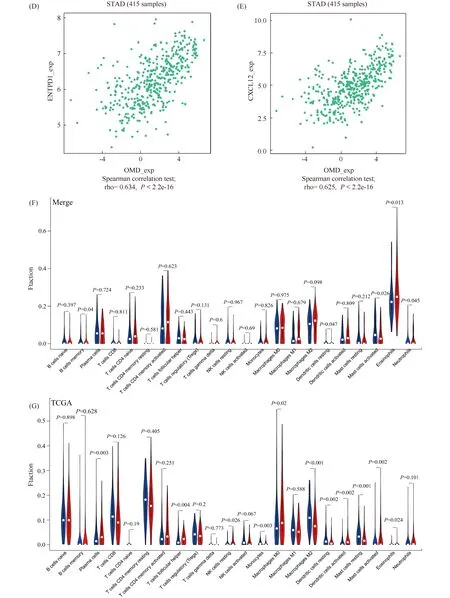
Fig.4 The results of immune cell infiltration analysis were plotted using R language packages "Pheatmap", "Corrplot" and "Vioplot" and spearman correlations between the expression of OMD and immunoinhibitors and chemokine in gastric cancer (A) Histogram of immune cell infiltration in 209 gastric cancer samples. (B) Heat map of immune cell infiltration in 209 gastric cancer samples. (C) Correlation heat maps of the degree of infiltration of 22 types of immune cells in 209 gastric cancer samples. (D) Correlation dot plot between OMD mRNA expression and ENTPD1 mRNA expression. (E) Correlation dot plot between OMD mRNA expression and CXCL12 mRNA expression. (F) Violin view of immune cell infiltration in 209 gastric cancer samples. (G) Violin view of immune cell infiltration in TCGA
3 讨论
生存预后及生活质量是衡量胃癌患者诊断及治疗的金标准。与胃癌患者生存预后相关的因素有许多,目前公认的是临床分期。但临床分期只有在胃癌手术切除后才能准确获取,因此临床分期对胃癌患者进行手术之前的预后评估具有一定的局限性。然而,手术之前胃癌患者的生存预后评估具有重要的临床意义:(1)术前评估作为预警信号,可以辅助制定手术计划,从而提高手术质量;(2)术前评估预后可以帮助制定术后个性化放化疗方案和适宜的随访间隔。因此,本研究一开始使用了GSE26253、GSE26942和GSE13861等3个数据库,共31例正常样本及699例胃癌样本,证明了胃癌组织中OMD的表达量高于正常组织,并且OMD的表达量与胃癌患者预后、年龄、Lauren分型、临床分期等临床性状密切相关,所以骨调节蛋白可能成为1个术前可获得的胃癌预后标志物。
随后,为了探究OMD是如何影响胃癌的发生发展,本文通过GSEA分析发现,骨调节蛋白在细胞外基质、白细胞的活动过程及细胞外信号传导过程中发挥着作用。首先,胃癌癌变中不可或缺的一个过程为细胞外基质的重塑及基底膜屏障的破坏,这种重塑主要由细胞外基质沉积、纤维排列和交联导致的,进而促进胃癌的进展[11]。目前,大多数研究认为,这种重塑是由于金属蛋白酶及其组织抑制因子表达之间的失衡所致[12]。骨调节蛋白一开始被认为是软骨细胞外基质中的蛋白质。本文发现,它在胃癌组织中也丰富表达,并且高表达的患者预后不佳。由此可知,骨调节蛋白不仅可以连接组织和分化成骨细胞,还可以促进细胞外基质的重塑,及加快基底膜屏障的破坏,从而导致胃癌癌变。
其次,骨调节蛋白具有调控白细胞活动过程的功能。因此,本文研究OMD的mRNA高、低表达组中的免疫细胞浸润情况。结果发现,OMD的mRNA低表达组中,静息状态下的树突状细胞浸润丰富,高表达组中嗜酸性粒细胞浸润丰富。树突状细胞是专职抗原呈递细胞之一,能够对CD8+和CD4+T细胞的主要组织相容性复合体I类和II类进行抗原呈递[13]。除此之外,树突状细胞可以在淋巴组织和非淋巴组织之间迁移,调控细胞因子和趋化因子的活动,从而导致炎症的发生[14]。因此,树突状细胞可以作为肿瘤疫苗进行癌症治疗。而且,目前已有数百项试验正在测试和评估树突状细胞疫苗的疗效。Mao 等[15]使用纳米结构脂质载体(NLC)来负载氯化素e6(Ce6),作为一种潜在的载体。利用Ce6在激光照射下产生活性氧的光动力效应,NLC/Ce6能够触发细胞死亡,暴露肿瘤相关抗原。此外,模拟自然炎症反应,活性氧还可以招募树突状细胞,以便有效地处理/呈现原地暴露的肿瘤相关抗原。结果发现,该方式具有很强的树突状细胞免疫效果,能有效地抑制胃原发和远端肿瘤的生长。一项研究表明,树突状细胞的数量与胃癌患者的临床特征及预后具有显著的相关性。树突状细胞的数目越高,胃癌患者的淋巴结受累越少,生存率也越高[16]。本研究也有这样的发现,OMD的mRNA低表达组中,树突状细胞浸润丰富且预后佳。嗜酸性粒细胞是白细胞的组成部分,被激活后能合成并释放大量的活性介质,这些介质单独对不同的靶细胞具有积极或消极影响[17]。例如嗜酸性粒细胞可以通过金属蛋白酶降解细胞外基质,有利于癌细胞的侵袭和转移[18]。在本文的研究中也发现,OMD参与了细胞外基质的改变过程,不但OMD的mRNA高表达组中嗜酸性粒细胞浸润丰富,而且OMD的mRNA高表达组的胃癌患者预后不良。这再次表明,OMD可能通过嗜酸性粒细胞使细胞外基质发生了降解,正常的细胞外稳态被破坏,从而导致胃癌患者的不良预后。综上所述,骨调节蛋白可能通过免疫微环境影响胃癌的发展。
最后,鉴于骨调节蛋白参与细胞外信号转导的过程,尤其在趋化因子信号通路上发挥作用。所以,本文研究OMD的mRNA表达与免疫调节点和趋化因子之间的关系。结果发现, OMD的mRNA与免疫增强剂ENTPD1的mRNA表达量具有显著的正相关性。ENTPD1又称CD39,是Treg细胞的功能性表面标记[19],被认为是一种新的免疫调节分子[20],其在水解细胞外ATP中发挥至关重要的作用,受损细胞释放ATP并表现出多种促炎作用[21]。有报道称,CD39高表达与胃癌患者根治术后不良预后相关[22]。同样,我们发现,OMD的mRNA表达量与CD39的mRNA表达量呈正相关,而且OMD的mRNA高表达患者预后不佳。趋化因子是一个小的细胞因子样蛋白质的超家族,对淋巴细胞运输到适当的器官和维持正常的免疫系统是必不可少的[23]。趋化因子CXCL12也被称为基质细胞衍生因子-1,是一种调节白细胞运输的小蛋白质,通过刺激CXCR4受体参与肿瘤的发展和转移[24]。在胃腺癌中,CXCL12与CXCR4的结合,上调了PI3K/mTOR和c-MET通路。通过整合素β1聚集、肌动蛋白重组和RhoA激活,导致侵袭性增加[25,26]。此外,PI3K/mTOR通路上调可防止肿瘤细胞自噬[27]。Ishigami等[28]发现,CXCL12阳性的胃癌表现出更强的侵袭行为。在本文的研究发现中,Ⅱ、Ⅲ和Ⅳ期胃癌患者体内OMD的mRNA表达量显著多于Ⅰ期患者。而OMD的mRNA表达量与CXCL12的mRNA表达量呈正相关。因而可以说明,Ⅱ、Ⅲ和Ⅳ期胃癌患者体内OMD的mRNA高表达可能与趋化因子CXCL14的作用有关。
综上所述,本文发现了骨调节蛋白是一个潜在的胃癌免疫治疗的新靶点。除此之外,骨调节蛋白也是一个理想的预后标志物。可以通过术前检测其表达量来预测胃癌患者的预后,为临床医生提供合适的个体化治疗方案。

