异体自噬的操控:病原微生物对宿主翻译后修饰的调节作用
郭凌峰, 周长林, 樊竑冶
(中国药科大学 生命科学与技术学院, 南京 211100)
自噬(autophagy)是一种广泛存在于真核细胞中的溶酶体依赖性分解代谢途径。目前,自噬主要被分为3种,即宏自噬(macroautophagy)、微自噬(microautophagy)和高等真核生物中特异的分子伴侣介导的自噬(chaperone-mediated autophagy,CMA)[1]。其中,宏自噬涉及生物学功能最多,也是研究最为深入的类型,并具有对底物的选择性和非选择性两种运行方式。异体自噬(xenophagy)属于选择性宏自噬,是细胞特异性识别并参与清除胞内病原微生物的自噬过程。异体自噬是免疫细胞重要的宿主防御机制之一,与炎症反应的发生和抗原呈递等多种免疫过程和功能息息相关[2, 3]。本文围绕泛素化、磷酸化等蛋白质翻译后修饰(post-translational modifications,PTMs)对自噬发生过程的影响,重点关注病原微生物利用自噬相关蛋白(autophagy related proteins,ATG proteins)的蛋白质翻译后修饰操控细胞自噬的相关机制,对病原微生物作用于异体自噬进行综述,为探索异体自噬的干预和控制病原微生物感染的研究提供参考。
1 异体自噬
异体自噬是细胞特异性识别并清除胞内病原微生物的自噬过程,通常可分为如下4个步骤:(1)病原微生物进入宿主细胞后诱导前自噬体结构(pre-autophagosomal structure,PAS)的形成。随着病原微生物主动侵入或经由吞噬作用被动进入宿主细胞,病原微生物的病原相关分子模式(pathogen-associated molecular pattern,PAMP),以及毒力蛋白质等异常成分可影响宿主细胞多方面功能,干扰其能量和物质代谢。而这些宿主细胞内环境信号的改变可激活ATG蛋白所介导的内质网、高尔基体等膜性细胞器上PAS的形成。(2)宿主细胞对病原微生物的泛素化标记与识别。细胞的泛素化系统标记入侵的病原微生物或异常宿主成分(病原微生物破坏的宿主细胞吞噬膜上暴露的多糖),即细胞内发出的“吃我”信号,是自噬选择性的重要基础[4, 5]。随后,泛素化的靶标被具有泛素结合结构域(ubiquitin-binding domains,UBDs)的自噬衔接蛋白(也称为自噬受体)识别结合。(3)宿主细胞靶向病原微生物形成自噬体(autophagosome, AP)。自噬衔接蛋白(例如p62/SQSTM1)同时兼具泛素结合结构域和LC3相互作用域(LC3 interaction region,LIR),因而能衔接泛素化的病原微生物和LC3,而LC3缀合着源自PAS的自噬前体(phagophore,PG)。在其他ATG蛋白的介导下,自噬前体逐渐延伸并闭合形成了包裹病原微生物的自噬体。整个过程中所涉及的ATG蛋白的精密调控均依赖于泛素化、磷酸化等PTMs作用[6];(4)自噬溶酶体的形成及病原微生物的清除。自噬体在Rab家族GTPases和SNARE复合体等作用下沿着细胞微管蛋白骨架运动,从而与溶酶体融合并最终成熟为自噬溶酶体(autolysosome,AL)[7]。溶酶体中的酸性水解酶会将自噬溶酶体的“内膜”和病原微生物降解破坏。
尽管宿主将自噬设计得如此精巧,但随着对宿主与病原微生物相互作用研究的深入,越来越多的证据表明,病原微生物已经进化出逃避或劫持自噬系统的策略。例如,病原微生物能通过多种毒力因子干扰自噬信号的传导逃避自噬体的捕获[8],抑制宿主膜成分的转运从而影响自噬体成熟[9],阻止自噬体与溶酶体的融合、酸化[10],甚至利用宿主自噬来促进自身生长复制和感染[11]。其中,很多过程涉及自噬相关蛋白的泛素化、磷酸化等蛋白质翻译后修饰。
2 病原微生物利用泛素化系统操纵异体自噬
泛素化(ubiquitination)是真核细胞中重要的蛋白质翻译后修饰,能够指导蛋白质的降解或调节细胞信号传导。泛素化系统包含泛素 (ubiquitin,Ub) 以及负责泛素化/去泛素化的酶。
2.1 异体自噬过程中的泛素化
宿主细胞的泛素化系统在异体自噬过程中发挥了重要作用。为了标记并识别细胞内的病原微生物,泛素化系统中的E3泛素连接酶(Parkin和Smurf1等)催化泛素共价结合至病原微生物表面,形成泛素外壳(ubiquitin coat)[12, 13]。由此,病原微生物通过泛素外壳向细胞发出“吃我”信号,而这些信号可被自噬衔接蛋白所识别。随后,p62/SQSTM1(sequestosome-1)、NBR1(neighbor of BRCA1 gene 1)、NDP52(nuclear dot protein 52)和OPTN(optineurin)等自噬衔接蛋白质,通过与泛素外壳相连接,以完成对病原微生物的识别[14]。泛素外壳和自噬衔接蛋白质的出现为异体自噬中靶向病原微生物自噬体的形成奠定了分子基础。然而,病原微生物已经进化出多种策略,以操纵和利用泛素化系统来调节自噬。
2.2 病原微生物利用去泛素化作用逃避自噬
泛素化是一个可逆的过程,去泛素化酶(deubiquitinases,DUBs)可特异性催化异肽键断裂,导致泛素链的释放进而改变底物的命运。目前,已发现细胞内病原微生物通过分泌具有去泛素化酶活性的毒力因子,使病原微生物去泛素化,从而有效地抑制了自噬发生。
鼠伤寒沙门氏菌(Salmonellatyphimurium)是一种兼性细胞内寄生细菌,可在宿主细胞中构建含沙门氏菌的囊泡(Salmonella-containing vacuole,SCV)进而在其中存活并增殖。沙门氏菌侵袭细胞后会导致各类异常物质的产生,例如SCV裂解后的囊泡膜残余物、细菌细胞壁成分和聚集体样诱导结构(aggresome-like induced structure,ALIS)等。这些物质可作为宿主细胞泛素化的底物,进而由自噬衔接蛋白p62/SQSTM1识别并触发异体自噬。然而,沙门氏菌的致病岛-2(Salmonellapathogenicity island 2,SPI-2)所编码形成的Ⅲ型分泌系统(type 3 secretion systems,T3SS),能够产生SseL效应蛋白。SseL具有去泛素化酶活性,可使沙门氏菌诱导产生的底物被去泛素化,从而阻止p62/SQSTM1介导的异体自噬反应,有利于沙门氏菌的存活[15]。
衣原体是另一种专性细胞内寄生的病原微生物,其侵入宿主上皮细胞后形成包涵体并在其中生长和增殖。衣原体也可以产生具有去泛素酶活性的毒力因子,来抵御宿主细胞自噬系统对包涵体的清除。譬如,在肺炎衣原体感染细胞的侵入位点,泛素短暂积累的出现使衣原体具有被自噬清除的风险。有趣的是,肺炎衣原体能分泌具有去泛素酶活性的OTU样结构域蛋白CCA00261(ChlaOTU),并巧妙地通过靶向泛素和NDP52参与入侵位点的去泛素化,从而避免自噬的发生[16]。此外,沙眼衣原体依赖于分泌到包涵体外的一种去泛素化酶ChlaDUB1,来降低包涵体的泛素化水平而逃避自噬[16, 17]。
与上述病原微生物不同的是,类鼻疽伯克氏菌(Burkholderiapseudomallei)可直接对泛素进行修饰,使其丧失作为底物的特性而抑制泛素化作用。伯克氏菌分泌的CHBP(Cif homologue inB.pseudomallei)蛋白,一种循环抑制因子(cycle inhibiting factor,Cif)的同源物,能使泛素第40位谷氨酰胺进行脱酰胺化。泛素脱酰胺化后将不再支持E3连接酶催化合成泛素链,并且抑制了其与泛素结合蛋白p62 /SQSTM1等的相互作用,从而干扰泛素化外壳的形成。此外,CHBP蛋白还可靶向另一种泛素样蛋白NEDD8 (neural precursor cell expressed developmentally downregulated-8 ),通过对其脱酰胺化,进而抑制NEDD8触发的巨噬细胞特异性凋亡[18]。
总之,胞内病原微生物通过毒力因子限制宿主免疫细胞对其的泛素化标记,阻碍了自噬衔接蛋白与病原微生物结合,从而抑制了异体自噬的发生。
2.3 病原微生物利用泛素化作用操控自噬
病原微生物利用泛素化作用操控自噬主要体现在两方面:
(1)病原微生物抑制异体自噬的发生。宿主细胞利用异体自噬来清除入侵的病原微生物,因此病原微生物通常会抑制自噬的发生。据报道,人类免疫缺陷病毒-1(HIV-1)编码的辅助蛋白Nef,可以通过负调节自噬体的形成来帮助HIV-1的存活。研究发现,Nef能结合E3连接酶Parkin进而促进其对BCL2的泛素化。泛素化修饰的BCL2与BECN1通过BH3结构域的相互作用将被增强。已知在自噬体形成阶段,BECN1需要首先从其抑制分子BCL2上解离,才能够与多种辅因子相互作用,从而形成复合物PI3KC3 (phosphatidylinositol 3-kinase complex class Ⅲ)。因此,Nef通过增强Parkin对BCL2的泛素化修饰,阻碍了PI3KC3复合体(BECN1-Vsp34-Vsp15-ATG14 L)的形成,从而影响LC3的脂质化[19]。最终,Nef导致了自噬体形成障碍,有利于HIV-1病毒在细胞内存活[20]。
(2)病原微生物诱导宿主自噬的发生,却抑制自噬溶酶体成熟。尽管多数研究认为,自噬的激活对于病原微生物在细胞内存活是有害的。但另一些研究却发现,存在病原微生物故意诱导宿主细胞的自噬途径进而促进自身存活的现象。嗜肺军团菌(Legionellapneumophila)被巨噬细胞内化后,能分泌一种具有非经典泛素连接酶活性(不依赖于E1、E2、E3酶级联催化)的SidE/SdeABC(SidEs)家族蛋白。一方面,SidEs通过直接催化宿主细胞Rag小GTPases的泛素化而抑制mTORC1信号通路,促使宿主细胞宏自噬整体水平的升高。其中,细胞自噬而释放的氨基酸等营养代谢产物可供嗜肺军团菌利用[21]。另一方面,嗜肺军团菌能利用巨噬细胞内质网衍生的囊泡建立自噬体样复制区室,即军团菌囊泡(Legionella-containing vesicles,LCV),并在此进行增殖。SidEs通过对内质网膜运输相关蛋白质Rtn4和Rab33b的泛素化修饰,促进内质网膜重排并向军团菌递送,为LCV的构建创造物质基础[22]。有趣的是,军团菌在LCV构建完成后会主动消除SidEs的促自噬功能以避免异体自噬。据报道,军团菌能通过分泌催化SidEs谷氨酰化的效应蛋白SidJ,废除SidEs的泛素连接酶活性[23];此外,军团菌还能产生具有去泛素化酶活性的效应蛋白质DupA / DupB,用于逆转SidEs介导的泛素化[24]。由此可见,病原微生物从自身利益出发,既可以编码各种修饰宿主底物的酶,又能产生用于控制酶活性的调节物,在不同时空中对自噬进行精确调控而逃避自噬清除。
3 病原微生物利用磷酸化系统操控异体自噬
蛋白质磷酸化是一种极为普遍和重要的蛋白质翻译后修饰作用。磷酸化方式主要有两种:(1)蛋白质激酶将ATP的磷酸基团催化转移至底物蛋白氨基酸残基(Ser、Thr、Tyr)上;(2)底物蛋白质与GTP结合获得磷酸基团。蛋白质的磷酸化经常会引发级联反应,在代谢控制和细胞信号传递中尤为突出。
3.1 异体自噬过程中的磷酸化
异体自噬与饥饿诱导的自噬均是宏自噬的一种具体形式。因此,两者在过程上存在着明显的相似性,并且同样都受到蛋白质磷酸化修饰的精细调节。UNC-51类自噬激活激酶(Unc-51 like autophagy activating kinase 1,ULK1)在自噬体形成位点的聚集,是自噬发生过程中可检测到最早的事件之一。在经典的饥饿诱导的自噬模型中,ULK1的活性主要受到mTORC1(mammalian target of rapamycin complex 1)和AMPK(5′ AMP-activated protein kinase)的磷酸化调节[25]。最近的一项研究表明,一旦细胞侦测到病原微生物,AMPK作为自噬的上游激活剂也同样会被迅速活化,导致AMPK介导的自噬起始复合物(ULK1-ATG13-FIP200-ATG101)中ULK1的磷酸化(S317)显著增强,这对于细胞快速响应病原微生物的入侵而启动异体自噬反应有着重要意义[26]。
此外,TANK结合激酶1(TANK-binding kinase 1,TBK1)在异体自噬信号传递过程中具有重要作用。有证据表明,TBK1能被自噬调节分子TBC1D9 (Ca2+-binding protein TBC1 domain family member 9)募集到细菌的泛素外壳周围,发生自缔合(self-association)形成二聚体,并伴随彼此的磷酸化。活化后的p-TBK1(S172)可以磷酸化自噬衔接蛋白NDP52,并促进后者通过泛素链与细菌结合[27]。随后,NDP52进一步募集自噬起始复合物ULK1以启动自噬体的形成[28]。
3.2 病原微生物利用磷酸化作用劫持自噬
随着对病原微生物与宿主关系研究的深入,已经发现有多种病原微生物能够利用磷酸化作用劫持并操纵异体自噬。其中,有些病原微生物毒力因子可通过影响自噬蛋白质的表达水平,间接操纵自噬通路基于磷酸化的信号传导。例如,肠炎沙门氏菌(Salmonellaenteritidis)是一种食源性病原菌,能够在肠上皮细胞中长期存活。研究表明,肠炎沙门氏菌分泌的效应蛋白AvrA能够下调C-Jun N端激酶(JNK)的磷酸化水平,进而抑制JNK / c-Jun / AP-1信号传导途径。AvrA对JNK的抑制作用会导致BECN1的转录和表达降低。不仅如此,AvrA还能够直接与BECN1相互作用,干扰BECN1参与复合物PI3K3C的形成。总之,AvrA通过JNK途径抑制了BECN1,从而减弱了细胞清除沙门氏菌的异体自噬反应,为细菌在细胞中存活创造了有利条件[29]。
有些病原微生物还会采用分子模仿的策略直接参与宿主的自噬调节。例如,Us3激酶能通过拮抗ULK1和Beclin1活性而抑制异体自噬,促进病毒在细胞内的复制。Us3是单纯疱疹病毒I型(HSV-1)编码的功能蛋白质,具有类似AKT的丝/苏氨酸蛋白激酶的活性。就机制而言,Us3以AKT非依赖性的方式磷酸化激活TSC2(Ser939/Thr1462),进而活化宿主细胞的mTORC1,加强对ULK1的抑制性磷酸化(Ser757)。此外,Us3激酶还可以直接促进BECN1的磷酸化(Ser234/Ser295)来抑制异体自噬[30]。
伤寒立克次氏体(Rickettsiatyphi)可以抑制溶酶体与自噬体的融合,从而达到逃避异体自噬等细胞防御的目的。该过程由一种兼具Ⅰ和Ⅲ类磷脂酰肌醇3-激酶(phosphoinositide 3-kinase,PI3K)活性的细菌分泌型激酶Risk1介导。Risk1能够将自噬体膜上的磷脂酰肌醇(phosphatidylinositol,PI)磷酸化为3-磷酸磷脂酰肌醇(phosphatidylinositol 3-phosphate,PI3P)[31]。据报道,PI3P的减少是触发自噬体膜上ATG蛋白解离,使自噬体能够与溶酶体相融合的重要条件[32]。因此,Risk1通过促进自噬体膜上PI3P的生成,进而延迟自噬溶酶体的成熟,有助于立克次氏体在宿主细胞中的存活和增殖[31]。
综上所述,病原微生物能够通过劫持依赖于磷酸化的自噬活化信号传递、控制异体自噬并促进自身在宿主细胞的复制和存活。
4 病原微生物利用其他蛋白质翻译后修饰操纵异体自噬
虽然已有近百种蛋白质翻译后修饰作用被鉴定报道,但在病原微生物调控异体自噬方面,目前的研究主要集中在泛素化和磷酸化作用。最近,也有相关报道指出,病原微生物还可以通过ADP-核糖基化(ADP-ribosylation)、乙酰化(acetylation)和脂肪酰化(fatty acylation)等操纵异体自噬。病原体操纵异体吞噬所用的策略见Table 1。
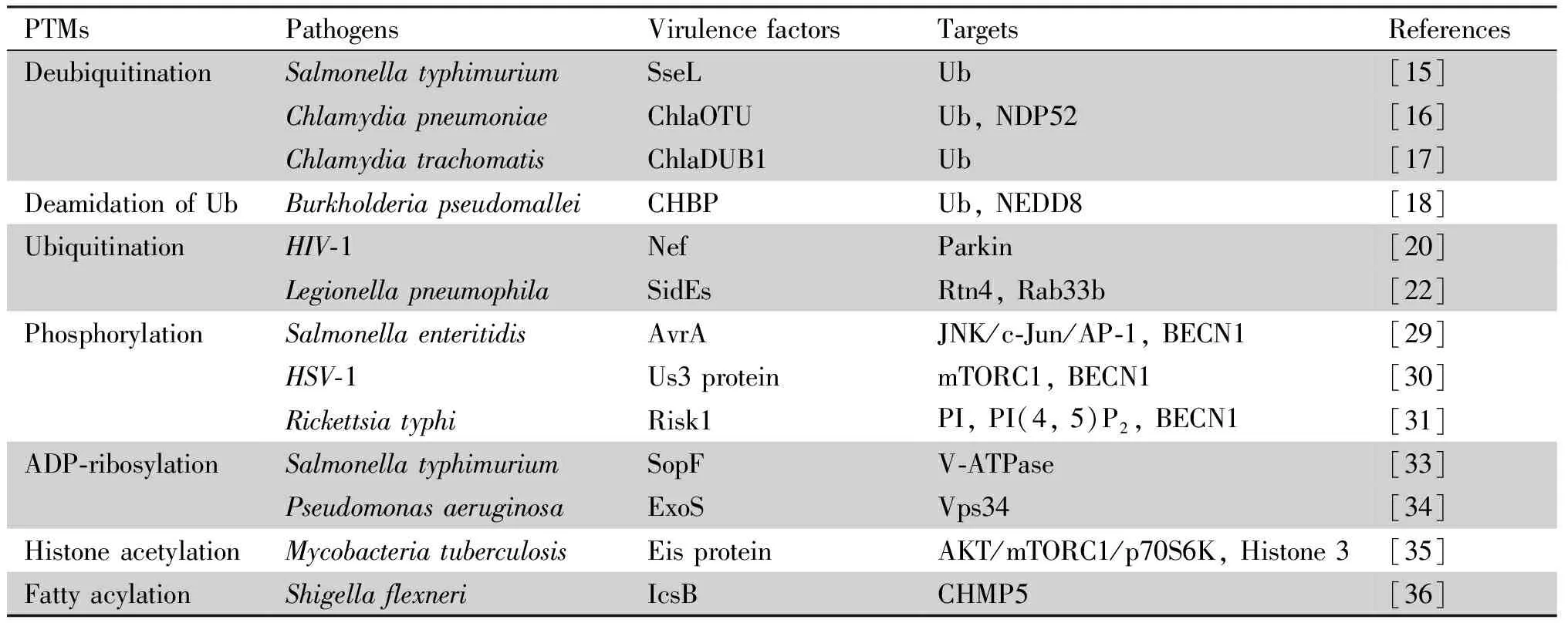
Table 1 Strategies used by pathogens to manipulate xenophagy
4.1 病原微生物利用ADP-核糖基化修饰抑制自噬
ADP-核糖基化是在蛋白质中加入1个或多个ADP-核糖基。它是一种可逆的蛋白质翻译后修饰,参与细胞信号传递、DNA修复和凋亡等多种细胞过程。鼠伤寒沙门氏菌Ⅲ型分泌系统效应蛋白SopF,通过对宿主细胞V-ATPase的亚基ATP6V0C上第124位谷氨酰胺进行ADP-核糖基化,从而减弱了V-ATPase对ATG16L1的募集。这将抑制ATG16L1所诱导的ATG5依赖性LC3脂化作用,进而抑制异体自噬的发生,削弱宿主细胞对沙门氏菌的杀伤[33]。此外,铜绿假单胞菌(Pseudomonasaeruginosa)Ⅲ型分泌系统效应蛋白质ExoS具有ADP-核糖基转移酶ADPRT结构域。实验观察到,ExoS借助其ADRPT结构域降低宿主细胞PI3KC3复合物中Vps34激酶的活性,进而抑制异体自噬,促进铜绿假单胞菌在呼吸道上皮细胞中的存活[34]。
4.2 病原微生物对组蛋白的乙酰化修饰抑制自噬
乙酰化是将乙酰基转移到底物蛋白质特定的N-端赖氨酸残基上的反应。细胞内乙酰化修饰受到乙酰转移酶(HAT/KAT)和脱乙酰酶(HDAC/KDAC)的双向调节。最近发现,结核分枝杆菌(Mycobacteriatuberculosis,MTB)的EIS蛋白具有高效且广泛的乙酰转移酶活性,并且能够显著降低巨噬细胞的自噬水平,促进MTB在细胞内的长期存活。作用机制方面的研究显示,EIS通过对巨噬细胞组蛋白H3第9位赖氨酸进行乙酰化修饰,促进了转录因子SP1和STAT3在IL-10基因启动子序列的结合,进而上调IL-10的转录表达。这将进一步激活AKT/mTORC1/p70S6K 信号通路,最终导致异体自噬的抑制[35]。
4.3 病原微生物利用蛋白质的脂肪酰化修饰抑制自噬
脂肪酰化是蛋白质脂化(lipidation)的一种主要形式,其涉及到不同链长的脂肪酰基在蛋白质上的共价附着。弗氏志贺氏菌(Shigellaflexneri)Ⅲ型分泌系统效应蛋白IcsB,其是一种碳十八脂肪酰基转移酶(18-carbon fatty acyltransferase),可催化蛋白质赖氨酸的Nε-脂肪酰化(Nε-fatty acylation)。IcsB通过对宿主细胞中CHMP5 (charged MVB protein 5) 第7位赖氨酸的脂肪酰化,抑制了CHMP5的活性。已知CHMP5是宿主细胞内体分选复合物ESCRT-Ⅲ的组成部分,CHMP5的失活将抑制自噬体的形成,削弱宿主细胞的异体自噬[36]。由此说明,IcsB通过对宿主蛋白质的脂肪酰化参与调节志贺氏菌在宿主细胞内的自噬逃逸。
5 问题与展望
大量的研究已证明,异体自噬在宿主防御中发挥着重要的作用。随着蛋白质翻译后修饰调控异体自噬重要性的日益突显,病原体利用蛋白质翻译后修饰操纵自噬的现象也不断被发现。然而,异体自噬的研究也面临着新的契机与挑战。首先,异体自噬的发生过程需要被进一步细化,其中新的信号分子及作用机制还有待深入发掘。以异体自噬中重要的“泛素化标记与识别”步骤为例,最近研究发现,泛素能够在不依赖于泛素连接酶的情况下直接与结核分枝杆菌的表面蛋白质Rv1468c结合[37]。然而,这种异体自噬的识别机制是否具有普适性仍未可知。其次,介入异体自噬中的蛋白质翻译后修饰的多样性以及具体过程有待更为细致的阐明。目前的研究多集中在磷酸化、泛素化等最常见的蛋白质翻译后修饰中,而像SUMO化(SUMOylation)等虽然已知与诸如神经退行性疾病[38]、癌症发生发展[39]有关,但在异体自噬中的研究工作仍有待进一步开展[40]。最后,需要进一步明确病原微生物影响异体自噬的毒力因子以及人为调控异体自噬的关键性靶标。这不仅有利于针对毒力因子及其分泌系统为靶标设计单抗或新型抗生素[41, 42],还可以作为开发干预异体自噬乃至其他类型的选择性自噬的新型抑制/激活剂的参考,从而在相关疾病的治疗中发挥作用。目前,这一方面的研究已有部分显示出积极效果,例如使用金合欢素(acacetin)激活宿主细胞的异体自噬能够有效抑制鼠伤寒沙门氏菌感染[43];维生素D3可以作为免疫增强剂促进宿主细胞针对幽门螺杆菌的自噬及降解[44]。另外,在应对目前SARS-CoV-2病毒引起的COVID-19全球流行时,自噬抑制剂(包括有争议的药物氯喹)作为COVID-19的可能疗法,也提示我们了解自噬与病原微生物之间的关系是非常重要的[45]。总之,加深对异体自噬的理解,将有助于进一步探究病原微生物在宿主细胞中存活的机制,并且有助于探寻疾病治疗靶点。

