CMTM家族成员在肿瘤细胞中的分子机制及潜在临床价值
姜 辉, 牟笑笑, 杨晓云*
(1)潍坊医学院临床医学院临床医学系,山东, 潍坊 261053;2)潍坊医学院基础医学院生物化学与分子生物学系,山东, 潍坊 261053)
含有MARVEL跨膜结构域的趋化素样因子基因家族(CKLF-like MARVEL transmembrane domain containing family of genes,CMTM family)是由我国学者在国际上首次报道的新的基因家族,其在人体内的生物学作用广泛,与免疫、造血和生殖系统以及肿瘤具有密切关系[1,2]。CMTM家族包括CKLF和CMTM1-8。CMTM家族成员具有不同的剪接体。其中,至少1种剪接体表达的蛋白质具有MARVEL跨膜结构域。并且此家族成员中,CKLF、CMTM1、CMTM2进化活跃,其他成员较为保守。据报道,CMTM家族在肿瘤和正常组织中有着表达差异,提示CMTM家族可能作为肿瘤相关基因调控肿瘤生物学行为[3]。Table 1列出了CMTM家族成员在不同肿瘤中的表达情况及分子信号机制。CMTM家族表达的蛋白质具有潜在的重要临床意义。例如,在预测肿瘤分期、癌症患者诊断与预后、化疗耐药等方面会发挥重要作用。CMTM家族也可作为抗肿瘤治疗的潜在靶点。深入研究CMTM为靶点的抗肿瘤新药具有广阔的空间,可为相关癌症的治疗提供新方案。本文综述了CMTM家族在卵巢癌、乳腺癌、肝癌、胃癌、结直肠癌、胰腺癌等肿瘤细胞中信号分子机制、生物学行为及其潜在的临床价值。
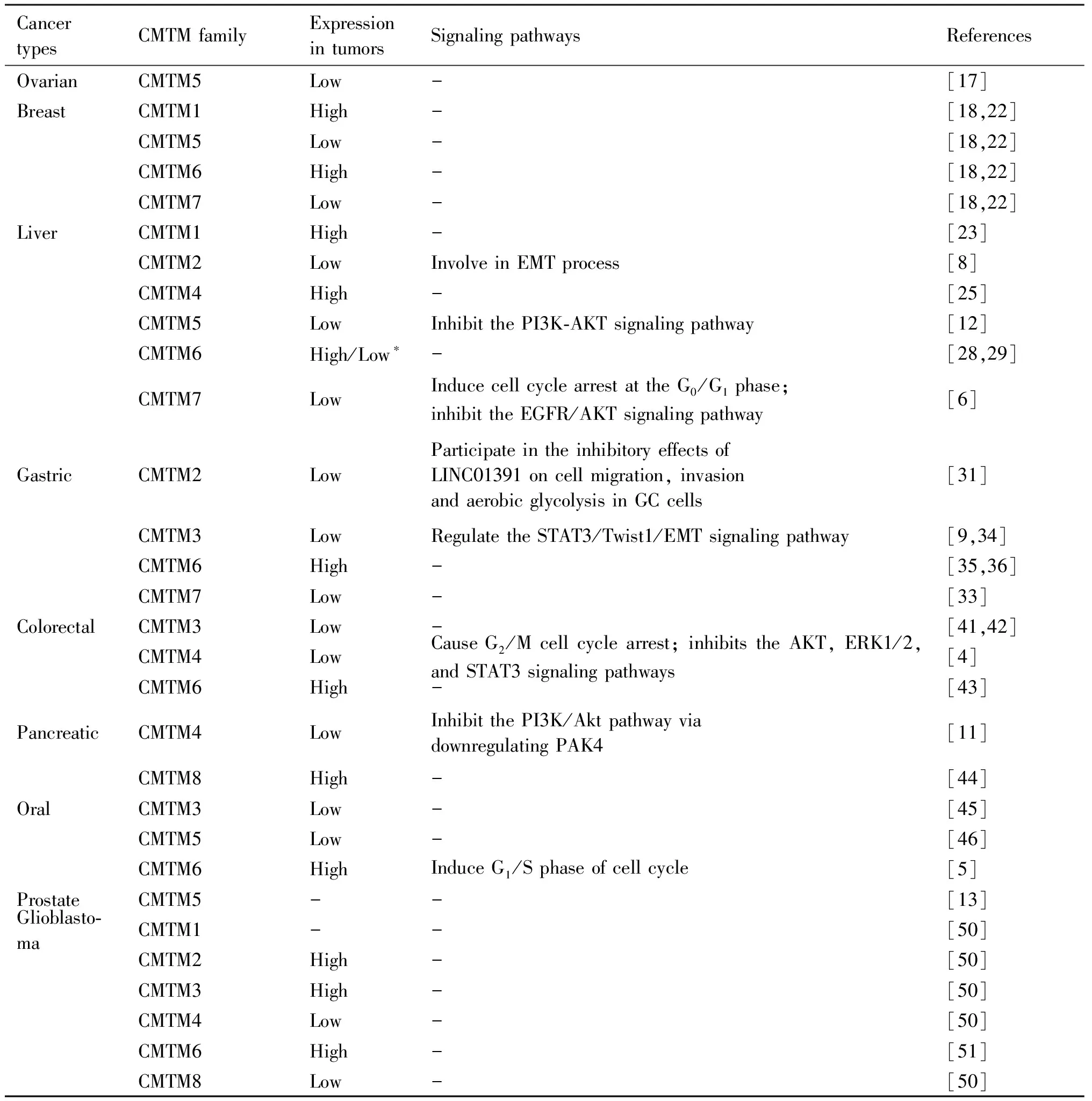
Table 1 Expressions and signaling pathways of CMTM family members in cancers
1 趋化素样因子基因家族调控肿瘤细胞生物学功能的信号转导的分子机制
1.1 调控细胞周期与细胞凋亡进程
细胞周期和凋亡的机制较为复杂,是受到多基因严格调控的过程。CMTM4可以阻滞肿瘤细胞G2/M期转换,抑制细胞增殖;CMTM5能够上调Bax, Bad等因子表达,诱导细胞凋亡;CMTM6能够诱导细胞周期G1/S期,促进细胞增殖;CMTM7能够使肿瘤细胞的细胞周期停滞在G1/S期,从而抑制细胞增殖[4-6]。
1.2 调控上皮-间充质转化进程
上皮-间充质转化(epithelial-mesenchymal transition,EMT)是肿瘤细胞侵袭和转移分子机制之一[7]。CMTM2能够抑制肿瘤细胞的EMT进程[8]。CMTM3可通过调节信号转导及转录激活因子3(signal transduction and activator of transcription,STAT3)/Twist1/EMT信号通路,抑制肿瘤细胞转移[9]。
1.3 调控表皮生长因子受体相关的信号通路
表皮生长因子受体(epidermal growth factor receptor, EGFR)的异常活化能够激活其下游信号通路,参与肿瘤的恶性生物学行为[10]。Ras/RAF/MEK/ERK和磷酸肌醇3激酶(phosphatidylinositide 3-kinase,PI3K)/蛋白激酶B(protein kinase B,AKT)信号通路是EGFR激活后启动的2条主要下游通路。CMTM4和CMTM5能抑制PI3K/AKT信号通路,从而抑制肿瘤细胞生长和转移[11-13]。CMTM7通过抑制EGFR/AKT通路发挥抑癌作用[6]。
1.4 调控肿瘤相关免疫因子
程序性死亡受体1(programmed death 1,PD-1)是一种重要的免疫抑制分子,其位于T淋巴细胞上。程序性死亡受体-配体1(programmed cell death-Ligand 1,PD-L1)是大小为40 kD的跨膜蛋白质,位于肿瘤细胞上。PD-1/PD-L1可向T淋巴细胞传递抑制信号,抑制T淋巴细胞增殖分化并诱导其凋亡。CMTM6是调控PD-L1稳定性的关键蛋白质并能够与PD-L1相互作用,保护其不被溶酶体降解[14]。CMTM6能够在蛋白质水平上调节PD-L1,可减少PD-L1的泛素化并增加PD-L1蛋白的半衰期,并受到CMTM4的协同作用[15]。CMTM6的缺失能够降低PD-L1的表达,但不会通过降低细胞表面MHC I类分子的表达影响抗原提呈[14,16]。
2 趋化素样因子基因家族在肿瘤细胞中调控机制和生物学功能
2.1 卵巢癌
卵巢癌在妇科肿瘤中发病率较高,对妇女的健康造成巨大威胁。Li等[17]研究结果表明,在80例上皮性卵巢癌标本中,CMTM5有着不同程度的表达下调,只有少数阳性表达。但在大多数卵巢囊腺瘤(12例中的10例)和正常卵巢表面上皮组织样本(10例中的9例)均表现为强阳性或中度阳性表达。他们还发现,超过46.2%(39例中的18例)的低分化卵巢癌CMTM5表达缺失,而高分化或中分化的卵巢癌CMTM5表达缺失率为14.6%(41例中的6例)。提示CMTM5的表达与肿瘤分化状态具有一定的相关性。同时,术前糖类抗原125(carbohydrate antigen 125,CA125)水平大于500 mIU/mL的患者,CMTM5表达丢失率与小于500 mIU/mL的患者相比,有增加[17]。提示CMTM5与卵巢癌的肿瘤分化及预后相关,但是CMTM5在卵巢癌中生物学机制仍需进一步研究。
2.2 乳腺癌
CMTM家族在乳腺癌中的表达与临床病理参数和预后相关。有文献[18,22]报道了CMTM家族在乳腺癌患者中的转录水平,发现CMTM1和CMTM6的转录水平显著上调,而CMTM5和CMTM7的转录水平则显著下调;同时,还研究了CMTM家族mRNA水平与乳腺癌临床病理参数的关系,发现淋巴结阳性乳腺癌患者CMTM4、CMTM5 mRNA水平低于淋巴结阴性的患者,并且雌激素受体和孕激素受体阳性的患者CMTM4、CMTM5和CMTM7 mRNA水平下降[18]。在HER2阳性的乳腺癌患者中,CMTM6、CMTM7 mRNA表达水平显著降低,而CMTM3 mRNA表达水平显著升高[18];在其与预后的关系中发现,CMTM5、CMTM6、CMTM7 mRNA的高水平表达或CMTM4 mRNA的低水平表达的乳腺癌患者预后较好[18]。由于CMTM5、CMTM7在乳腺癌组织中的变化较为显著,提示CMTM5和CMTM7可以作为乳腺癌的预后生物标志物和潜在的治疗靶点。此外,据Tian等[19]研究报道,CMTM6高表达的三阴性乳腺癌患者的无进展生存期(progression-free survival,PFS)较短,提示CMTM6可作为预测三阴性乳腺癌患者PFS的独立危险因素。但关于CMTM家族在乳腺癌中的调控机制目前仍不清楚。
2.3 肝癌
肝细胞癌占原发性肝癌的90%,是第6大常见癌症[20]。在肝细胞癌中,CMTM家族可参与细胞EMT过程并调控多种肿瘤相关的信号通路[21]。CMTM2被认为是一种潜在的肿瘤抑制因子,能够参与肝细胞癌的EMT过程。在CMTM2表达下调的肝细胞癌细胞系中,细胞上皮标志物E-钙黏着蛋白和β-联蛋白(β-catenin)的表达降低,而细胞间充质标记物N-钙黏着蛋白、波形蛋白、ZEB1(zincfingerE-box binding homeobox 1)和ZEB2的表达增加,提示CMTM2的表达下调能够诱导肝细胞癌的EMT过程[8];CMTM5会通过抑制PI3K/AKT信号通路来抑制肝细胞癌的生长、迁移及侵袭并促进细胞凋亡[12]。其机制可能为CMTM5下调PI3K, p85, pAKT及其下游信号Bcl2, 细胞周期蛋白D1(cyclin D1), 细胞周期蛋白E(cyclin E), MMP2(matrix metalloproteinase 2)和MMP9的表达,并上调p21, Bax, Bad, 切割胱天蛋白酶-3来发挥抑癌作用[12];CMTM7可调控肿瘤细胞的细胞周期抑制肿瘤增殖。在CMTM7过表达的肝细胞癌中,p27表达增高,细胞周期蛋白 D1、CDK 4(cyclin dependent kinase 4)和CDK 6的表达降低。并且p27能够与cyclin D1/CDK 4/CDK 6复合物结合并抑制其活性,阻滞G1/S周期转换,从而抑制肝细胞癌的细胞增殖[6]。此外,Ras/RAF/MEK/ERK和PI3K/AKT信号通路是EGFR激活后启动的2条主要下游通路,能够促进细胞增殖。CMTM7过度的表达能够抑制AKT激活,而对ERK激活无影响,提示CMTM7也可能通过抑制EGFR/AKT通路来抑制细胞增殖[6]。
CMTM家族在判断肝细胞癌病理分级、预后等方面具有巨大的潜在临床价值。Song等[23]经生物学分析显示,在肝细胞癌组织中CMTM1 mRNA表达水平上调,并且CMTM1的低表达与肝细胞癌患者更长的无病生存期相关。而基于免疫组化的生存分析显示,CMTM1阴性组肝细胞癌患者预后明显低于CMTM1阳性组(P< 0.05);有研究发现,CMTM2的表达与肝细胞癌患者的肿瘤分级显著相关(P<0.05),而与其他临床病理特征无相关性。并且Guo等[24]进行COX回归分析表明,CMTM2是肝细胞癌患者有关预后的独立保护因素;CMTM4 mRNA在肝细胞癌组织中表达上调,并与肝细胞癌患者预后不良相关[25]。提示CMTM4 mRNA可作为肝细胞癌潜在的预后预测及诊断指标;CMTM5的过表达能够抑制肝细胞癌细胞的增殖、迁移和侵袭能力,并可作为miR-10b-3p的靶基因而被抑制表达[26]。Guan等[26]在肝细胞癌组织和细胞系中检测到miR-10b-3p表达上调,而CMTM5的表达下调。他们还证实了miR-10b-3p上调和CMTM5下调与总生存期缩短相关。提示CMTM5和miR-10b-3p可作为肝细胞癌患者潜在的预后预测的因子。另有研究显示,CMTM5 rs3811178和CMTM6 rs164207位点的多态性可能参与了中国南方人群肝细胞癌的遗传易感性[27];粗梁-团块型肝细胞癌(macrotrabecular-massive,MTM)是肝细胞癌的特殊亚型,Liu等[28]研究表明,CMTM6和PD-L1的共表达对粗梁-团块型肝细胞癌患者的预后有着不良影响,并认为CMTM6为肝细胞癌患者的危险因素。而Zhu等[29]研究表明,在肝细胞癌组织中CMTM6表达下调,并且CMTM6的表达与肿瘤分期、转移、甲胎蛋白水平及患者预后有显著关系。他们认为,CMTM6阴性表达与肝细胞癌患者预后不良相关。综上所述,CMTM6在对肝细胞癌患者的预后影响中得到了矛盾的结果,这体现了CMTM6在肝细胞癌中表达与调控机制的复杂性。提示关于CMTM6与肝细胞癌的关系仍需要进一步研究。
2.4 胃癌
在胃癌细胞中,CMTM家族会影响癌细胞有氧糖酵解并参与细胞EMT过程。长链非编码RNA (long noncoding RNA, lncRNA)在肿瘤的有氧糖酵解中发挥关键作用[30]。CMTM2可参与lncRNA对胃癌细胞的抑制作用[31]。Qian等[31]研究发现,长链基因间lncRNA01391(LINC01391)的过表达能够抑制胃癌细胞的增殖、迁移、侵袭和有氧糖酵解,但敲低LINC01391则表现出相反的作用。他们还发现,miR-12116可能与CMTM2的3′UTR具有共享结合位点,提示miR-12116和CMTM2可能共同参与LINC01391对胃癌细胞迁移、侵袭及有氧糖酵解的抑制作用[31];CMTM3可下调Twist1的表达,来抑制胃癌细胞的EMT过程。Twist是一种诱导EMT关键转录因子,与肿瘤血管生成、肿瘤侵袭和转移等恶性生物学行为有着密切的关系[32]。Yuan等[9]研究发现,CMTM3通过上调E-钙黏着蛋白的表达和下调N-钙黏着蛋白、波形蛋白和Twist1的表达来抑制EMT。提示CMTM3能够通过调节STAT3/Twist1/EMT信号通路抑制胃癌转移[9]。CMTM7作为抑癌基因在胃癌中表达下调,而SOX 10可通过调控CMTM7的表达来调控胃癌的增殖和肿瘤生长[33]。有研究发现,在胃癌组织中,CMTM7和SOX10的表达均显著下调,且两者的表达模式具有强相关性(r=0.6455, P<0.001)[33]。提示SOX10可以作为CMTM7的转录调节因子,介导CMTM7在胃癌中的表达。
在胃癌中,CMTM家族在预测患者总生存期、肿瘤分级等方面具有潜在临床价值。CMTM3是miR-135b-5p的一个特异性靶点,并且两者在胃癌中的表达成负相关[34]。CMTM3的过度表达或使用抑制剂阻碍miR-135b-5p的表达都能够抑制胃癌细胞系SGC-7901的增殖和侵袭,且促进其凋亡[34]。由此提示,miR-135b-5p/CMTM3轴可能为预测胃癌预后和制定治疗策略提供了新靶点;Li等[35]研究表明,CMTM6高表达患者的总生存期短于低表达的患者。PD-L1阳性表达患者的总生存期也明显短于PD-L1阴性表达的患者。并且在胃癌组织中,CMTM6表达与PD-L1的阳性表达具有显著相关性。由此提示,CMTM6表达可能是PD-L1阳性表达的独立危险因素。Zhang等[36]研究认为,CMTM6和PD-L1联合检测可作为判断胃癌患者预后的指标;另有研究表明,胃癌组织中,CMTM7 mRNA的表达水平明显低于正常组织(P<0.001),并且水平随着肿瘤分级增加,CMTM7 mRNA表达逐渐降低(P<0.001)[33]。Kaplan-Meier生存曲线和log-rank检验分析显示,CMTM7高表达患者的总生存期显著提高[33]。提示CMTM7在胃癌中的低表达将是某些胃癌患者预后不良的潜在危险因素。
2.5 结直肠癌与胰腺癌
在结直肠癌的发生发展中,PI3K/AKT、MEK/ERK1/2、JAK/STAT3信号通路有着重要作用[37-40]。CMTM3在结直肠癌中发生了明显的甲基化,并可能作为结直肠癌患者早期检测的潜在表观遗传生物标志物,但其在结直肠癌中的作用机制仍需进一步研究[41,42]。CMTM4可以诱导结直肠癌细胞G2/M细胞周期阻滞,Xue等[4]研究发现,在CMTM4过表达的细胞系中,AKT、ERK1/2和STAT3的磷酸化被抑制,而敲除CMTM4它们的磷酸化水平则升高。提示CMTM4在结直肠癌中的调控机制可能由AKT、ERK1/2和STAT3依赖的信号通路所介导。他们还发现,CMTM4的表达水平与结直肠癌患者的组织学亚型、临床分期、性别、年龄和体重之间无显著相关性,但CMTM4高表达的患者的总生存期明显提高。Peng等[43]研究表明,CMTM6在结直肠癌中表达上调,并且早期结直肠癌患者CMTM6的表达水平高于晚期患者。在早期结直肠癌中,CMTM6的高表达与活跃的肿瘤免疫微环境及良好预后相关。
CMTM家族在胰腺癌中的调控机制和生物学功能仍未完全明确,但也有研究做了初步探索。CMTM4的高表达能够抑制胰腺癌,其机制可能为CMTM4可以负向调控PAK4来抑制PI3K/AKT通路,进而抑制细胞增殖[11]。此外,CMTM4是胰腺星状细胞源性外泌体miR-5703的靶点,miR-5703可以直接与CMTM4的3′UTR结合,并通过PAK4激活PI3K/AKT通路促进细胞增殖[11]。CMTM8的异位表达能够增强胰腺癌细胞的迁移和侵袭能力[44]。Shi等[44]研究发现,敲除CMTM8可减弱溶血磷脂酸(lysobisphosphatidic acids,LPA)诱导的胰腺癌细胞迁移和侵袭。
2.6 其他肿瘤
2.6.1 口腔鳞状细胞癌 在口腔鳞状细胞癌中,CMTM3、CMTM5常因启动子甲基化而表达下调,而CMTM6则高表达[5,45,46]。研究发现,ATAD2(ATPasefamily AAA domaincontaining 2)蛋白表达与CMTM6的表达显著相关,并且ATAD2蛋白的过表达提示口腔鳞状细胞癌预后不良[47]。Zheng等[5]研究发现,CMTM6和NRP1(neuropilin-1)在口腔鳞状细胞癌中均高表达,且两者表达显著相关。CMTM6通过调控NRP1促进肿瘤细胞的增殖和侵袭。同时发现,CMTM6能够诱导细胞周期G1/S期促进细胞增殖,并促进EMT。
2.6.2 前列腺癌 CMTM5在前列腺癌中几乎不表达,但在良性前列腺增生组织中表达[13]。EGFR信号通路在前列腺癌的发展、转化中发挥重要作用[48]。Yuan等[13]研究发现,CMTM5-v1可降低p-EGFRTry117以及p-AKT的水平,提示CMTM5-v1可以通过抑制EGFR和AKT的磷酸化,从而减弱前列腺癌细胞中EGF诱导的受体信号。
2.6.3 胶质母细胞瘤 胶质母细胞瘤是最常见的原发性恶性脑肿瘤,病死率高,预后差[49]。CMTM1和CMTM3能够促进肿瘤细胞体外增殖和侵袭,并与患者总体生存率显著降低相关。这表明,CMTM1和CMTM3可能是胶质母细胞瘤的发病机制中最为重要的致癌基因[50]。并且其下游信号可能通过生长因子受体,Src家族激酶和WNT的激活进行传递[50]。另有研究发现,CMTM6的过表达与胶质母细胞瘤的高恶性程度相关[51]。
3 问题与展望
自CMTM家族被发现以来,对该基因家族与男性生殖系统、免疫系统、血液系统以及肿瘤发生发展的相关研究开展的越来越多。CMTM家族与肿瘤发生发展的关系已被广泛研究,但要了解CMTM家族表达调控的分子机制,仍有许多细节需要深入研究。近年研究发现,CMTM家族在多种恶性肿瘤细胞中表达上调或下调,并参与细胞的生长增殖、侵袭、迁移与凋亡过程。在上述过程中,PI3K/AKT、EGFR/AKT、STAT3/Twist1/EMT等信号通路发挥着重要作用。本文综述了CMTM家族与卵巢癌、乳腺癌、肝癌、胃癌、结直肠癌和胰腺癌等多种常见恶性肿瘤的关系,但其详尽的分子机制目前尚未完全明确。相信随着研究的进一步深入,CMTM家族在肿瘤中的表达、生物学作用以及调控机制将会进一步完善,并为肿瘤的诊断、治疗以及预测预后等方面提供新的思路和靶点。

