桑芩止咳浓煎剂对咳嗽变异性哮喘急性发作期患者小气道功能的影响*
林孔秦 赵建高 林 浩 刘 坤
(南京中医药大学附属南京市中西医结合医院,江苏 南京 210014)
咳嗽变异性哮喘(CVA)又可称为隐匿性哮喘,主要特征为长期反复发作的咳嗽,属于哮喘的特殊类型,30%~40%的患者最终会发展为典型哮喘[1]。CVA与典型哮喘一样,具有气道高反应性及慢性气道炎症等病理生理基础,在吸入油烟、灰尘、冷空气等刺激性气体或呼吸道感染、运动等情况下急性发作,故临床治疗方法也与典型哮喘基本一致,多应用吸入性糖皮质激素(ICS)、支气管扩张剂、白三烯受体拮抗剂(LTRA)等进行治疗,但并不能完全控制CVA的反复发作[2]。为克服单药治疗效果不佳或长期大剂量使用同一种药物所致不良反应,临床多采用联合疗法,在一定程度上增加了患者的经济负担,部分患者依从性不高。中医药在咳嗽的诊疗方面具有丰富的理论基础与独特的优势,其治疗CVA也获得了广泛重视。本研究采用自制桑芩止咳浓煎剂联合西药治疗急性发作期CVA,观察其对患者小气道功能的影响,并尝试从炎症相关因子的变化方面揭示其部分作用机制。
1 资料与方法
1.1 病例选择 1)诊断标准:西医诊断参照《咳嗽的诊断与治疗指南(2015)》[3]中对CVA的诊断标准;中医诊断参照《咳嗽中医诊疗专家共识意见》[4]中“痰热郁肺证”。2)纳入标准:符合CVA西医诊断标准及中医辨证;处于疾病急性发作期;年龄18~75岁;近3个月内未接受激素、支气管扩张剂等相关治疗;意识清楚,认知功能及沟通能力正常,能够配合临床试验;自愿参与本次临床试验并愿意接受中药治疗。3)排除标准:已明确诊断为典型哮喘者;合并慢性阻塞性肺疾病、肺结核、肺癌等严重肺系疾病者;因呼吸道感染等其他疾病所致咳嗽者;先天性支气管发育不良及囊性纤维化者;合并造血系统疾病、严重心、肝、脑、肺、肾等脏器原发病或功能障碍者;合并内分泌系统疾病等可能影响炎症因子水平者;长期吸烟、酗酒或药物依赖者;过敏性体质、既往多种药物过敏史或对本研究用药过敏者;合并精神神经系统疾病者;妊娠期或哺乳期女性。
1.2 临床资料 选取2018年6月至2020年6月在本院门急诊就诊且符合入选标准的急性发作期CVA患者160例为研究对象。按照随机数字表法分为对照组与观察组各80例。观察组男性48例,女性32例;年龄22~75岁,平均(41.85±5.12)岁;CVA病程8~40周,平均(25.79±6.02)周;本次急性发作时间 1~7 d,平均(3.01±0.75)d。对照组男性51例,女性29例;年龄19~75岁,平均(41.26±5.06)岁;CVA病程8~36周,平均(25.12±5.74)周;本次急性发作时间1~5 d,平均(2.71±0.69)d。两组患者的基线资料均衡,差异无统计学意义(均P>0.05)。本次研究方案经过医院伦理委员会审核且批准通过,患者均签署知情同意书。
1.3 治疗方法 1)对照组参照《咳嗽的诊断与治疗指南(2015)》[1]在常规对症治疗基础上给予ICS治疗,即布地奈德/福莫特罗吸入粉雾剂(信必可都保,瑞典阿斯利康公司,每吸 80 μg/4.5 μg,国药准字H20140459)吸入治疗,每次1~2吸,每日2次,吸入后屏气8~10 s,然后缓慢呼气,再以清水漱口。症状缓解后降低至每次1吸,每日1次维持治疗。用药期间注意防寒保暖,预防感冒,清淡饮食,戒烟戒酒。2)观察组在对照组基础上给予桑芩止咳浓煎剂,组方:鱼腥草15 g,桑白皮、黄芩、焦栀、浙贝母、白前各10 g,紫苏子、蝉蜕各9 g,姜半夏、陈皮、桔梗、甘草各6 g。由医院制剂室统一煎制为浓煎剂,2剂为1瓶(100 mL),每次25 mL,早晚各1次温服。两组均治疗14 d后评定疗效。
1.4 观察指标 1)咳嗽症状评价。观察并记录两组咳嗽减轻时间、日咳消失时间与夜咳消失时间;分别于治疗前及治疗7、14 d后按照“哮证”的症状分级量化标准拟定中医证候(TCM)评分标准[5],即咳嗽、喉痒、咽痛3项主要证候,按轻度、中度、重度以2、4、6分评价,各项评分之和为TCM总分。2)血清炎症因子检测。治疗前后抽取空腹清晨静脉血5.0 mL,离心分离血清置于-80℃冰箱内保存统一检测。采用双抗体夹心酶联免疫吸附法(ELISA)测定血清白细胞介素-4(IL-4)、白细胞介素-6(IL-6)、干扰素-γ(INF-γ)、肿瘤坏死因子-α(TNF-α)、神经生长因子(NGF)、基质金属蛋白酶-2(MMP-2)、基质金属蛋白酶-9(MMP-9)、基质金属蛋白酶抑制剂-1(TIMP-1),常规检测嗜酸性粒细胞百分比(EOS)。3)肺功能指标检测。由固定检查人员采用同一型号的肺功能仪测定基础肺功能指标,包括用力肺活量与第1秒用力呼气容积(FEV1)比(FEV1/FVC)与呼气流速峰值占预计值百分比(PEFR pred);采用气道测定仪检测呼气中期瞬间流速(FEF50%)、呼气后期瞬间流速(FEF75%)、最大呼气中期流速占预计值百分比(MEEF pred%)。4)安全性评价。统计用药期间不良反应或并发症发生情况,治疗前后各检查1次肝肾功能及三大常规指标。
1.5 疗效标准 参照文献[4-5]拟定。临床控制:诸项症状及阳性体征消失,TCM积分减少≥95%。显效:诸项症状及体征均显著改善,TCM积分减少≥70%,<95%。有效:诸项症状及体征均有所减轻,TCM积分减少≥30%。无效:诸项症状及体征均无明显变化或较治疗前加重,TCM积分减少<30%。计算总有效率=(临床控制+显效+有效)/总例数×100%。
1.6 统计学处理 应用SPSS22.0统计软件。计量资料以()表示,采用独立样本或配对样本t检验比较;计数资料以(%)表示,采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 两组治疗前后症状缓解情况比较 见表1。与对照组相比,观察组咳嗽减轻时间、日咳消退时间及夜咳停止时间均明显缩短(P<0.05)。
表1 两组治疗前后症状缓解情况比较(d,±s)
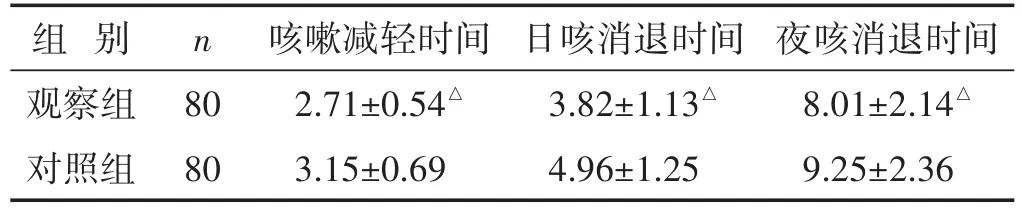
表1 两组治疗前后症状缓解情况比较(d,±s)
注:与对照组比较,△P<0.05。下同。
组别观察组对照组n 80 80咳嗽减轻时间2.71±0.54△3.15±0.69日咳消退时间3.82±1.13△4.96±1.25夜咳消退时间8.01±2.14△9.25±2.36
2.2 两组临床疗效比较 见表2。与对照组相比,观察组的显控率明显升高(P<0.05),但组间总有效率差异不明显(P>0.05)。
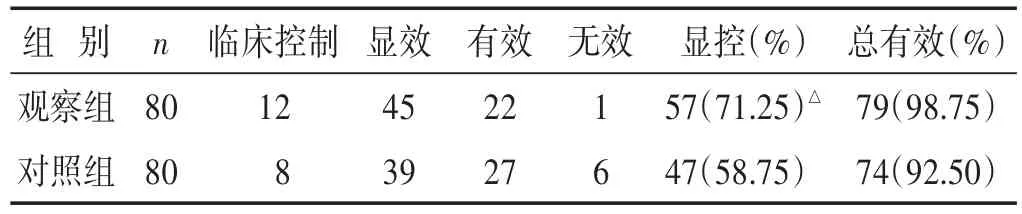
表2 两组临床疗效比较(n)
2.3 两组治疗前后TCM评分比较 见表3。治疗7、14 d后,两组评分均较治疗前有明显降低,且观察组评分均低于对照组(P<0.05)。
表3 两组治疗前后TCM评分比较(分,±s)
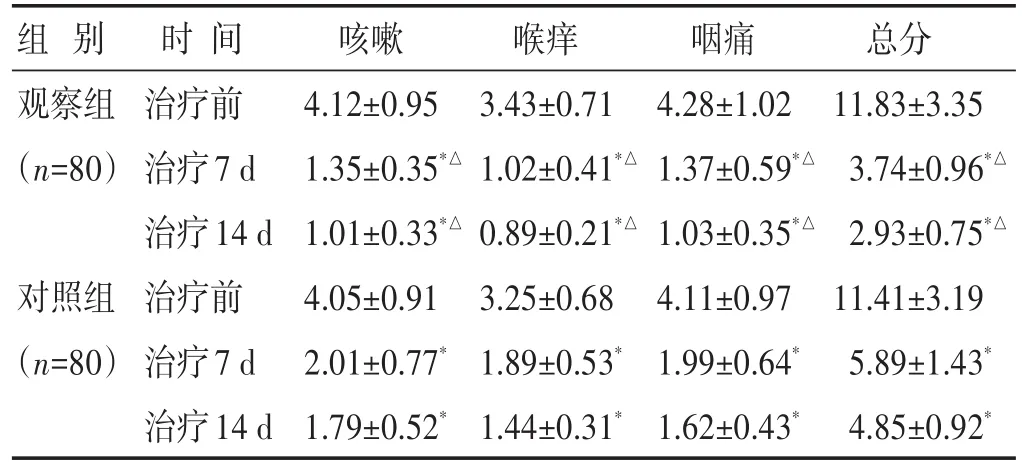
表3 两组治疗前后TCM评分比较(分,±s)
注:与本组治疗前比较,*P<0.05;与对照组治疗后同时间比较,△P<0.05。下同。
组别观察组(n=80)对照组(n=80)时间治疗前治疗7 d治疗14 d治疗前治疗7 d治疗14 d咳嗽4.12±0.95 1.35±0.35*△1.01±0.33*△4.05±0.91 2.01±0.77*1.79±0.52*喉痒3.43±0.71 1.02±0.41*△0.89±0.21*△3.25±0.68 1.89±0.53*1.44±0.31*咽痛4.28±1.02 1.37±0.59*△1.03±0.35*△4.11±0.97 1.99±0.64*1.62±0.43*总分11.83±3.35 3.74±0.96*△2.93±0.75*△11.41±3.19 5.89±1.43*4.85±0.92*
2.4 两组治疗前后血清炎症因子水平比较 见表4。治疗后,两组的EOS、IL-4、IL-6及TNF-α水平均较治疗前有明显降低,而IFN-γ明显升高(P<0.05),组间比较观察组明显优于对照组(P<0.05)。
表4 两组治疗前后血清炎症因子水平比较(±s)
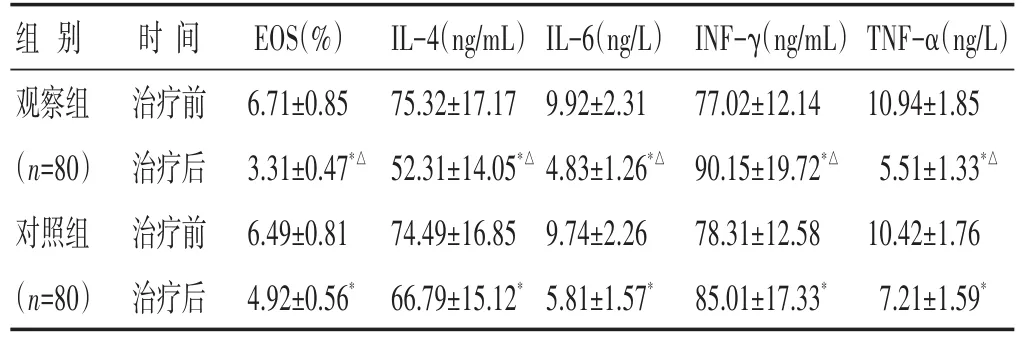
表4 两组治疗前后血清炎症因子水平比较(±s)
组别观察组(n=80)对照组(n=80)时间治疗前治疗后治疗前治疗后EOS(%)6.71±0.85 3.31±0.47*△6.49±0.81 4.92±0.56*IL-4(ng/mL)75.32±17.17 52.31±14.05*△74.49±16.85 66.79±15.12*IL-6(ng/L)9.92±2.31 4.83±1.26*△9.74±2.26 5.81±1.57*INF-γ(ng/mL)77.02±12.14 90.15±19.72*△78.31±12.58 85.01±17.33*TNF-α(ng/L)10.94±1.85 5.51±1.33*△10.42±1.76 7.21±1.59*
2.5 两组治疗前后血清NGF、MMPs、TIMP-1水平比较 见表5。治疗后,两组的血清NGF、MMP-2、MMP-9、TIMP-1水平较治疗前有明显降低(P<0.05),组间比较观察组明显低于对照组(P<0.05)。
表5 两组治疗前后血清NGF、MMPs、TIMP-1水平比较(ng/L,±s)

表5 两组治疗前后血清NGF、MMPs、TIMP-1水平比较(ng/L,±s)
组别观察组(n=80)对照组(n=80)时间治疗前治疗后治疗前治疗后NGF 102.47±23.15 40.21±15.22*△99.85±21.19 48.32±18.04*MMP-2 2.17±0.65 1.39±0.34*△2.14±0.61 1.61±0.42*MMP-9 330.85±57.96 226.41±25.19*△325.96±55.48 276.94±30.21*TIMP-1 289.41±31.29 201.15±20.43*△285.02±28.94 244.06±23.12*
2.6 两组治疗前后肺通气功能指标比较 见表6。治疗后,两组的FEV1/FVC、PEFpred、FEF50%、FEF75%、MMEF Pred均较治疗前有明显改善(P<0.05),组间比较观察组明显优于对照组(P<0.05)。
表6 两组治疗前后肺通气功能指标比较(±s)
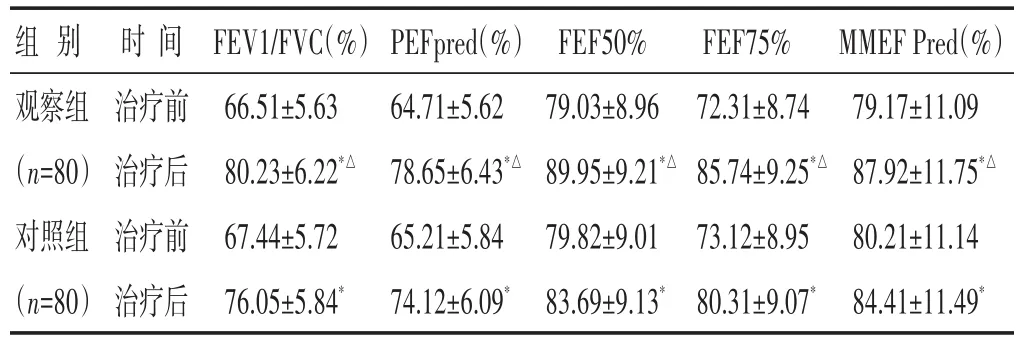
表6 两组治疗前后肺通气功能指标比较(±s)
组别观察组(n=80)对照组(n=80)时间治疗前治疗后治疗前治疗后FEV1/FVC(%)66.51±5.63 80.23±6.22*△67.44±5.72 76.05±5.84*PEFpred(%)64.71±5.62 78.65±6.43*△65.21±5.84 74.12±6.09*FEF50%79.03±8.96 89.95±9.21*△79.82±9.01 83.69±9.13*FEF75%72.31±8.74 85.74±9.25*△73.12±8.95 80.31±9.07*MMEF Pred(%)79.17±11.09 87.92±11.75*△80.21±11.14 84.41±11.49*
2.7 两组不良反应比较 两组患者用药期间均未出现肝肾功能损害、过敏反应等严重不良事件。观察组3例胃肠道不适,1例乏力,不良反应率为5.00%;对照组1例头晕头痛,1例心悸,不良反应率为2.50%。两组间不良反应率经检验,差异无统计学意义(P>0.05)。
3 讨 论
CVA属于中医学“咳嗽”“干咳”“喘证”等范畴,其发病与饮食不节、情志不畅、外感六淫、肺脏自病等密切相关,病机不外乎风、寒、邪、火等,病之初期以风寒为主,病变进程中可发生风寒化热或风热化燥、蕴热成痰等转化,故CVA多见痰热郁肺证。CVA急性发作期咳嗽明显,多因外感、内伤而致肺气失宣,气道挛急而咳嗽,根据中医“急则治其标,缓则治其本”的思想,对急性发作期CVA的治疗首选止咳平喘之法,并配合清泻肺热、宣肺化痰。桑白皮汤出自《景岳全书》,是治疗咳嗽、咳喘等症的经典名方。本研究在原方基础上加减形成桑芩止咳浓煎剂,方中桑白皮性寒味甘,入肺经,有利水祛痰、泻肺止咳之功,为本方之君。黄芩味苦性寒,入肺经,有清热燥湿、泻火解毒之功,尤善清上实火,对肺热咳嗽之证疗效颇佳[6];姜半夏性温味辛,具有燥湿化痰及降逆止咳之功,与黄芩相伍可解表里痰热往来;鱼腥草味辛性微寒,为清热解毒要药;浙贝母清热化痰,对肺火热盛之痰效果颇佳;4药相伍化痰止咳、清热解毒,为本方之臣。佐以陈皮健脾理气、燥湿化痰,配伍半夏可燥湿化痰、健运中焦;焦栀子性寒味苦,入肺经及三焦经,有泻火除烦、清热利湿之功;白前性微温,味辛苦,善泻肺降气、破壅消痰、降逆止咳;紫苏子入肺经,善敛肺气、化痰浊而定咳喘,配伍白前可加强降气化痰之功;蝉蜕升宣肺气,疏散风热、祛风解痉,为治疗刺激性干咳的良药。甘草性平味甘,可健脾和中、化痰止咳,并可调和诸药;桔梗性微温味辛苦,归肺经,有开宣肺气、祛痰排脓之功。选方组药符合CVA病机及证候特点,共奏开宣肺气、化痰止咳、理气健脾之功。
本次研究结果显示,观察组的咳嗽缓解时间更短,日咳及夜咳消失时间明显提前,与此同时,治疗7 d及14 d时,观察组无论是单项证候还是TCM总分均低于对照组,整体疗效的显控率较对照组显著提高,且观察组用药后FEV1/FVC、PEFpred均明显高于对照组,提示桑芩止咳浓煎剂用于CVA急性发作期的治疗较单纯西药治疗能够更快、更好地缓解临床症状,提高疾病控制效果,改善CVA急性发作期患者的基础肺功能。研究表明,CVA急性发作期患者在激发试验前小气道功能基本正常,但激发试验后存在一定的小气道功能障碍,且以FEF50%下降尤为明显[7-8]。本研究中,两组治疗前FEF50%、FEF75%及MMEF均高于65%预计值,但仍有下降趋势,提示CVA急性发作期存在小气道功能下降。本研究中,两组治疗后FEF50%、FEF75%及MMEF均得以明显升高,而观察组较之对照组更具优势,提示桑芩止咳浓煎剂或可改善CVA急性发作期患者的小气道功能,但其作用机制尚不明确。
气道慢性非特异性炎症是CVA的重要发病机制之一,而气道感染等因素引起的气道炎症加重是CVA急性发作的重要原因,多种细胞因子参与了该过程[9]。EOS、IL-4、IFN-γ、IL-6、TNF-α为常见的炎性因子,已被证实与CVA的发生及发作有关[10-11]。研究表明,NGF过表达所致神经源性炎症反应可促使气道高反应性的发生,并可参与气道重塑而诱导CVA及典型哮喘的发生[12]。MMP-2、MMP-9过表达可刺激多种胶原及蛋白的降解,激活基质TGF-β1等的释放,从而诱导细胞的增殖、分化,进而参与气道重塑及气道纤维化过程[13]。TIMP-1是MMPs的主要抑制剂,可抑制MMPs活性而抑制ECM的降解,导致气道壁增厚,参与气道重塑过程[14-15]。本研究中,两组治疗前血清EOS、IL-4、IL-6、TNF-α、NGF、MMP-2、MMP-9及TIMP-1均处于高表达状态,而IFN-γ表达相对不足,证实CVA患者存在一定的气道炎症反应以及气道重塑,这也是CVA发生及发展的重要机制。治疗后,两组以上指标均得以显著改善,且观察组的IFN-γ水平高于对照组,而 EOS、IL-4、IL-6、TNF-α、NGF、MMP-2、MMP-9及TIMP-1均低于对照组。结果证实桑芩止咳浓煎剂可能通过抑制气道炎症反应及气道重塑而治疗急性发作期CVA。
综上所述,桑芩止咳浓煎剂用于急性发作期CVA的治疗能够提高临床疗效,促进咳嗽等症状的缓解,改善肺功能及小气道功能,其机制或与抑制气道炎症及气道重塑有关。但本研究收集样本量较小,观察时间相对较短,检测指标有限,今后有待进一步大样本研究加以证实。

