参附注射液有效成分治疗急性心肌梗死作用机制的网络药理学研究*
蓝 洲 陀 鹏 梁镫月 朱冬玲 韦宜宾 邓海霞 赵 旋(广西中医药大学第一附属医院,广西 南宁 530021)
急性心肌梗死(AMI)的病理生理机制主要是因冠脉严重狭窄或易损斑块的破裂而导致的急性血栓形成,或伴有血管收缩剂微血管栓塞,引起心肌缺血坏死。因其住院率及死亡率呈同比上升趋势,且预后差,已严重威胁我国民众健康[1]。因此,早期发现易损斑块并进行药物或器械等预防性治疗是预防AMI的关键措施[2]。目前,进行紧急经皮冠状动脉介入治疗(PCI)及溶栓是治疗AMI的主要有效手段,最大限度地提高再灌注疗效,但治疗费用颇高,且存在较多的并发症,如急性心力衰竭、交感风暴等,尤其在出院后长期的预防用药及心脏康复治疗更给社会及家庭带来沉重的经济负担。故目前寻求有效的药物防治AMI仍是难以攻克的问题。AMI属于中医学心系病证中“真心痛”范畴,其发病基础是本虚,标实是发病条件,临床上以寒凝心脉证、正虚阳脱证为常见,故通常选用温补心阳、回阳救逆、益气固脱之方药进行干预,研究证实能取得较好的临床疗效[3-4]。目前,由红参、附子提取制作而成的参附注射液(SFI)具有很好的临床应用价值,且安全性能好,其主要生物活性源于人参皂苷及多类生物碱成分,两者相辅相成,共同发挥药物疗效。多项研究表明,SFI可发挥抑制细胞凋亡、调节免疫等作用,对心肌细胞起保护作用,可明显减轻心脏血管的再灌注损伤[5-6]。在AMI中,使用SFI得以补益阳气、温振心阳,从而达到治疗目的[7]。本研究采用网络药理学方法探讨SFI主要生物成分治疗AMI的作用机制,旨在为进一步的实验研究和临床应用提供思路。
1 资料与方法
1.1 SFI有效成分获取 通过中药系统药理学数据库与分析平台(TCMSP)数据库(https://old.tcmsp-e.com/tcmsp.php)对SFI中所含中药(红参、附子)进行检索,以生物利用度(OB)>30%、类药性(DL)>0.18为标准进行筛选,其中OB是指中药被吸收入人体循环的速度与程度,OB>30%表示有效;DL指化合物与已知药物的相似性,从而确定药物的某种化合物是作用于人体的[8]。得到符合标准的成分(Ingredients)和相关靶点(Related Targets),进而得到药物有效成分及靶点的信息表格图。
1.2 AMI与SFI对应分子靶标的获取 通过Gene-Cards数据库(https//www.genecards.org)及在线人类孟德尔遗传数据库(OMIM)(https://www.omim.org),以“AMI”为关键词,采用Cytoscape 3.6.1软件,检索得到疾病的靶点,采用ActivePerl软件、venny.R、Java插件、R软件、UltraEdit等软件分析,得到药物靶点和疾病靶点交集部分,找出药物对应疾病的关键靶点,构建疾病与药物文恩图,此处文恩图指SFI有效成分中所对应的靶点与AMI靶点相互交集的关系图,并将其可视化。
1.3 AMI与SFI的蛋白互作网络图及核心基因构建 利用SRTING数据库(https://string-db.org),复制并输入疾病与药物相交集的靶基因,以“Homo sapiens”作为检索条件,隐藏无关系的游离点,绘制出疾病与药物间蛋白互作网络图,并高清输出,统计并分析疾病与药物基因蛋白之间的连线关系(基因蛋白间连线越多,则说明该基因蛋白在疾病与药物关系中所起的作用越关键)。
1.4 基因本体生物学过程(GO-BP)富集分析及基因组百科全书(KEGG)通路分析 将疾病与药物相交集的33个基因名字转化为基因的ID,在R软件中安装citation(“DOSE”)、citation(“clusterProfiler”)、citation(“pathview”)等相应的软件包,修改相应的公众目录,运行并构成的网络图进行GO功能富集分析及KEGG的通路富集分析,以统计学P<0.05为条件进行过滤,通过此步骤明确SFI是通过调节人体的何种功能或通路来达到治疗AMI的目的。
2 结 果
2.1 SFI中有效成分 通过TCMSP数据库进行检索,以OB>30%、DL>0.18作为筛选标准,得到SFI有效成分共24个。有效成分包括谷甾醇(sitosterol)、次乌头碱(hypaconitine)、β-谷甾醇(beta-sitosterol)、人参皂苷rh2(ginsenoside rh2)等,见表1。

表1 SFI中有效成分
2.2“SFI有效成分-靶点-AMI”文恩图 见图1。利用GeneCards数据库及OMIM数据库,以“AMI”为检索关键词,得到疾病的靶点共3 341个,如白细胞介素-6(IL-6)、FMS样的酪氨酸激酶3(FLT3)、肿瘤坏死因子(TNF)、肿瘤蛋白p53(TP53)、非受体型酪氨酸蛋白激酶2(JAK2)、白细胞介素-10(IL-10)等,两者取交集后获得药物成分疾病共同核心靶点33个,以文恩图形式展现,其中蓝色区域代表Disease(疾病-AMI),红色区域代表Drug(药物-SFI),暗红色区域代表疾病与药物相交集的核心靶点。
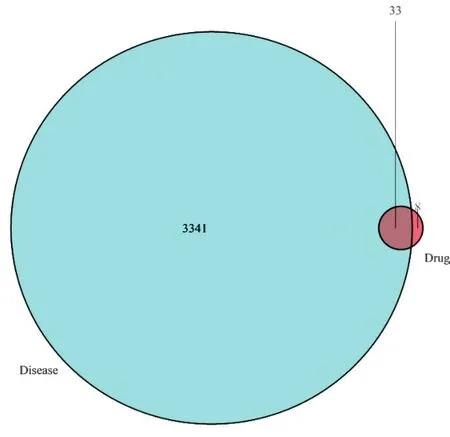
图1 “SFI有效成分-靶点-AMI”文恩图
2.3 SFI与AMI的蛋白互作网络图构建 见图2。利用SRTING数据(https://string-db.org),复制并输入疾病与药物相交集的靶点,即文恩图中两者相交集的33个靶点,以“Homo sapiens”作为检索条件,去掉游离无作用的单个蛋白靶点,在线网络生成SFI与AMI的蛋白互作网络图。由蛋白互作网络图可以得出,AMI与SFI关系较为紧密的蛋白分子有半胱氨酸-天冬氨酸蛋白酶 3(CASP3)、白细胞介素-1β(IL-1β)、半胱氨酸-天冬氨酸蛋白酶8(CASP8)、半胱氨酸-天冬氨酸蛋白酶1(CASP1)等。紫色连线表明PTGS2与CASP1、CASP3之间具有实验论证的证据。JUN与CASP9既存在融合关系,也具有共表达关系。由此,笔者可以预测JUN、CASP3、IL-1β、CASP8、PTGS2等可能是SFI治疗AMI的核心潜在靶点蛋白。
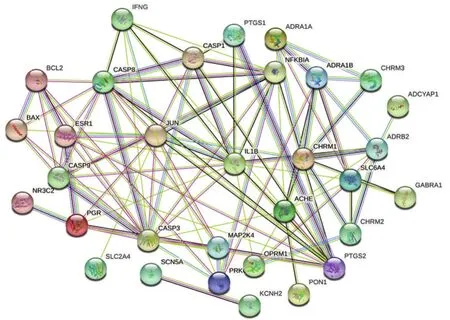
图2 “AMI-SFI”蛋白互作网络图
2.4 SFI中有效成分及靶点蛋白治疗AMI的GO功能富集分析 见图3。根据GO富集分析柱状图可知,笔者得到功能富集数目较多的活性物质共20个,颜色的不同表明不同的富集关系,其中功能富集受体活动较强的5个是:G protein-coupled amine receptor activity(G蛋白偶联的胺受体活性)、G protein-coupled neurotransmitter receptor activity(G蛋白偶联的神经递质受体活性)、postsynaptic neurotransmitter receptor activity(突触后神经递质受体活性)、acetylcholine receptor activity(乙酰胆碱受体活性)以及steroid hormone receptor activity(类固醇激素受体活性)。由此,笔者可预测SFI可能通过以上富集活性较强的受体,起到对AMI的干预作用。

图3 SFI-AMI的GO功能富集柱状图
2.5 SFI中有效成分及靶点蛋白治疗AMI的KEGG的通路富集分析 见图4~图5。由图4可以统计总共有20条相关通路,根据富集的程度,IL-17 signaling pathway(IL-17信号通路)、TNF signaling pathway(TNF信号通路)、C-type lectin receptor signaling pathway(C型凝集素受体信号通路)、p53 signaling pathway(p53信号通路)、Calcium signaling pathway(钙信号通路)、Toll-like receptor signaling pathway(Toll样受体信号通路)、NOD-like receptor signaling pathway(NOD样受体信号通路)、cAMP signaling pathway(cAMP信号通路)等通路在SFI治疗AMI过程中关联密切,同时与Lipid and atherosclerosis(脂质和动脉粥样硬化)、Hepatitis B(乙型肝炎)、Influenza A(甲型流感)、Measles(麻疹)等疾病存在关系。此外,笔者根据图4中IL-17信号通路预测,IL-17E生成因子可能通过上调或下调某些细胞分子,诱发细胞凋亡,在DNA中表达成th2相关细胞因子或趋化因子,从而诱导th2细胞反应或抑制th17细胞反应,达到调控目的。
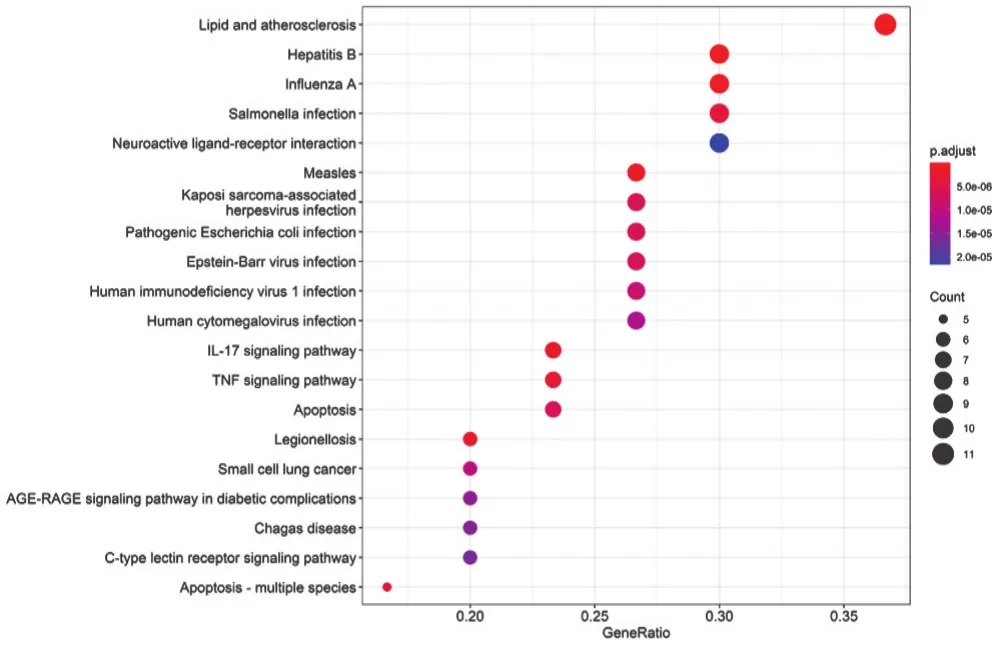
图4 SFI-AMI的KEGG气泡图
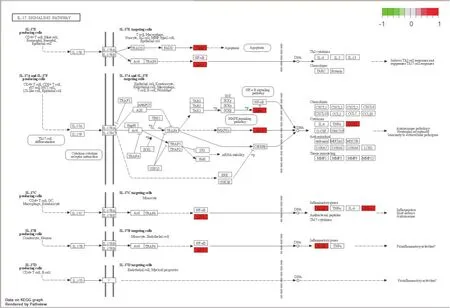
图5 IL-17信号通路图
3 讨 论
对于AMI来说,粥样硬化斑块破裂或糜烂所致的急性血栓形成,是最常见的发病原因。易损斑块主要以纤维帽较薄、脂核大、富含炎症细胞和组织因子为形态学特点,斑块破裂则与体内的炎症细胞、淋巴细胞分泌的蛋白酶相关。目前,多项研究表明,已知SFI中的有效成分对心肌细胞缺血缺氧具有保护机制[9-11]。本研究中笔者通过网络药理学的方法,检索得到参附注射液的主要有效成分,如β-谷固醇、人参皂苷rh2、芥子碱、谷甾醇、羟乙炔等。其中,β-谷甾醇广泛存在于天然植物中,通过对β-谷固醇酯化反应获得了4种新的衍生物,发现其衍生物可大大提高抗氧化酶的活性,降低了肿瘤坏死因子-α(TNF-α)、IL-1β和IL-6的水平,证实了其衍生物可对抗由TLR4和Nrf2途径介导的LPS/GalN诱导的急性肝损伤,有抗干细胞损伤作用[12]。芥子碱不仅是一种非常有价值的天然抗氧化剂,还具有显著的抗氧化、降血压、抗炎等多种生物活性功能。笔者通过检索相关中外文献,发现人参皂苷rh2广泛用于抗肿瘤、抗心肌缺血、调节免疫功能等方面。邵恳等通过对大鼠分组进行实验,发现人参皂苷Rh2可改善高脂大鼠氧化应激与炎症水平,增加大鼠心肌缺血再灌注后外周血EPCs数量,从而保护受损心肌[13]。同时,笔者发现SFI可能通过关系较为紧密的JUN、CASP3、IL1B、CASP8、PTGS2等蛋白分子,达到治疗AMI的疗效。吴林慧等通过实验表明,Casp3可促进Jun的表达,达到抑制肾癌细胞的增殖,加快癌细胞凋亡的作用[14]。Caspase-3是一种蛋白酶,一般认为Caspase-3是细胞凋亡过程中最主要的终末剪切酶,也是CTL细胞杀伤机制的重要组成部分。Riedel等发现体内尿酸对CASP3的不可逆转抑制,可减少肝细胞凋亡[15]。CARD8和IL-1B多态应激反应可治疗新生儿体温过低的缺氧缺血性脑病[16]。此外,在GO功能富集分析上得出在SFI治疗AMI中主要的蛋白活性受体,其中,G蛋白偶联的胺受体活性具有自主神经系统的调节的功能,在AMI发病过程中,心肌耗氧量的增加以及心肌氧释放的减少,如心跳加速、疼痛、发热、低血压等,均会导致心绞痛恶化加重或心源性休克。Katie发现肾上腺G蛋白偶联受体激酶2在心力衰竭中交感神经系统中具有调节作用[17]。研究发现,α7nACh受体激动剂可上调心肌细胞p-GSK-3βSer9蛋白表达,而p-NF-κB p65 Ser536蛋白表达下调,具有降低GSK-3β活性抑制炎性反应,从而减轻大鼠心肌细胞缺氧复氧损伤[18]。
在KEGG的通路富集图中笔者得到20条富集程度较高的通路。图5显示IL-17信号通路家族包含IL-17E、IL-17A、IL-17C等,此外,其受体家族包括IL-17RA、IL-17RB、IL-17RC等。2017年苏静丽等提出抑制IL-17可能是治疗心肌缺血再灌注损伤的新型治疗靶向通路[19]。而今,多项研究已证实,IL-17与多个器官缺血再灌注损伤的发病机制有关,尤其在心肌再灌注损伤中具有很好的抗缺血作用。郭梅等采用IL-17A对小鼠冠脉进行实验,发现不同浓度IL-17A能够促进原代心肌细胞凋亡,诱导Caspase-3、Bax表达,抑制Bcl-2及PI3K/Akt通路蛋白表达,起到保护心肌细胞的作用[20]。另有研究发现,心肌梗死后,IL-17A、IL-17F和IL-17受体的表达均升高,表明在心肌缺血再灌注损伤期间IL-17细胞因子及其受体的表达升高,IL-17可增强心肌梗死期间的心肌嗜中性粒细胞募集,促进梗死后的炎性反应和凋亡反应[21-22]。由此,笔者预测在治疗AMI中,SFI可能靶向作用IL-17细胞因子或其家庭细胞因子,通过上调或下调作用诱发细胞凋亡,从而改善急性心肌梗死中心肌细胞的缺血缺氧。此外,笔者还发现TNF、C型凝集素受体及p53等信号通路与AMI、SFI同样具有密切关联,值得深入探索。
综上所述,SFI中的有效成分在治疗AMI中起重要角色作用,可调节相关细胞因子,与抗缺血缺氧、抑制凋亡和炎症反应等多个靶向通路联系密切。本研究为SFI治疗AMI的进一步临床试验研究提供了网络药理学理论基础,但其具体靶向分子作用机制需进行深入研究。

