具有万古霉素高产能的东方拟无枝酸菌诱变株的选育研究
陈德刚,牛 春,李春玲
(宁夏泰瑞制药股份有限公司, 银川 750101)
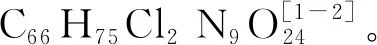
目前,国内万古霉素发酵生产中普遍存在产率不高、质量不稳定等问题,根本原因在于缺少优良的发酵菌株[9-11]。因此,亟待开展万古霉素发酵高产菌株的选育研究。阮丽军等[12]通过UV(紫外)诱变,选育出一株效价、万古霉素抗性得到显著提高的突变菌株A.orientalis6-21。陈代杰等[13]运用UV诱变、激光诱变、NTG诱变及其复合诱变,结合卡那霉素、万古霉素和甘油抗性筛选,选育出生产能力极大提高的高产突变株。虽然万古霉素发酵菌种选育已取得长足进步,发酵效价达到4000 μg/L,但与发达国家约10000 μg/L效价水平还存在较大差距,菌株发酵特性还有待进一步提升。鉴于此,本研究以引进保存的产万古霉素的(Amycolatopsisorientalis)V-1806菌株作为原始菌株,利用EMS (甲基磺酸乙酯)、UV以及ARTP(常压室温等离子体诱变)、激光诱变及其复合诱变的方法,对菌株进行诱变处理,选育出优良发酵菌株,以期提升万古霉素发酵水平。根据《中华人民共和国农业农村部公告第250号》,万古霉素及其盐、酯在食品动物中禁止使用,此研究亦可为其他产品发酵菌种的选育提供借鉴。
1 材 料
1.1 材料 原始菌株为万古霉素的东方拟无枝酸菌(Amycolatopsisorientalis)菌株,由本实验室保藏。试剂为国产和国外分析纯;恒温振荡摇床(武汉科学仪器厂,编号:HQL150C)、恒温恒湿培养箱(江苏杰瑞尔电器有限公司,编号:LHP160)、ARTP等离子体生物育种机(北京思清源生物科技有限公司,编号:ARTP-Ⅱ型),紫外分光光度计(编号:BECKMANDU-600)、高效液相色谱仪(Watesr)。
1.2 培养基及培养条件 斜面和分离培养基(g/L):葡萄糖 5,麦芽提取物 1,酵母提取物 1,琼脂 20, pH 6.0,26 ℃,培养10 d[7]。
种瓶培养基(g/L):淀粉10,葡萄糖 10,蛋白胨 5,酵母粉 3,氯化钠 2,碳酸钙 2, pH7.0,斜面挖块接种于种子培养基中,250 mL的三角瓶装量 40 mL,置于26 ℃摇床,220 rpm振荡培养 26 h[6]。发酵瓶培养基(M/V):黄豆饼粉3%,玉米浆3%,葡萄糖6%,硫酸铵 0.1%,磷酸氢二钾 0.1%,碳酸钙 0.4%,pH自然,装量为500 mL锥形瓶装量80 mL,26 ℃,220 rpm振荡培养[9]。
中试(500 L)培养基(g/L):淀粉20,蔗糖53,玉米浆98,酵母粉10,硫酸铵4,磷酸二氢钾 1,氯化钙 2,碳酸钙 0.5,纯水1 L,pH自然,培养温度26 ℃,培养湿度36%,培养时间7 d[10]。
2 方 法
2.1 孢子液的制备 参考文献[14]的方法。取成熟斜面孢子,用4.5 mL无菌水冲洗,将冲洗的孢子液用研磨器研磨,然后将菌液用滤纸过滤,离心管收集滤液,稀释至1×10-6浓度备用。
2.2 菌株诱变方法
2.2.1 甲基磺酸乙酯(EMS)诱变 取20 mL的孢子液于灭菌三角瓶(50 mL)中,加入EMS (终浓度0.2%),放在摇床上振荡培养,诱变处理时间分别为1、2、4、6、8、10 h,然后将孢子液均匀涂布于分离培养基上,以未经EMS处理的孢子液作为对照,于26 ℃培养箱培养 10 d。
2.2.2 紫外线(UV)诱变 取2 mL制备好的孢子液放入置有圆形磁片的培养皿中(直径为9 cm),打开预热15 W紫外灯(波长253.7 nm)30 min,将离紫外灯管置于培养皿垂直高度35 cm处,然后打开皿盖,分别采用照射0 s(对照)、20 s、40 s、60 s、80 s、100 s进行处理,盖上皿盖,诱变处理过程在黑暗条件下进行。诱变结束后,再将培养皿在黑暗处条件下放置2 h,然后吸取孢子液,均匀涂布于分离培养基上,同时取未经诱变的孢子悬液作为对照,于26 ℃培养箱中培养10 d,统计致死率。
2.2.3 常压室温等离子体(ARTP)诱变 ARTP的工作气体为纯度为99.99%的氦气,处理功率为80 W,等离子体发生器待处理样品与出口之间的距离为4 mm,气体的流量9.0 L/min。将准备好的50 μL孢子液均匀涂布于载片上,然后进行照射,照射的时间分别为0 s(对照)、50 s、100 s、150 s、200 s、250 s,用50 μL 无菌水冲洗,将照射后的菌液洗脱倒入平皿中,反复洗脱4次,均匀涂布在平皿中,同时取未经诱变的孢子悬液作为对照,在26 ℃培养箱中培养10 d,统计致死率。
2.2.4 激光(Laser)诱变 将0.5 mL的孢子悬液倒入专用玻璃小瓶(内有磁力搅拌转子),然后用波长532 nm、50 mj/pulse/s的YGA倍频脉冲激光仪照射各小瓶,照射次数分别为200、400、600、800、1000。对不同照射次数的悬液梯度稀释后涂布平板,同时取未经诱变的孢子悬液作为对照,在26 ℃培养箱中培养10 d,统计致死率。
2.2.5 EMS+UV诱变 取20 mL的孢子液于灭菌三角瓶(50 mL)中,加入EMS (终浓度0.2%),放在摇床上振荡培养,诱变处理6 h,然后从中取2 mL制备好的孢子液放入置有圆形磁片的培养皿中(直径为9 cm),打开预热15 W紫外灯(波长253.7 nm)30 min,将离紫外灯管置于培养皿垂直高度35 cm处,然后打开皿盖,照射80 s,盖上皿盖,诱变处理过程在黑暗条件下进行。诱变结束后,再将培养皿在黑暗处条件下放置2 h,然后吸取孢子液,均匀涂布于分离培养基上,同时取未经诱变的孢子悬液作为对照,于26 ℃培养箱中培养10 d,统计分析致死率。
2.2.6 UV+ Laser诱变 取2 mL制备好的孢子液放入置有圆形磁片的培养皿中(直径为9 cm),打开预热15 W紫外灯(波长253.7 nm)30 min,将离紫外灯管置于培养皿垂直高度35 cm处,然后打开皿盖,照射80 s,盖上皿盖,诱变处理过程在黑暗条件下进行。诱变结束后,再将培养皿在黑暗处条件下放置2 h,然后吸取0.5 mL的孢子悬液倒入专用玻璃小瓶(内有磁力搅拌转子),然后用波长532 nm、50 mj/pulse/s的YGA倍频脉冲激光仪照射各小瓶,照射次数1000,同时取未经诱变的孢子悬液作为对照,在26 ℃培养箱中培养10 d,统计致死率。
2.2.7 UV+ ARTP诱变 取2 mL制备好的孢子液放入置有圆形磁片的培养皿中(直径为9 cm),打开预热15 W紫外灯(波长253.7 nm)30 min,将离紫外灯管置于培养皿垂直高度35 cm处,然后打开皿盖,照射80 s,盖上皿盖,诱变处理过程在黑暗条件下进行。诱变结束后,再将培养皿在黑暗处条件下放置2 h,然后从中将取50 μL孢子液均匀涂布于载片上,然后进行照射,照射的时间分别为0 s(对照)、50 s、100 s、150 s、200 s、250 s,用50 μL 无菌水冲洗,将照射后的菌液洗脱倒入平皿中,反复洗脱4次,均匀涂布在平皿中,同时取未经诱变的孢子悬液作为对照,在26 ℃培养箱中培养10 d,统计致死率。
2.3 致死率和正突变率 每个诱变处理36孔培养皿,重复3次,以未经诱变处理的孢子液为对照,致死率等于(对照处理平皿菌落-诱变处理平皿菌落)/对照处理平皿菌落×100%;正突变率等于诱变处理效价高于对照6%的菌株数/诱变处理的菌株总数×100%。利用SPSS_21.0软件(独立样本T检验)进行统计分析。
2.4 菌株遗传稳定性测定 参考文献[6]的方法,将选育出的高产菌株以斜面形式保存,产生孢子后取少许孢子转入另一斜面,此为一代,连续传代 3次,使用摇瓶检测法测定每一代菌株的万古霉素效价,分析其遗传的稳定性。
2.5 菌株万古霉素抗性测定 孢子悬液稀释后涂布于含有5000、10000、15000 mg/L万古霉素的平板上,于29 ℃培养箱倒置培养18 d,检测菌株的万古霉素抗性。
2.6 Cu2+浓度对发酵效价的影响 在摇瓶发酵过程中,向培养基中分别添加10、20、30、40、50 mg/L的CuSO4·5H2O或CaCl2,分析不同浓度Cu2+、Ca2+对菌株发酵效价的影响。
2.7 HPLC测定 定量吸取发酵液,加入 7 倍体积的无水乙醇,充分振荡 0.5 h,5000 r/min 离心15 min,过滤,取上清液,利用HPLC测定效价。HPLC 测 定的条件:色 谱 柱Agilent Extend-C 18(4.6 mm×250 mm);流动相:甲醇∶0.1%醋酸(80∶30);检测的波长为 250 nm;柱子温度为 40 ℃。MPA 对照品为 Sigma 公司的产品[8]。
3 结果与分析
3.1 原始菌株的复壮筛选 将引进保存的12株菌株进行复壮,经过传代3次,结果发现编号V-1806菌株发酵效价最高,为4402 mg/L,而且菌株的遗传稳定性较好,作为后续诱变处理的原始菌株(表1)。

表1 原始菌株的效价及遗传稳定性
3.2 菌株诱变及筛选
3.2.1 EMS诱变 V-1806菌株经EMS诱变处理,结果发现随着处理时间的增加,菌体致死率呈现升高的趋势,处理时间为1 h时,致死率为24.7%,正突变率为5.6%;处理时间为2 h时,致死率为37.2%,正突变率为6.3%;处理时间为4 h时,致死率为68.5%,正突变率为13.7%;处理时间为6 h时,致死率为78.5%,正突变率为19.6%;处理时间为8 h时,致死率为88.5%,正突变率为14.7%;处理时间为10 h时,致死率为96.4%,正突变率为16.3%(图1)。综合考虑,确定诱变处理适宜时间为6 h。采用EMS诱变处理6 h,初筛出22株正突变菌株,经摇瓶效价检测复筛,得到3株效价显著升高的菌株(编号为Ve-1、Ve-18、Ve-21),其效价分别为4956、5145、5174 mg/L。

图1 EMS诱变不同处理时间的致死率和正突变率
3.2.2 UV诱变 V-1806菌株经UV诱变处理,结果发现随着处理时间的增加,菌体致死率呈现升高的趋势,处理时间为20 s时,致死率为10.9%,正突变率为2.3%;处理时间为40 s时,致死率为22.3%,正突变率为5.8%;处理时间为60 s时,致死率为58.5%,正突变率为17.9%;处理时间为80 s时,致死率为85.8%,正突变率为20.6%;处理时间为100 s时,致死率为93.1 %,正突变率为19.2%(图2)。综合考虑,确定诱变处理适宜时间为80 s。采用EMS诱变处理80 s,初筛出15株正突变菌株,经摇瓶效价检测复筛,得到2株效价显著升高的菌株(编号为Vu-5、Vu-13),其效价分别为5256、5533 mg/L。
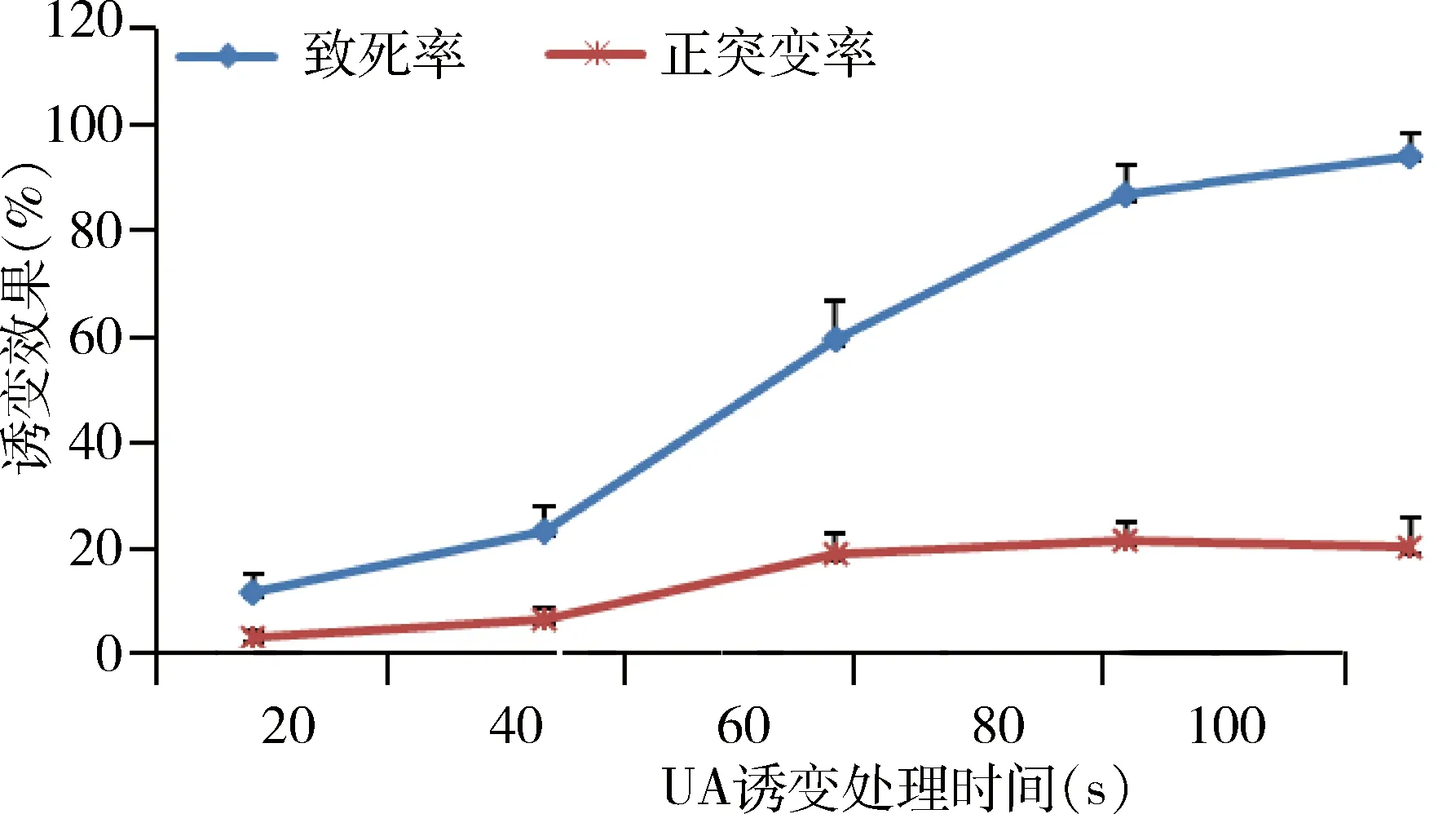
图2 UV诱变不同处理时间的致死率和正突变率
3.2.3 ARTP诱变 V-1806菌株经ARTP诱变处理,结果发现随着处理时间的增加,菌体致死率呈现升高的趋势,处理时间为50 s时,致死率为8.1%,正突变率为32.4%;处理时间为100 s时,致死率为32.4%,正突变率为12.7%;处理时间为150 s时,致死率为58.7%,正突变率为12.9%;处理时间为200 s时,致死率为88.6%,正突变率为20.3%;处理时间为250 s时,致死率为90.4 %,正突变率为16.5%(图3)。综合考虑,确定诱变处理适宜时间为200 s。采用ARTP诱变处理200 s,初筛出16株正突变菌株,经摇瓶效价检测复筛,得到2株效价显著升高的菌株(编号为Va-10、Va-12),其效价分别为4856、5424 mg/L。
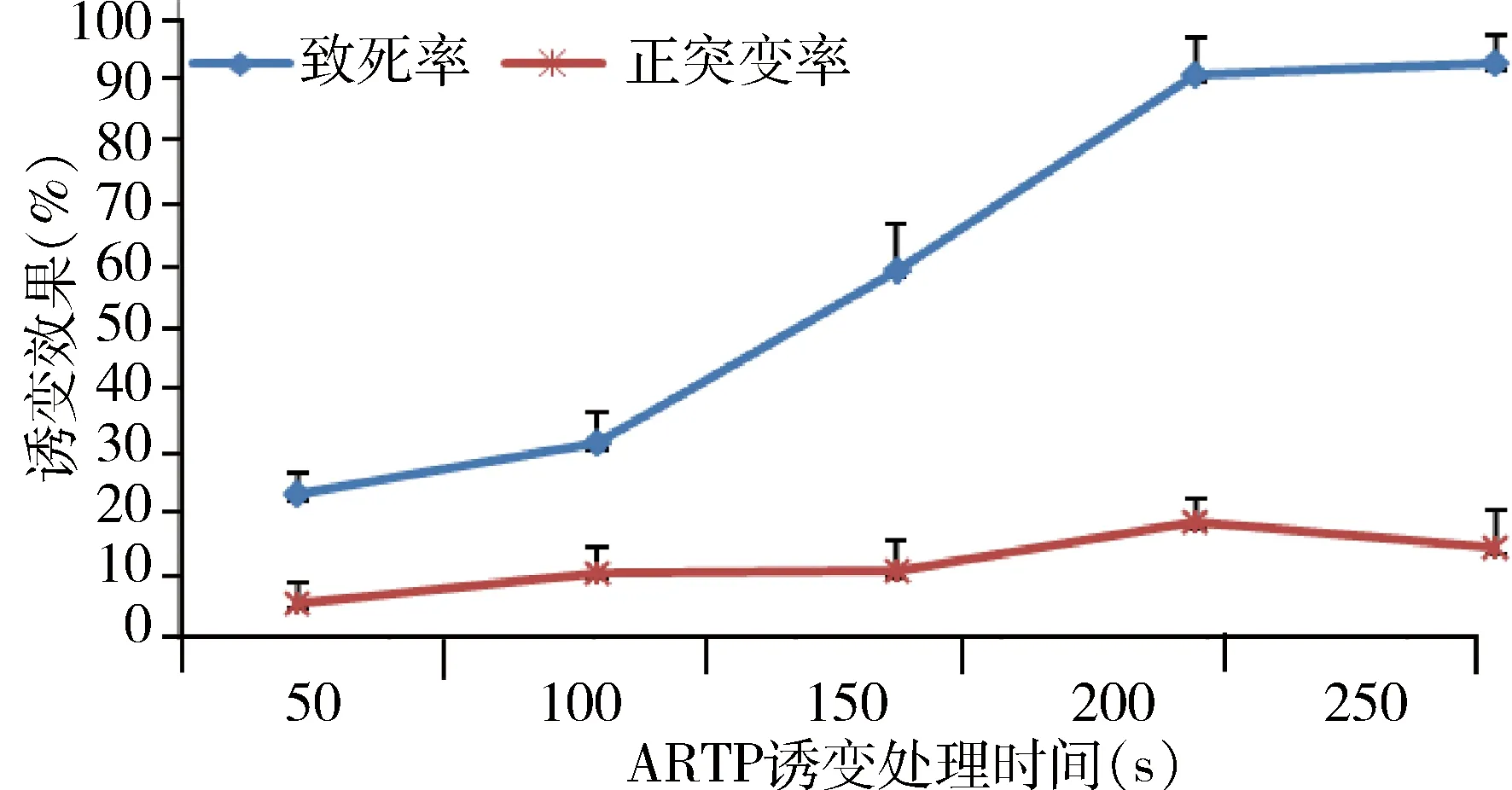
图3 ARTP诱变不同处理时间的致死率和正突变率
3.2.4 Laser诱变 V-1806菌株经激光诱变处理,结果发现随着照射次数的增加,菌体致死率呈现升高的趋势,照射次数为200时,致死率为14.5%,正突变率为3.1%;照射次数400时,致死率为23.6%,正突变率为7.7%;照射次数为600时,致死率为55.6%,正突变率为8.9%;照射次数800 时,致死率为68.6%,正突变率为15.3%;照射次数为1000时,致死率为88.4 %,正突变率为16.5%;(图4)。综合考虑,确定诱变照射次数为1000次。采用ARTP诱变处理1000次,初筛出18株正突变菌株,经摇瓶效价检测复筛,得到3株效价显著升高的菌株(编号为Vl-4、Vl-13、Vl-17),其效价分别为5044、5438、5103 mg/L。
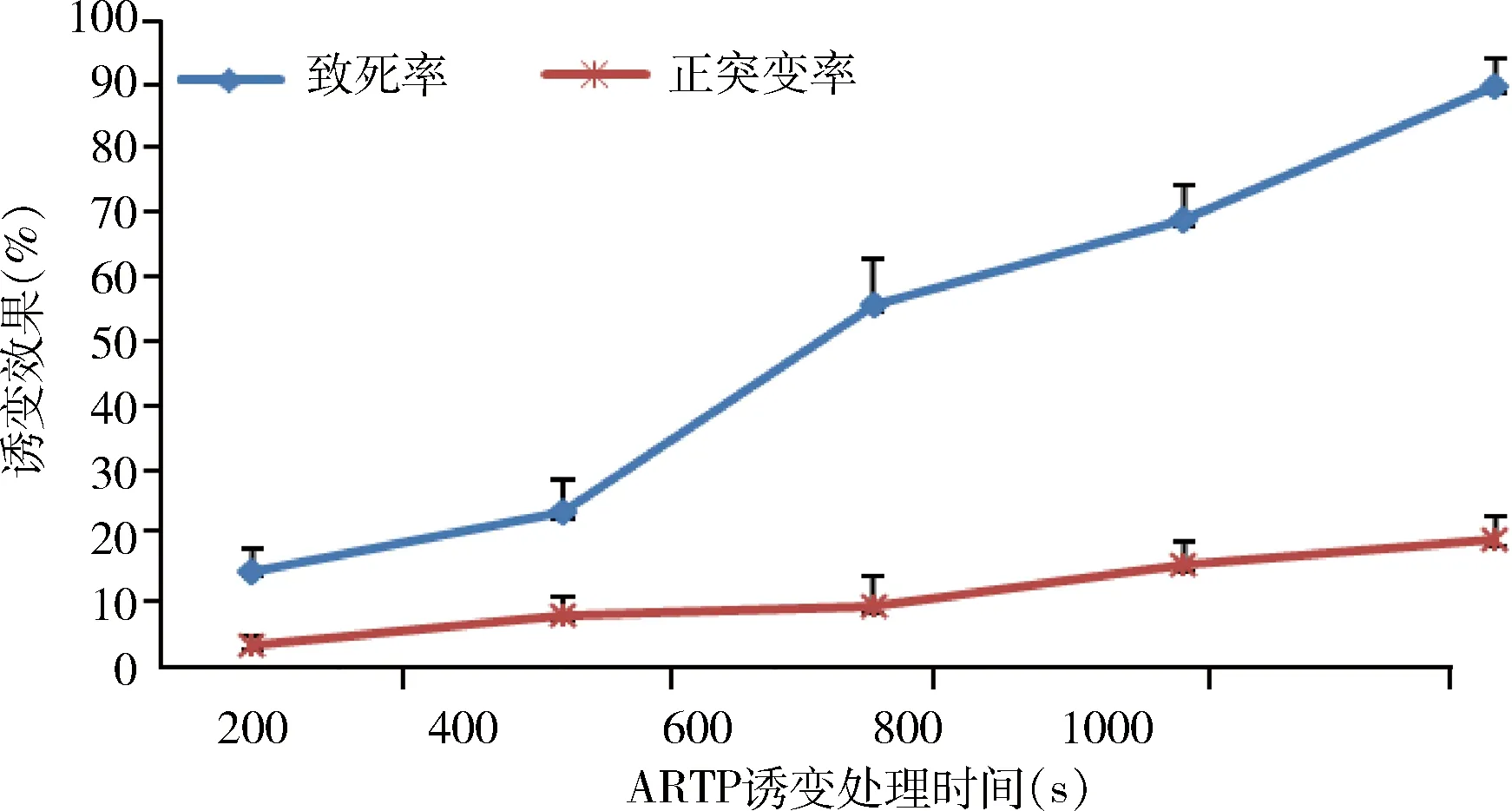
图4 Laser诱变不同处理时间的致死率和正突变率
3.2.5 EMS+UV诱变 V-1806菌株经EMS+UV复合诱变处理,菌体致死率为91.4%,正突变率为13.6%。通过初筛出13株正突变菌株,经摇瓶效价检测复筛,得到2株效价显著升高的菌株(编号为Veu-4、Veu-12),其效价分别为5562、5621 mg/L。
3.2.6 UV+Laser诱变 V-1806菌株经UV+Laser复合诱变处理,菌体致死率为92.9%,正突变率为8.6%。通过初筛出11株正突变菌株,经摇瓶效价检测复筛,得到1株效价显著升高的菌株(编号为Vul-4),其效价为5684 mg/L。
3.2.7 UV+ARTP诱变 V-1806菌株经UV+Laser复合诱变处理,菌体致死率为89.7%,正突变率为14.2%。通过初筛出17株正突变菌株,经摇瓶效价检测复筛,得到2株效价显著升高的菌株(编号为Vua-4、Vua-15),其效价分别为5742、5751 mg/L。
比较分析不同诱变方法的诱变效果,结果发现,复合诱变的致死率显著高于单一诱变,而正突变率低于单一诱变,但其筛选出的正突变菌株的最高效价显著高于单一诱变。
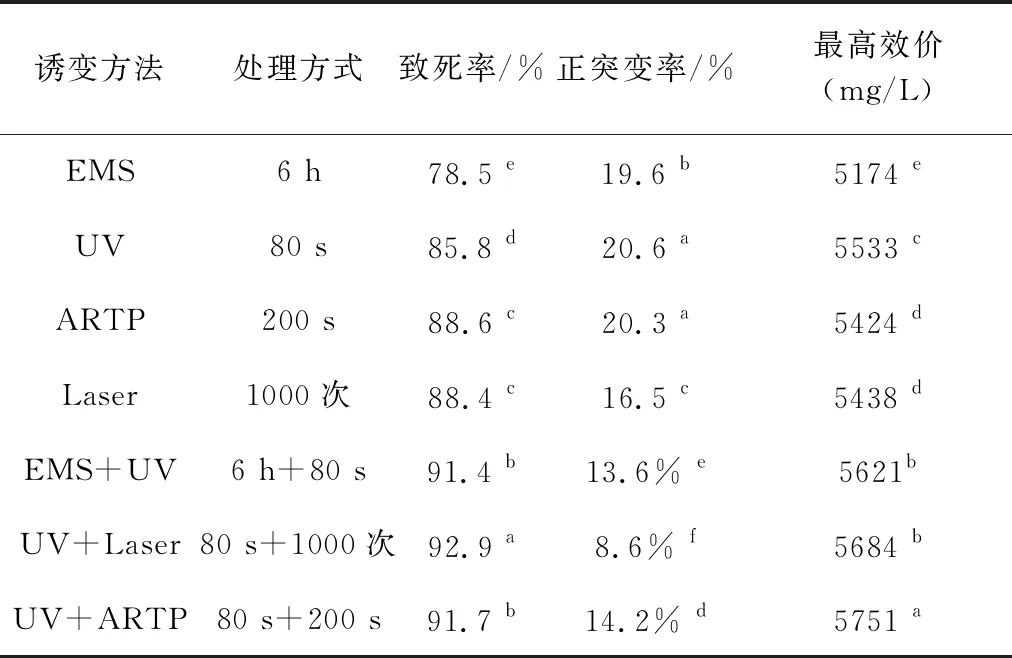
表2 不同诱变方法诱变效果的比较
3.3 选育菌株遗传稳定性的检测 对获得的优良菌株的遗传稳定性及生长特性进行检测,结果发现菌株Ve-21、Vu-13、Va-12、Veu-4、Vua-4、Vua-15的遗传稳定性较好(表3)。而且Ve-21、Veu-4、Vua-4、Vua-15菌落直径明显增大,呈白色“褶皱”状(表3、表4、图5)。
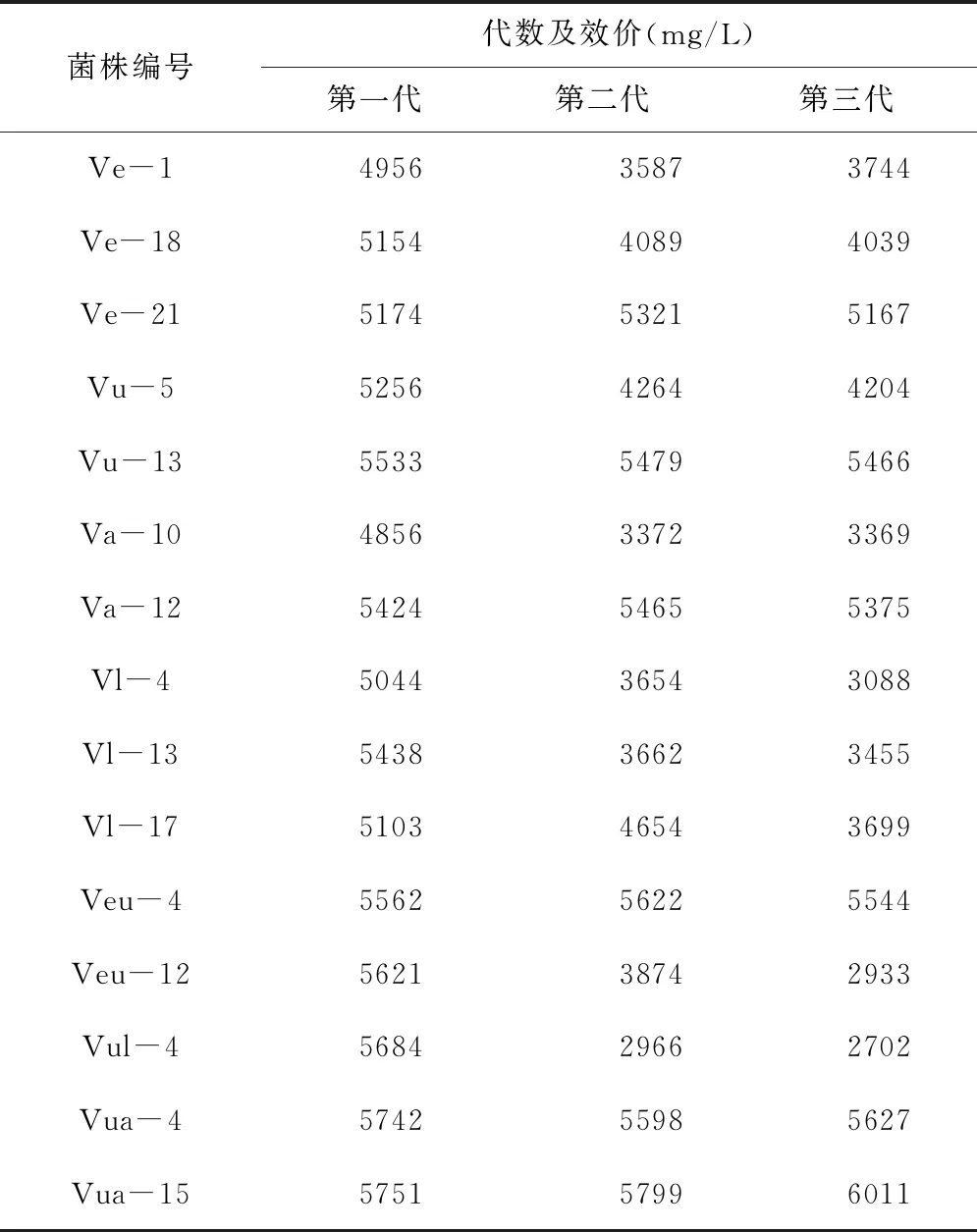
表3 优良菌种遗传稳定性分析
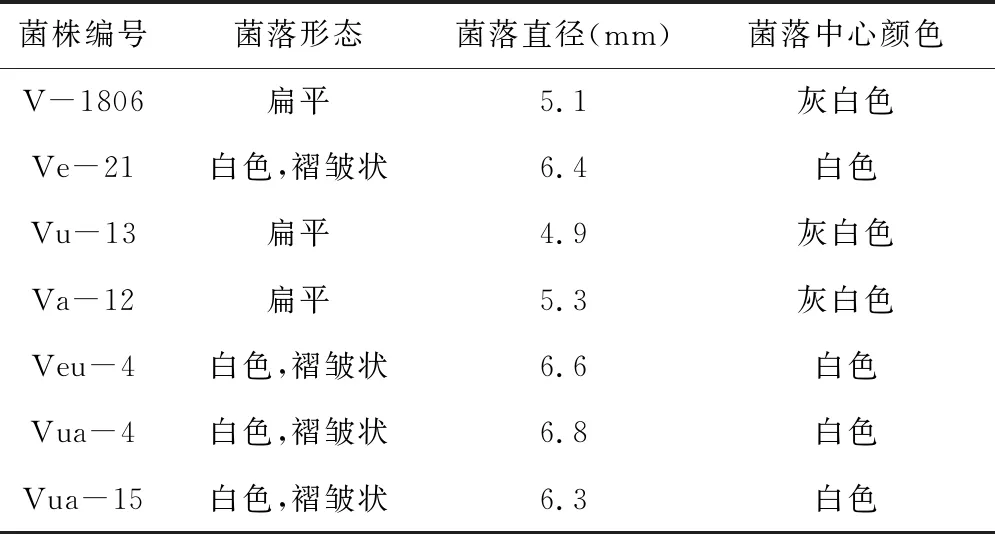
表4 优良菌种生长特性分析
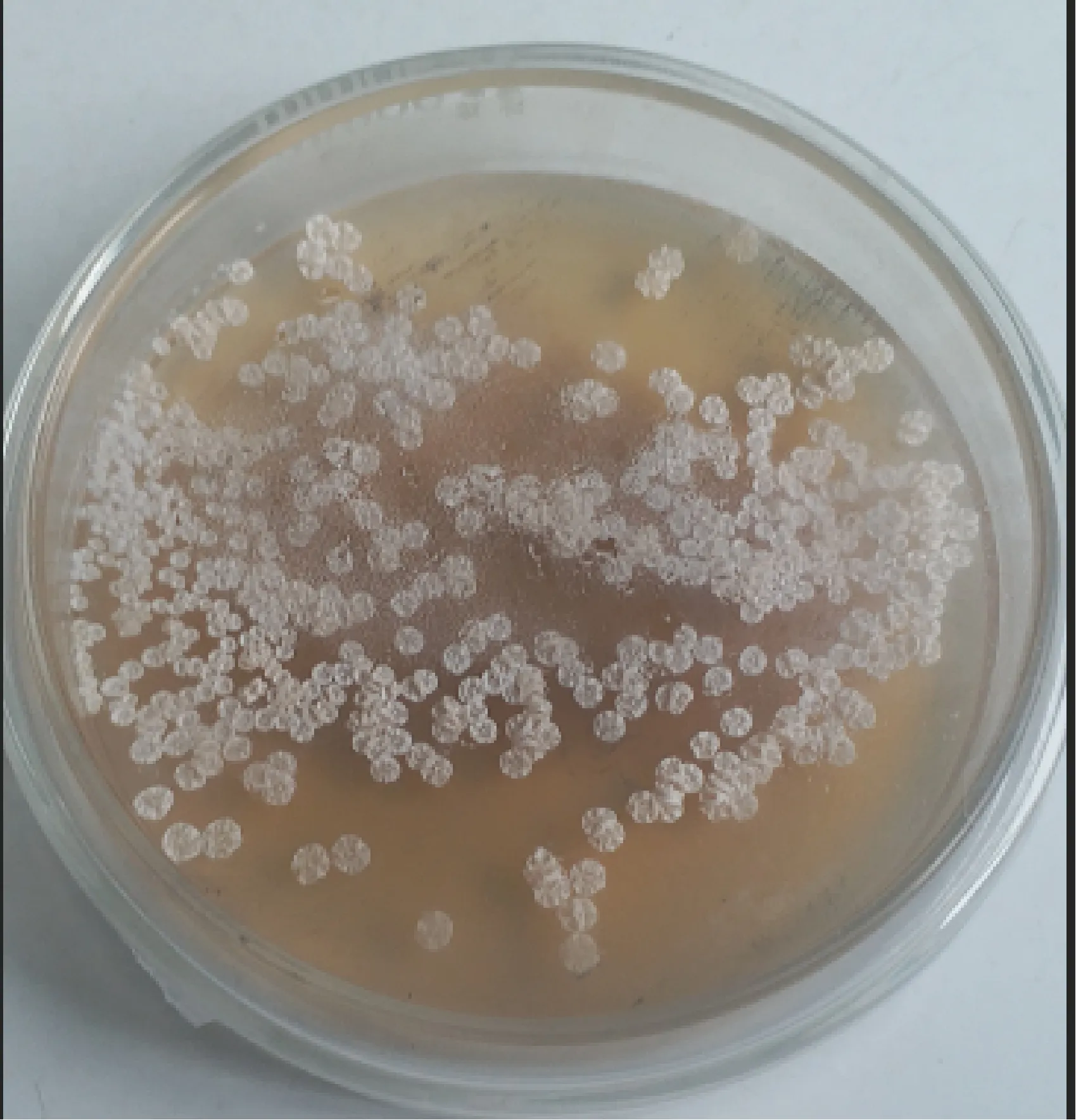
图5 万古霉素优良菌种菌落形态
3.4 选育菌株万古霉素抗性检测 对菌株Ve-21、Vu-13、Va-12、Veu-4、Vua-4、Vua-15的万古霉素进行检测,结果发现,与原始菌株相比,Ve-21、Veu-4、Vua-15菌株在含万古霉素浓度5000、10000、15000 mg/L的培养基上均能较好生长,表明这三株菌株具有较好的万古霉素抗性(表5)。

表5 菌种万古霉素耐受性检测
3.5 Cu2+对菌株发酵效价的影响 在摇瓶发酵过程中,向培养基中分别添加不同浓度的CuSO4·5H2O,结果发现Ve-21、Veu-4、Vua-15菌株在发酵效价均有所提高,CuSO4·5H2O浓度为40 mg/L时,这三株菌株发酵效价增加最大(表6)。

表6 Cu2+对发酵效价的影响
3.6 菌株SA-2 中试发酵性能的检测 以原始菌株S-225为对照,对菌株Ve-21、Veu-4、Vua-15的中试发酵性能检测进行,结果发现菌株Vua-15的效价最高,为7863 mg/L,较出发菌株V-1806的效价4512 mg/L,提高了74.3%;而且显著高于Ve-21、Veu-4的效价。Vua-15的发酵液菌丝呈现“舒展网密”,表明其具有较好的发酵生长性能(表7)。

表7 菌株中试性能检测
4 讨论与结论
诱变技术是选育万古霉素优良发酵菌种的主要途径,但目前仅见UV诱变、激光诱变相关报道[12-13]。本研究采用EMS、UV、ARTP、Laser单一诱变,以及EMS+UV、UV+Laser、UV+ARTP复合诱变的方法,选育出了优良东方拟无枝酸菌菌株Vua-15,极大的提高了菌株发酵效价。就选育效果而言,复合诱变选育的菌株性能明显高于单一诱变,这与陈代杰等[13]研究结果类似。其可能的原因是复合诱变产生的突变更多,正突变率更高,其对应的表型可能更丰富,更容易选育出符合预期的优良菌株[15]。
东方拟无枝酸菌菌株在发酵过程中易受万古霉素的反馈抑制,因此万古霉素的抗性是其关键选育指标。Vua-15具有较强的万古霉素抗性,适应发酵过程中万古霉素的积累浓度。同时,Cu2+等无机盐离子可以有效的提升东方拟无枝酸菌菌株的万古霉素发酵效价[16]。本研究对Cu2+的浓度进行了筛选,确定了40 mg/L为适宜的添加浓度,这与陈代杰等[13]、彭哲[16]的研究结论较一致。研究对菌株 Vua-15的中试发酵性能进行了初步评价,表明Vua-15具有较好的生产应用潜能,后续还需对该菌株的性能开展深入研究,以期为其他产品发酵菌种的选育提供参考。

