5种塞内卡病毒灭活疫苗佐剂的比较研究
李晓艳,齐志涛,王秉昆,赵丽霞,温学平,李 超,方建国,高艳华,杨青春,贺 瑶,张 静,宋庆庆,陈 坚
(金宇保灵生物药品有限公司,呼和浩特 010100)
塞内卡病毒病是近年来新发的一种猪传染病,由小核糖核酸病毒科塞内卡病毒属的 A 型塞内卡病毒(Senecavirus A,SVA)引起[1]。SVA在 2002 年首次发现于细胞培养基中,被认为可能是由胎牛血清或猪胰蛋白酶引入人类胎儿视网膜细胞培养物中的污染物[2]。2015年我国广东首次发现SVA的存在,随后逐渐蔓延至其他省份。猪感染SVA后的临床表现与感染口蹄疫病毒(foot-and-mouth disease virus,FMDV)类似,通常表现为沉郁、体温升高、厌食、跛行、蹄部和鼻吻出现水疱[1],临床上难以区分。SVA感染的诊断目前主要依赖于病原学和血清学方法,防控方面仍无商品化疫苗可用。另外,随着SVA在我国的传播,其毒力也逐渐致弱,目前国内猪场已频繁出现亚临床感染情况[3]。我国农业农村部2018年发布了《农业农村部办公厅关于做好SVA病防治工作的通知》,可见对该疫病的重视程度。在进行细胞培养、提升病毒效价、优化纯化工艺的同时,佐剂的选择也是疫苗制备的关键因素。因此,本试验通过自主合成佐剂原料、筛选最优佐剂配方,制备了SVA灭活疫苗,并与进口佐剂(ISA206)疫苗进行理化性质、安全性、中和抗体及攻毒保护对比试验,以期筛选最优佐剂用于SVA灭活疫苗的研制。
1 材料与方法
1.1 主要实验材料 塞内卡病毒SVV-CH/ZZ/2016株灭活抗原液,批号2021003,病毒含量108.0TCID50/0.1mL;用于做中和试验的病毒液SVV-CH/ZZ/2016株、攻毒毒株SVV-CH/22/2016株,F7,批号19023,病毒含量106.5TCID50/0.1mL;PK-15细胞(猪肾细胞);塞内卡病毒标准阳性血清和阴性血清;以上均由金宇保灵生物药品有限公司兽用疫苗国家工程实验室制备保存。体重18~22 g清洁级小鼠30只,购自呼和浩特市内蒙古大学动物实验部;90日龄以上架子猪12头,60日龄以上架子猪30头,购自呼和浩特市草原立新养猪场;ISA206佐剂购自法国赛比科公司,批号200218023298;佐剂制备原料:失水山梨醇购自山东天力药业有限公司,批号202000312;植物油酸购自四川西普化工股份有限公司。美国贝克曼粒经仪LS-230购自常州昆耀自动化科技有限公司,二级生物安全柜购自香港力申发展有限公司;水浴锅HH-420购自常州智博瑞仪器制造有限公司;二氧化碳培养箱,Thermo Fisher 14291;IKA EUROSTAR 60control悬臂搅拌器、搅拌桨R1345购自艾卡(广州)仪器设备有限公司。
1.2 佐剂制备
1.2.1 亲油性表面活性剂的制备[4]将已蒸馏的失水山梨醇与植物油酸分阶段投入反应釜内,加入催化剂,升温,开启搅拌釜至均匀搅拌,随后减压升温于205±5 ℃/700 mmHg以上反应5 h。反应完毕后待反应物冷却放出,静置24 h分去黑色胶状物,将上层澄清液抽入脱色锅内加热至65 ℃,加入催化剂,继而在搅拌下于80 ℃脱色1 h,过滤,即得亲油性表面活性剂。
1.2.2 亲水性表面活性剂的制备 将亲油性表面活性剂加入不锈钢反应釜中,加热熔化,搅拌,加入催化剂,逐渐升温,减压脱水,当温度上升至120 ℃通氮气,以驱除釜内空气,经数次充氮驱氧后开始通入环氧乙烷,当反应温度至180 ℃,通入的环氧乙烷接近需求量时,取样测定终点,然后降温至80 ℃左右时加入催化剂,20 min后进行升温脱水15 min,继续搅拌1 h,冷却,放料,得到亲水性表面活性剂。
1.2.3 佐剂合成 按照表1佐剂成分配比所示,分别量取相应成分,混合加入烧杯或佐剂配制罐内,升温至45 ℃开启搅拌桨匀速搅拌,充分溶解和混合油相至澄清透明状,分别装入透气性瓶内于121 ℃高压灭菌30 min。

表1 自制佐剂成分配比
1.3 疫苗配制 取塞内卡病毒SVV-CH/ZZ/2016株纯化浓缩灭活抗原液2500 g平均分为5份,再分别称取JY-1、JY-2、JY-3、JY-4、ISA206佐剂各500 g,在30 ℃环境下将5份抗原分别缓慢加入5份佐剂,期间以400 r/min匀速搅拌10 min,使水相与油相充分混合,维持30 min后迅速转移至2~8 ℃保存备用。
1.4 疫苗检测
1.4.1 理化检测
1.4.1.1 外观检查 将5批疫苗倒至透明玻璃瓶中,在自然光照下观察产品的颜色及状态。
1.4.1.2 剂型检查 取适量冷水至500 mL烧杯中,待液面平静后,取一清洁1 mL吸管,分别吸取5批疫苗各1 mL,从距冷水液面上方2~3 cm处滴入,3~5 s后再滴入2~3滴疫苗,从上方观察疫苗在液面的扩散情况,从容器侧面观察疫苗向下扩散的情况,并记录液滴的扩散结果。
1.4.1.3 稳定性检测 将5批疫苗温度恢复至室温,吸取疫苗10 mL加入离心管中,3000 r/min离心15 min,轻轻取出离心管,观察离心管底是否有水相析出,并记录水相体积。
1.4.1.4 黏度检测 5批疫苗分别吸取1 mL,缓缓加入样品杯内,在扭矩40%~60%、转子转速6~16 r/min的条件下,用黏度计测定疫苗黏度。
1.4.1.5 粒径检测 用美国贝克曼粒径仪检测器探测散射光强度,计算颗粒粒度分布。
1.4.2 无菌检验 用注射器分别抽取2 mL疫苗,接种TG小管2支、1支TSB小管,每支0.2 mL,TSB小管置23~25 ℃培养,1支TG小管置35~37 ℃培养,另1支TG小管置23~25 ℃培养,同时设TG小管2支、TSB小管1支做空白对照,置相应温度培养。各管均培养7 d,每天观察并做记录。
1.4.3 内毒素含量测定 分别吸取45 mL疫苗放入50 mL离心管中,置50±5 ℃水浴90 min,在4 ℃条件下,以9500 r/min离心25 min,用带长针头的注射器吸出下层水相5.0 mL(先吸取3 mL弃去再吸取2 mL)备用;择供试品阴性对照和供试品阳性对照,分别用移液器准确吸取0.1 mL加入反应管,依次加入复溶好的鲎试剂0.1 mL。混匀后迅速将反应管插入内毒素检测仪检测。
1.4.4 总蛋白含量测定 取1瓶疫苗恢复至室温摇匀后,用1 mL注射器吸取一定量疫苗,在3个1.5 mL离心管中分别精确加入100 μL疫苗,用移液器准确吸取900 μL丙酮,分别加入上述盛有疫苗的离心管中,盖好盖子后充分震荡混匀,室温放置10 min,在4 ℃条件下,以15000 r/min离心15 min。取出后,先用移液器吸弃上层的液相,只保留白色沉淀物,再用移液器分别吸取200 μL丙酮对沉淀物进行2次洗涤,将离心管开盖倒置放于纸巾上控干,室温干燥约15 min后,用移液器准确加入50 μL纯化水复溶,用Lowry法试剂盒测定总蛋白含量。
1.4.5 安全性试验
1.4.5.1 小动物安全性试验 体重18~22 g小鼠30只,随机分为6组,每组5只,5个免疫组(JY-1、JY-2、JY-3、JY-4、ISA206)各皮下注射疫苗1.0 mL,1个对照组皮下注射生理盐水1 mL。逐日观察7 d,观察小鼠有无死亡或明显的局部反应或全身不良反应,7 d后剖检注射部位,观察有无溃烂、增生、肿块。
1.4.5.2 本动物安全性试验 用90日龄以上健康猪(SVA细胞中和抗体滴度不高于1∶2或血清ELISA抗体检测阴性)12头,随机分为6组,每组2头,5个免疫组各两侧耳根后肌肉分点注射疫苗6 mL(3头份),每侧3 mL,连同对照组逐日观察10 d并监测体温,观察猪是否出现塞内卡病毒病症状或因注射疫苗引起的死亡,以及是否出现明显的局部反应或全身不良反应。
1.4.6 效力试验 选取60日龄以上健康易感猪(SVA细胞中和抗体滴度不高于1∶2或血清ELISA抗体检测阴性)30头,随机分为6组,每组5头。每个免疫组5头猪耳根后肌肉注射疫苗2 mL,免疫后第21天以相同剂量、相同接种方法加强免疫1 次,对照组5头猪不接种疫苗。分别于免前、一免7 d、一免14 d、一免21 d、二免7 d、二免14 d对疫苗试验组猪只采血进行抗体监测,于二免14 d连同对照组,每头滴鼻检验毒5 mL(0.1 mL毒液病毒含量不低于107.0TCID50),左右鼻孔各2.5 mL。攻毒后每日观察猪的发病情况,连续观察10 d。
2 结果与分析
2.1 一般检验结果 5组SVA灭活疫苗理化检验均符合疫苗生产规程要求:5组疫苗外观均呈性状均匀的乳剂;剂型为水包油包水型;稳定性检测均未出现水相析出;粒径检测结果为单峰,无杂峰;无菌检验结果为阴性;内毒素浓度均低于0.25 EU/头份;蛋白含量在56~63 μg/mL之间;四组JY佐剂制备的SVA灭活疫苗黏度检测结果为26.54~27.88 cP,均低于ISA206佐剂制备的疫苗(黏度为43.02 cP),详见表2。
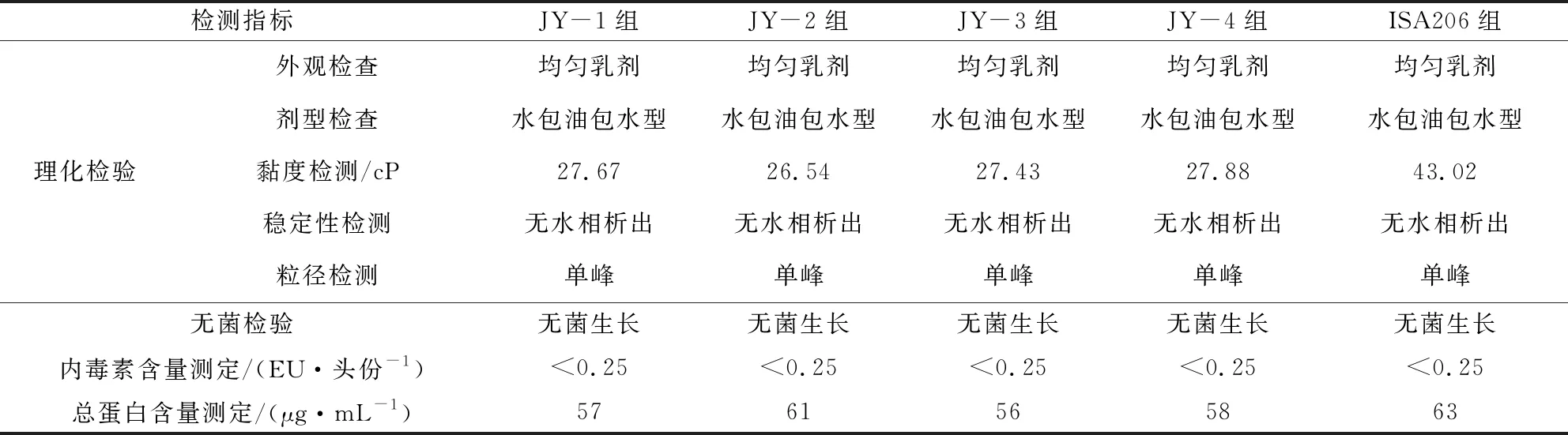
表2 5组SVA灭活疫苗一般检验结果
2.2 安全性试验结果
2.2.1 小动物安全性试验 本实验制备的5种灭活疫苗对小鼠注射部位的皮下组织均无刺激性,注射局部均未见溃烂、增生、肿胀及其他与疫苗相关的反应,5种佐剂制备的疫苗免疫小鼠后,小鼠剖检结果均未见明显异常,见图1。
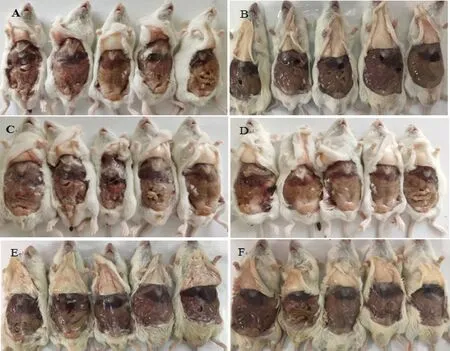
A:JY-1组;B:JY-2组;C:JY-3组;D:JY-4组;E:ISA206组;F:对照组
2.2.2 本动物安全性试验 本实验制备的5种灭活疫苗3倍免疫剂量肌肉注射仔猪,连续观察10 d并监测体温,结果显示,注射局部均未见红、肿、热等反应,免疫后前2 d出现体温轻微升高,于免后第3天体温恢复至正常,未见由疫苗引起的全身或局部不良反应,仔猪发育良好,精神和食欲都正常。自主开发的4组佐剂制备的疫苗试验结果与ISA206佐剂无安全性差异,表明新佐剂对仔猪安全性未产生影响。将每组中2头猪监测的体温取平均值绘制曲线,结果见图2。

图2 体温监测结果
2.3 效力试验结果
2.3.1 中和抗体检测结果 阴性对照组SVA中和抗体滴度为0,其他5种疫苗免疫仔猪,SVA抗体滴度呈现逐渐上升的趋势,一免7 d开始全部产生中和抗体,一免21 d中和抗体均大于28,二免14 d中和抗体滴度大于211,四组JY佐剂均能达到ISA206佐剂的水平,且高于进口佐剂约1个滴度。其中,JY-1佐剂抗体产生最快且中和抗体滴度最高。5种疫苗免疫仔猪中和抗体检测结果见图3。
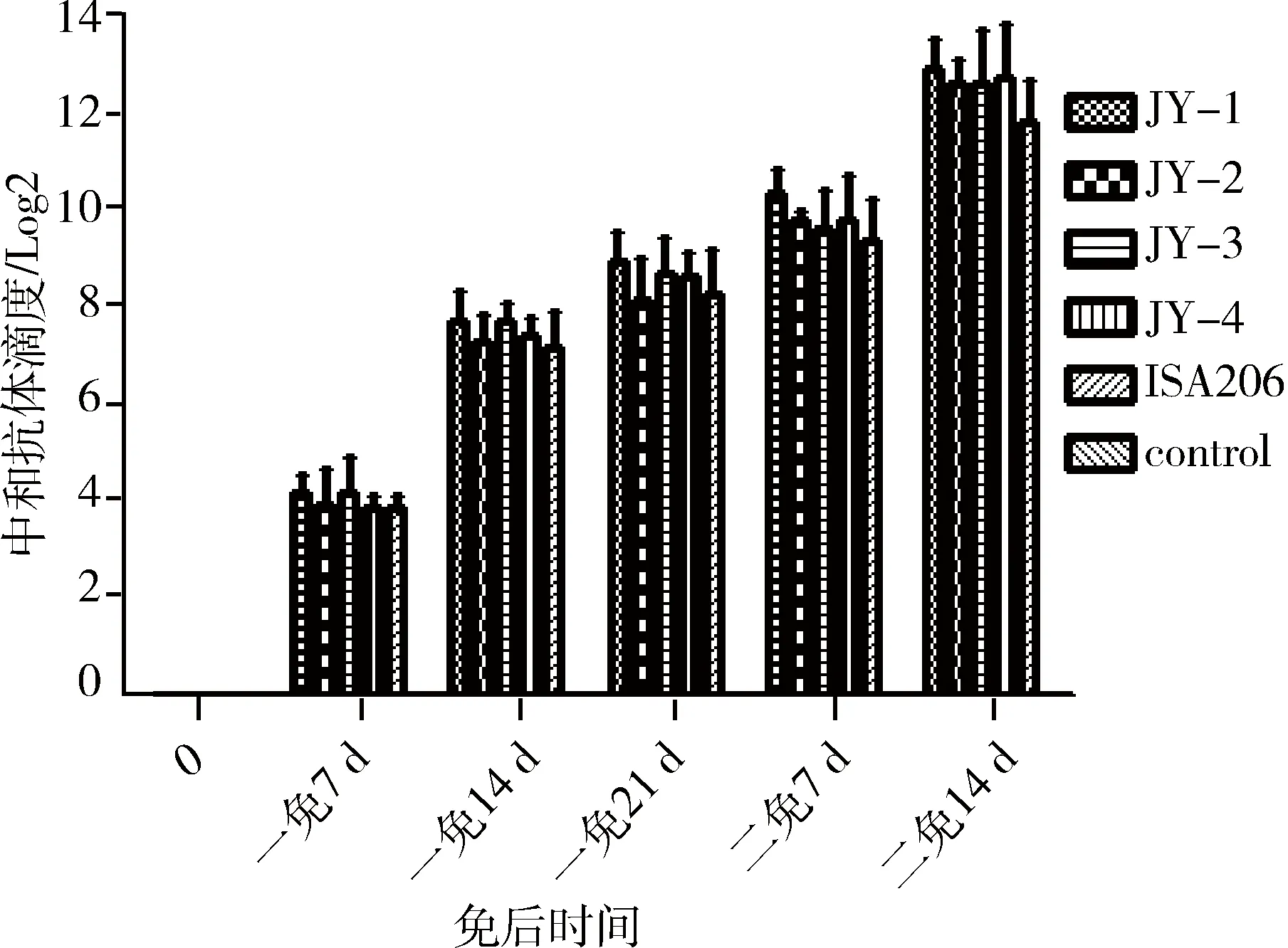
图3 5 批疫苗本动物效力试验抗体监测结果
2.3.2 攻毒结果 5 组疫苗连同阴性对照于二免后14 d攻毒,阴性对照组5头猪60%发病,对照组攻毒成立,免疫组各5头猪,保护率达80%以上,各免疫组均达到SVA攻毒保护要求,其中,JY-1组、JY-3组、JY-4组保护率达到100%,保护率高于进口佐剂组(表3)。

表3 5组疫苗攻毒结果
架子猪SVA免后中和抗体及攻毒保护试验结果表明,四组JY佐剂均能达到ISA206佐剂的水平,并能提升SVA灭活疫苗免疫效力及保护率。
3 讨 论
SVA 在猪群中流行已有十余年,目前,仍无疫苗或特定的治疗方法可用,猪场只能通过加强饲养管理和生物安全来防范,因此开发安全高效疫苗至关重要。
有学者[5]通过反向遗传技术拯救了一株重组 SVA弱毒株,并在猪体内评估了重组病毒的免疫原性及免疫保护性。中和抗体及攻毒试验结果显示,该重组病毒保留了较理想的免疫原性,说明该重组 SVA 是一株有效的活疫苗候选株。虽然活疫苗能够诱导理想的体液及细胞免疫反应,但具有潜在的生物安全风险,如毒力返强。而灭活苗不具有潜在的生物安全风险,因此也是另一种理想的候选疫苗[6]。灭活疫苗对佐剂的要求已从疫苗的一种辅助性物质转变为能提高动物机体对免疫原刺激的应答能力,但没有一种佐剂适用于所有抗原,每种佐剂都有其优点和缺点[7],所以从佐剂的原料合成、配伍、制备来选择和应用佐剂更能有针对性地开发需求性佐剂,提升疫苗免疫效力和保护率。
本研究按照兽用疫苗佐剂需求,优化表面活性剂的合成工艺,制备水包油包水佐剂,在同等配苗条件下,与进口佐剂对比疫苗乳化后各项理化指标、安全性及免疫效力、攻毒保护的情况。试验结果表明:自制的JY佐剂理化性状均符合SVA疫苗的要求;四组JY佐剂疫苗黏度均低于ISA206佐剂疫苗,降低了疫苗粘稠度,更易于注射,减少注射后应激反应程度,提高了疫苗的安全性;安全性检验及效力检验均符合且高于SVA疫苗要求,对小动物及本体动物均无任何免疫副反应。
本研究根据SVA疫苗安全性及效力提升的需求,定制合成表面活性剂,通过控制表面活性剂反应过程中的生成物,减少副产物的生成,降低了疫苗黏度及对机体的副作用。同时,自主合成佐剂根据抗原的情况调控佐剂原料配方或添加免疫增强剂,提升了疫苗免疫效力、免疫持续期及攻毒保护率。综合以上试验结果,表明JY-1、JY-2、JY-3、JY-4佐剂均可用于制备SVA灭活疫苗,对比而言,JY-1佐剂稳定性更好及个体差异低,用其制备的疫苗免疫仔猪后产生的抗体最高,在猪群中可能会产生长期的抗体水平,起到较理想的保护作用。

