Shh/Twist1对大鼠肺动脉内皮细胞间质转化及血管重构的作用机制*
刘蕾, 马德宾, 史亮, 孙文武
(中国人民解放军北部战区总医院 呼吸内科, 辽宁 沈阳 110016)
肺动脉高压(pulmonary arterial hypertension, PAH)是以肺动脉平均压渐进性升高为特征的慢性疾病,其病理特点为肺血管重构及血管阻力的持续升高,最终导致患者右心衰竭及死亡[1-2]。内皮间质转化(endothelial-to-mesenchymal transition, EndMT)引起的内皮细胞(endothelial cells, EC)损伤是PAH发生发展的关键因素[3]。抑制EndMT、恢复EC功能,可有效缓解PAH的发病进程。Shh(Sonic hedgehog)可调控内皮细胞生长,促进细胞迁移,进而诱导新生血管的生成[4]。研究发现,Shh在缺氧环境下的人肺动脉内皮细胞中表达上调[5],提示Shh可能参与低氧诱导的PAH发病进程;Twist参与细胞的迁移及血管生成,是促进EndMT的关键因子[6]。推测Shh、Twist1在调控内皮细胞功能方面发挥关键作用。然而,关于Shh/Twist1对肺动脉内皮细胞间质转化的影响鲜见报道。因此本研究旨在探讨Shh/Twist1对低氧诱导的PAH细胞模型内皮间质转化及血管重构的影响,以期为PAH的早期防治提供实验依据。
1 材料与方法
1.1 实验材料
1.1.1动物来源 4周龄SPF级雄性SD大鼠,体质量100~120 g,购自北京华阜康公司[许可证号SCXK(京)2020-0004],用于原代分离肺动脉内皮细胞。
1.1.2主要试剂及材料 肺动脉内皮细胞专用培养基(上海中乔新舟生物科技有限公司),胰酶(美国Sigma公司),Twist siRNA干扰片段及阴性对照(实验室前期构建保存),Cyclopamine(上海源叶生物科技有限公司),脂质体3000(美国sigma公司),丝裂霉素C(美国sigma公司),Matrigel胶(美国Cornig公司);全蛋白提取试剂盒、兔抗大鼠Shh一抗(A7726,1 ∶400)及BCA蛋白浓度测定试剂盒(武汉爱博泰克生物科技有限公司),兔抗大鼠Twist1一抗(WL00997,1 ∶500)、兔抗大鼠血管内皮生长因子(vascular endothelial growth factor,VEGF)一抗(WL00009b,1 ∶400)、兔抗大鼠基质金属蛋白酶2(matrix metalloproteinase,MMP2)一抗(WL03702,1 ∶1 000)及山羊抗兔IgG-HRP二抗(WLA023,1 ∶5 000)均购自沈阳万类生物科技有限公司。
1.2 研究方法
1.2.1大鼠原代肺动脉内皮细胞的分离[7]采用组织块贴壁法提取大鼠原代肺动脉内皮细胞,SD大鼠经戊巴比妥钠麻醉(200 mg/kg)后颈椎脱臼处死,无菌环境下取新鲜肺动脉组织。在含PBS的10 cm的培养皿中,反复清洗血管内的血液。将清洗干净的血管移入另一个培养皿中,PBS冲洗2次后,移入第3个培养皿。用眼科剪纵向剪开肺动脉,用无菌刀片将组织片切成1~2 mm2大小的动脉片,整个操作过程标本要浸泡于PBS中。最后将动脉片移入直径为35 mm的培养皿中,将其内膜面贴于培养皿,置于细胞培养箱中干涸2 h后,加入3 mL专用培养基于37 ℃、5 %CO2的培养箱内培养。72 h细胞达一定密度后将动脉片去除,换液1次,以后每2 d换液1次,每次按照新鲜培养基1 ∶1进行换液,继续培养7 d,细胞融合成单层。细胞密度达到90%,用胰蛋白酶消化,进行传代培养。
1.2.2造模及细胞分组 肺动脉内皮细胞接种至专用细胞培养基中,3%O2培养细胞3 d,建立PAH细胞模型[8-9]。胰酶消化计数后的大鼠肺动脉内皮细胞接种于培养板,分为正常对照组(37 ℃、5%CO2培养细胞3 d)、模型组(3%O2培养细胞3 d)、Shh抑制剂组(37 ℃、5%CO2条件下5 μmol/L Cyclopamine处理过夜后,细胞置于3%O2条件下培养3 d)、siRNA NC组(37 ℃、5%CO2条件下用siRNA NC转染过夜后,细胞置于3%O2条件下培养3 d)及Twist1 siNRA组(37 ℃、5%CO2条件下用Twist1 siNRA转染过夜后,3%O2条件下培养3 d)。
1.2.3划痕实验检测细胞的迁移能力 培养各组细胞至密度为融合状态。在实验前将培养基换为无血清培养基并加入1 mg/L的丝裂霉素C处理1 h。将各组细胞利用200 μL pipette tip造成细胞划痕,用无血清培养基清洗细胞表面1次,除去细胞碎片,换用无血清培养基培养。将各组细胞置于37 ℃、5 % CO2的培养箱中分别培养24 h后拍照。
1.2.4小管形成实验检测细胞成管能力 Matrigel胶4 ℃过夜解冻,冰上操作,吸取Matrigel胶至96孔培养板,每孔50 μL,置37 ℃培养箱中孵育2 h,使其凝固。收集各组缺氧诱导1 d的培养液,用于细胞培养。将细胞分别消化离心后进行细胞计数。分别取各组细胞悬液100 μL加入已铺胶的96孔细胞培养板,每孔细胞数为104个,倒置显微镜下观察拍照。
1.2.5实时荧光定量PCR(Real-time PCR)检测细胞中CD31、vWF、α-SMAmRNA的表达 收集各组细胞,Trizol法提取细胞总RNA,分光光度仪测定总RNA浓度,采用Real-time PCR检测各组细胞中CD31、vWF、α-SMAmRNA的相对表达量。CD31上游引物序列为5′-CTCCATCCTGTCGGGTAA-3′,下游引物序列为5′-TCATTCACGGTTTCTTCG-3′;vWF上游引物序列为5′-CTACGGCTTGCACTATTCA-3′,下游引物序列为5′-CCAGACACTTGCGTTCATC-3′;α-SMA上游引物序列为5′-GGGCATCCACGAAACCACCT-3′,下游引物序列为5′-GAGCCGCCGATCCAGACAGA-3′;内参照β-actin上游引物序列为5′-GGAGATTACTGCCCTGGCTCCTAGC-3′,下游引物序列为5′-GGCCGGACTCATCGTACTCCTGCTT-3′。反应条件为94 ℃预变性5 min,94 ℃变性15 s、60 ℃退火及延伸50 s,共40个循环。反应结束后进行溶解曲线分析。以β-actin为内参,采用2-ΔΔCt法计算基因的相对表达量。
1.2.6Western blot检测细胞中Shh、Twist1、VEGF、MMP2蛋白的表达 收集各组细胞,预冷PBS漂洗3次,加入适当体积的蛋白裂解液,抽提细胞总蛋白。BCA法测定蛋白浓度并定量,以SDS-PAGE凝胶电泳分离蛋白复合物,将转印好的PVDF膜用质量分数5%的脱脂奶粉室温封闭1 h。分别加入Shh(1 ∶400)、Twist1(1 ∶500)、VEGF(1 ∶400)、MMP2(1 ∶1 000)一抗,4 ℃孵育过夜;孵育一抗后的PVDF膜用TBST缓冲液洗膜4次,5 min/次;继续用HRP标记的山羊抗兔二抗(1 ∶5 000)37 ℃孵育45 min,TBST缓冲液洗膜6次,每次5 min。最后加入ECL化学发光液显色,用凝胶图处理系统(Gel-Pro-Analyzer)软件分析目标条带的光密度值。
1.3 统计学分析
2 结果
2.1 细胞迁移能力
划痕实验检测各组细胞的迁移能力,结果如图1和表1所示。与空白对照组比较,模型组细胞的迁移率升高(P<0.05);与模型组比较,Shh抑制剂组及siRNA-Twist1组细胞的迁移率降低,差异有统计学意义(P<0.05)。
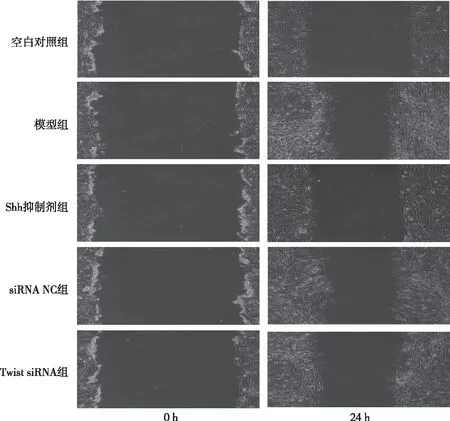
图1 各组细胞的迁移情况(100×)Fig.1 The migration ability of cells(100×)

表1 各组细胞的迁移率比较Tab.1 The migration rate of
2.2 成管能力
小管形成实验检测各组细胞的血管生成能力。如表2所示,与空白对照组比较,模型组细胞形成的管腔数明显增多,差异具有统计学意义(P<0.05);与模型组比较,经Shh抑制剂处理或干扰Twist1后,细胞形成的管腔数明显减少,差异有统计学意义(P<0.05)。

图2 各组细胞的成管情况(100×)Fig.2 The Tube formation of cells in each group(100×)

表2 各组细胞的管腔形成数目比较Tab.2 Number of luminal formation
2.3 CD31、vWF及α-SMA mRNA表达
与模型组比较,Shh抑制剂处理或干扰Twist1可上调CD31、vWFmRNA的表达,下调α-SMAmRNA的表达,差异均有统计学意义(P<0.05)。见表3。

表3 各组细胞CD31、vWF及α-SMA mRNA相对表达水平Tab.3 Expression of CD31,vWF, and α-SMA mRNA in each
2.4 Shh、Twist1、VEGF及MMP2蛋白表达
Western blot检测结果显示,与空白对照组相比,模型组Shh、Twist1、VEGF及MMP2蛋白的表达水平上调,差异均有统计学意义(P<0.05);与模型组比较,Shh抑制剂组和siRNA-Twist1组细胞中Shh、Twist1、VEGF及MMP2蛋白的表达水平下调,差异均有统计学意义(P<0.05)。见图3和表4。
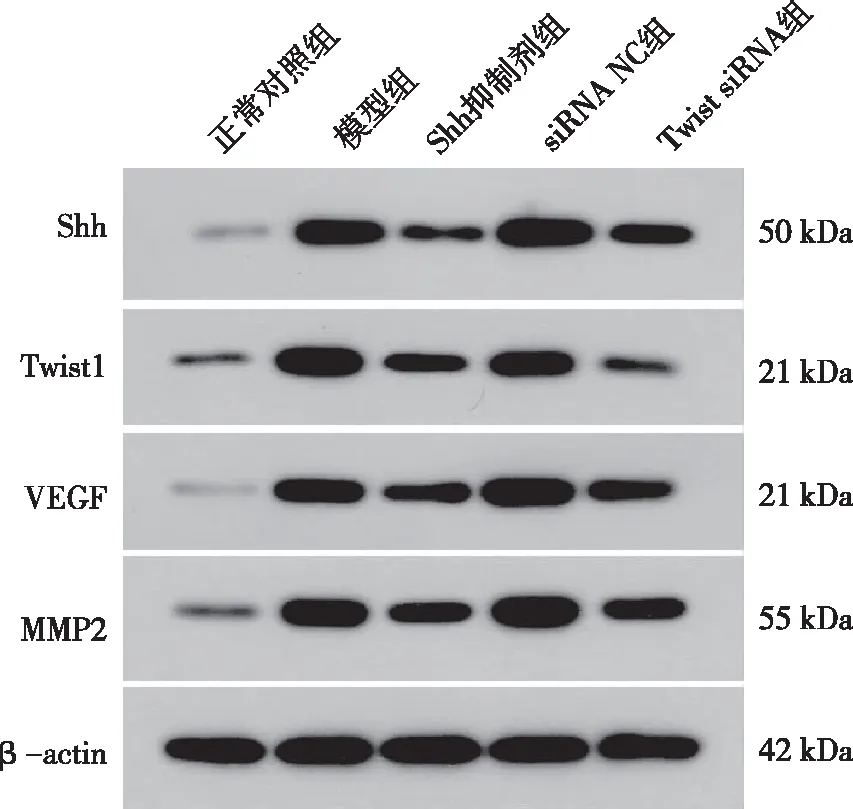
图3 各组细胞Shh、Twist1、VEGF及MMP2蛋白电泳结果Fig.3 Protein electrophoresis images of Shh, Twist1, VEGF, and MMP2 in each group

表4 各组细胞Shh、Twist1、VEGF及MMP2蛋白相对表达水平Tab.4 Expression of Shh、Twist1、VEGF、MMP2 proteins in each
3 讨论
PAH是一种破坏性极强的心肺疾病,发病率及死亡率均较高[10]。目前,PAH的发病机制尚未完全阐明,现认为炎症、低氧、氧化应激等因素均可能导致肺动脉内皮细胞受损,引起肺血管重构,进而导致肺动脉腔隙狭窄甚至完全堵塞[11]。
EndMT是PAH发生时肺动脉血管重构的主要因素,EndMT会加剧肺血管重构及PAH进程[12]。因此,抑制EndMT、恢复EC的正常功能可有效治疗PAH。
内皮细胞发生EndMT的主要特征变化为间质细胞标志物α-SMA表达增加,内皮细胞标志物CD31及vWF表达下调[3]。本研究结果显示,经缺氧诱导后,肺动脉内皮细胞中α-SMAmRNA的表达上调,CD31及vWFmRNA的表达降低,说明细胞发生EndMT,符合PAH的临床病理特征[13]。
Shh作为HH蛋白家族中重要一员,是调节细胞生长发育的重要信号通路。激活Shh可促进细胞迁移及上皮间质转化[14-15]。此外,Shh信号通路还可通过促进血管因子的释放,增强血管再生。在胃癌发病进程中,抑制Shh/Gli1通路可下调Twist1的表达,提示Shh对Twist1存在调控作用[16]。Twist1是诱导EndMT的常见转录因子,抑制E-cadherin的表达,促进EndMT的发生[17]。研究显示,缺氧处理的肺微血管内皮细胞中CD31的表达显著减少,α-SMA表达显著增加,其作用机制可能是Twist1的激活诱导了EndMT的发生[18]。本研究结果表明,抑制Shh/干扰Twist1表达均能上调CD31及vWFmRNA的水平,降低α-SMAmRNA的表达,具有抑制EndMT的作用。
VEGF是促进血管新生重要的细胞因子,可促进血管内皮细胞激活、迁移及血管形成[19-20]。MMP2是基质蛋白酶(MMPs)家族中一种明胶酶,参与血管生成过程[21]。本研究结果显示,缺氧诱导后,肺动脉内皮细胞中VEGF和MMP2蛋白表达水平显著上升,与赵海燕等[22]的研究结果一致。研究显示,Shh信号通路及Twist1可通过直接或间接上调VEGF及MMP2的表达[23-24],促进血管形成[21]。抑制Shh/Twist1蛋白的表达可降低血管再生及细胞转移[25-26]。本研究结果表明,当抑制Shh/干扰Twist1表达后,细胞中VEGF、MMP2蛋白表达下调,肺动脉内皮细胞的血管生成能力减弱,使缺氧诱导的PAH得到明显改善。
综上所述,降低Shh/Twist1的表达可有效抑制抑制肺动脉内皮细胞发生EndMT,改善肺动脉血管重塑。

