亚砷酸钠对小鼠肝细胞AML12氧化应激、凋亡及MST1、MST2蛋白表达的影响*
赵哲仪, 王正蓉, 方兴艳, 王甜, 罗昭逊, 谢婷婷*
(1.贵州医科大学附属医院 临床检验中心, 贵州 贵阳 550004; 2.贵州医科大学 医学检验学院, 贵州 贵阳 550004; 3.贵州医科大学附属医院 产前诊断中心, 贵州 贵阳 550004; 4.山东省立第三医院 检验科, 山东 济南 250031; 5.贵州医科大学 儿科学院, 贵州 贵阳 550004)
地方性砷中毒是严重危害人体健康的生物地球化学性疾病之一,目前已发现的地方性砷中毒病区遍布于全球70多个国家,至少有2亿人面临砷暴露的风险[1]。砷中毒是以多脏器多系统损害为特点的全身性疾病,肝脏亦是砷毒作用的主要靶器官之一[2]。研究发现,砷所致机体内氧化与抗氧化作用失衡、细胞凋亡信号通路异常是砷中毒的重要机制[3-4]。哺乳动物不育系20样激酶1(mammalian sterile 20-like kinases 1,MST1)和MST2是不育系20样激酶家族中具有进化保守性的、编码丝氨酸和苏氨酸蛋白激酶的同源基因[5]。以往动物及细胞水平的研究表明,MST1和MST2能通过调节多条信号通路促进氧化应激和凋亡,且磷酸化MST1/2(phosphorylated-MST1/2,p-MST1/2)能通过激活Hippo信号通路抑制一系列抗氧化及抗凋亡因子的表达[6-8]。尽管MST1和MST2与砷毒性作用相关的信号通路存在相互作用关系[9-10],但目前未有报道表明砷对肝细胞p-MST1/2、MST1及MST2表达水平的影响。因此,本研究用亚砷酸钠(sodium arsenite,NaAsO2)对正常肝细胞AML12进行染毒处理,探究砷对肝细胞氧化应激、凋亡以及MST1/2表达的影响,为砷所致肝损伤疾病的防治提供新的思路。
1 材料与方法
1.1 实验材料
1.1.1细胞来源 小鼠正常肝细胞AML12购自中国科学院细胞库。
1.1.2主要试剂和仪器 NaAsO2(美国Merck公司),2.5 g/L胰蛋白酶溶液、DMEM/F-12培养基及磷酸盐缓冲溶液(phosphate buffer saline,PBS;美国Gibco公司),胎牛血清(fetal bovine serum,FBS;美国Corning公司),青霉素、链霉素(美国Hyclone公司),细胞培养瓶、培养皿(无锡耐思生物科技有限公司),细胞冻存液、普通RIPA裂解液、5×蛋白上样缓冲液、蛋白marker和聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)凝胶制备试剂盒及超氧化物歧化酶(superoxide dismutase,SOD)活性检测试剂盒(北京索莱宝生物有限公司),化学发光试剂(electrochemiluminescence,ECL;美国Millipore公司),活性氧(reactive oxygen species,ROS)检测试剂盒(南京建成生物工程研究所),二辛可宁酸(bicinchoninicacid,BCA)蛋白浓度测定试剂盒(上海碧云天生物技术研究所),兔抗小鼠p-MST1/2单克隆抗体(美国CST公司),兔抗小鼠MST1、MST2、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)单克隆抗体及辣根过氧化物酶标记的山羊抗兔免疫球蛋白G二抗(英国Abcam公司),兔抗小鼠半胱氨酸蛋白酶3剪接体(cleaved caspase 3, c-caspase 3)单克隆抗体(沈阳万类生物科技有限公司)。
1.1.3主要仪器 倒置光学显微镜(日本OLympus公司),ELX800 酶标仪(美国Bio-Teck公司),倒置荧光显微镜(日本Nikon公司),小型垂直电泳槽(美国Bio-Rad公司)。
1.2 研究方法
1.2.1细胞培养、NaAsO2染毒处理及分组 小鼠正常肝细胞AML12用含10%FBS的DMEM /F-12培养基,于5%CO2、37 ℃恒温条件下培养;待细胞融合率达80%时,进行传代、冻存及后续实验。常规培养时,每隔2 d进行换液,传代比例为1 ∶2;待细胞融合率达80%时,弃原培养基,0、10、15、20、25及30 μmol/L NaAsO2的完全培养基溶液继续培养24 h,以不含NaAsO2为对照组,其余各浓度NaAsO2处理组为实验组。
1.2.2荧光探针染色法检测AML12细胞内ROS含量 取处于对数生长期的AML12细胞接种于6孔板中,实验组NaAsO2染毒处理后,弃各组细胞的原培养基,加含10 μmol/L活性氧荧光探针(DCFH-DA)的DMEM/F-12培养基1 mL继续于37 ℃孵育细胞1 h;弃含染料的培养基,PBS洗涤细胞2次,加适量PBS于倒置荧光显微镜下观察细胞内的荧光强度。
1.2.3化学比色法检测AML12细胞内SOD活性 取处于对数生长期的AML12细胞接种于6孔板中,实验组NaAsO2染毒处理后,消化收集各组细胞至离心管,按每500万细胞加蛋白提取液1 mL,行超声破碎裂解细胞后,4 ℃下8 000 r/min离心10 min,取部分上清测定蛋白浓度,再按说明书配制SOD活性检测反应体系行吸光度检测,计算每克样本质量中MDA的含量;每组样本设置3个复孔,并重复3次实验。
1.2.4Western blot法检测AML12细胞内p-MST1/2、MST1、MST2及c-caspase 3蛋白相对表达量 取处于对数生长期的AML12细胞接种于6孔板中,实验组NaAsO2染毒处理后,弃各孔中原培养基,按100 ∶1 ∶1的比例加入蛋白裂解液、蛋白酶抑制剂及蛋白磷酸酶抑制剂提取总蛋白;经BCA法测定蛋白浓度,再将蛋白样品与1/4倍体积的5×SDS-PAGE上样缓冲液充分混匀,置于100 ℃金属浴中加热8 min;各组蛋白均以40 μg上样量进行SDS-PAGE电泳分离,转移至PVDF膜上,5%BSA封闭2 h,TBST洗膜3次、10 min/次,分别加p-MST1/2抗体(1 ∶1 000)、MST1抗体(1 ∶10 000)、MST2抗体(1 ∶10 000)及c-caspase 3抗体(1 ∶1 000)和GAPDH抗体(1 ∶10 000)于4 ℃孵育过夜;TBST洗膜3次、10 min/次,加山羊抗兔IgG二抗(1 ∶10 000)于室温孵育2 h,TBST洗涤3次、10 min/次,ECL显影;采用Image J软件统计蛋白条带灰度值,以GAPDH为内参照计算各目的蛋白的相对表达水平。
1.3 统计学分析
采用SPSS 23.0软件进行数据统计学分析,所有计量资料均进行正态性检验、方差齐性检验;计量资料呈正态分布且方差齐时,组间比较采用单因素方差分析法,进一步两两比较采用最小显著性差异法(least significance difference t test,LSD-t);P<0.05为差异有统计学意义。
2 结果
2.1 ROS含量
倒置荧光显微镜结果表明,与对照组相比,随着NaAsO2浓度的增高,10~30 μmol/L NaAsO2各组小鼠AML12细胞内ROS的荧光强度逐渐增强,且差异均有统计学意义(P<0.05)。见图1。
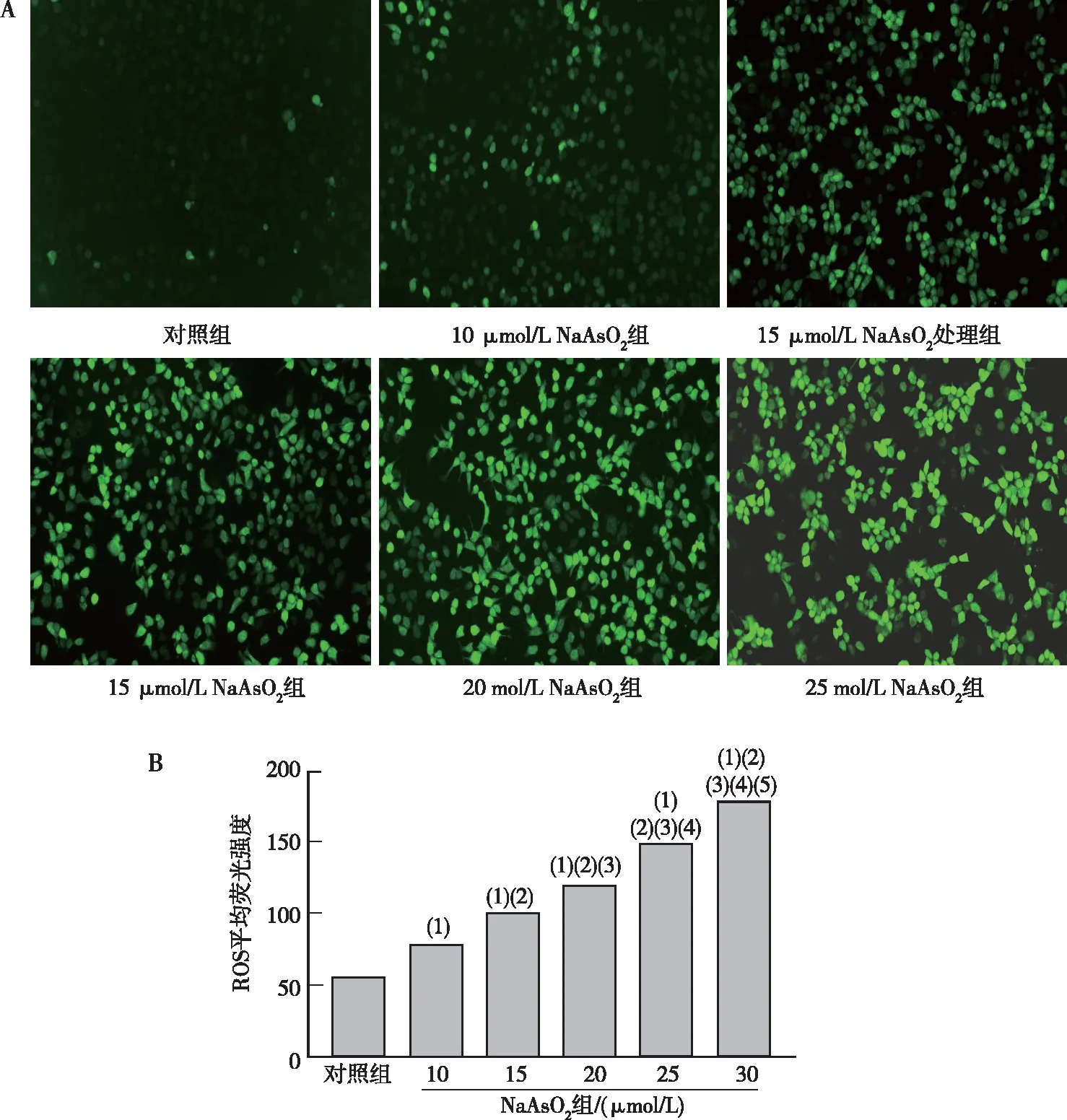
注:A为荧光探针染色法检测结果(200×),B为荧光强度的定量结果;(1)与对照组比较,P<0.05;(2)与10 μmol/L NaAsO2组比较,P<0.05;(3)与15 μmol/L NaAsO2组比较,P<0.05;(4)与20 μmol/L NaAsO2组比较,P<0.05;(5)与25 μmol/L NaAsO2组比较,P<0.05。图1 各组小鼠AML12细胞的ROS表达Fig.1 The contents of ROS in AML12 hepatocytes of mice in each group
2.2 SOD活性
化学比色法检测结果表明,与对照组相比,10~30 μmol/L NaAsO2各组小鼠AML12细胞内SOD活性降低,差异均有统计学意义(P<0.05)。见图2。
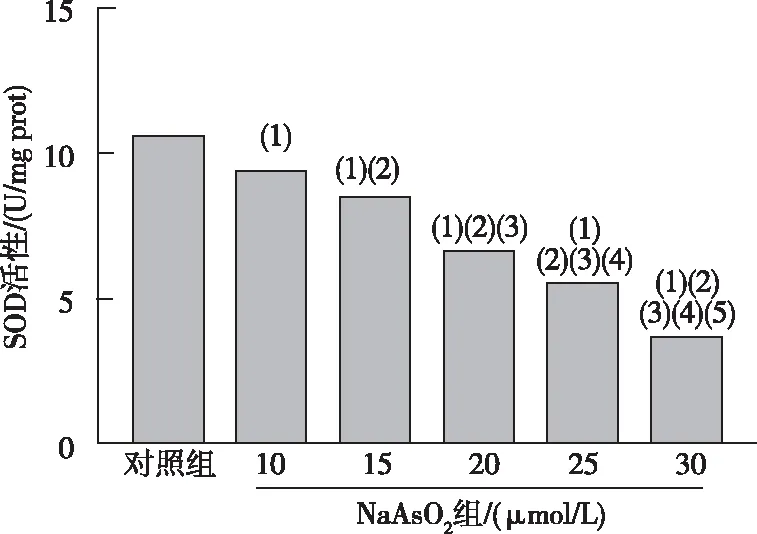
注:(1)与对照组比较,P<0.05;(2)与10 μmol/L NaAsO2组比较,P<0.05;(3)与15 μmol/L NaAsO2组比较,P<0.05;(4)与20 μmol/L NaAsO2组比较,P<0.05;(5)与25 μmol/L NaAsO2组比较,P<0.05。图2 各组小鼠AML12肝细胞的SOD活性Fig.2 The activity of SOD in AML12 hepatocytes of mice in each group
2.3 p-MST1/2、MST1、MST2和c-caspase 3蛋白表达
Western blot结果显示,与对照组相比,10~30 μmol/L NaAsO2组小鼠AML12细胞内p-MST1/2蛋白相对表达量增加(P<0.05),20~30 μmol/L NaAsO2组小鼠AML12细胞内MST1蛋白相对表达量降低、c-caspase 3蛋白相对表达量升高(P<0.05),15~30 μmol/L NaAsO2组小鼠AML12细胞内MST2蛋白相对表达量升高(P<0.05)。见图3。
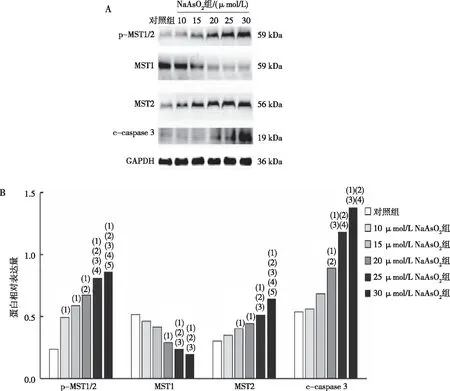
注:A为Western blot检测各蛋白结果;B为各蛋白表达的定量结果;(1)与对照组比较,P<0.05;(2)与10 μmol/L NaAsO2组比较,P<0.05;(3)与15 μmol/L NaAsO2组比较,P<0.05;(4)与20 μmol/L NaAsO2组比较,P<0.05;(5)与25 μmol/L NaAsO2组比较,P<0.05。图3 各组小鼠AML12细胞内p-MST1/2、MST1、MST2及c-caspase 3蛋白的表达(Western blot)Fig.3 The protein expression levels of p-MST1/2, MST1, MST2, and c-caspase 3 in AML12 hepatocytes of mice in each group(Western blot)
3 讨论
ROS是一类具有高化学反应活性的含氧物质,其主要来源于线粒体内的氧化呼吸链[11]。当机体发生氧化应激时,体内的抗氧化物质不足以清除氧化物质,使得ROS过度积累,最终导致组织细胞损伤[12]。SOD作为生物体内的一线抗氧化酶,在清除ROS、维持氧化与抗氧化平衡中具有重要作用,其水平高低可直接反应体内氧化应激状态[13]。而ROS作为连接氧化应激和凋亡的枢纽,可通过多种途径激活凋亡信号通路,进而促进caspase-3发生裂解而活化,最终导致细胞凋亡[14]。本研究通过体外构建砷暴露细胞模型发现:随着染砷剂量的增加,AML12细胞内ROS含量逐渐增加,SOD活性逐渐下降,c-caspase 3蛋白相对表达量逐渐增加,提示砷可以明显诱导AML12细胞发生氧化应激和凋亡。
MST1和MST2作为不育系20样激酶家族中受到广泛研究的成员,在细胞氧化应激、凋亡、增殖、分化等多种生物学过程中都发挥着重要作用[15-16]。研究表明,MST1/2属于Hippo信号通路中关键的信号传导激酶,可在氧化应激状态下发生自磷酸化而被激活,活化的MST1/2可通过激酶级联反应抑制一系列抗凋亡因子的表达[17-19]。此外,基因敲除实验表明,敲低MST1/2能降低p53的表达量及caspase-3的活性,从而抑制细胞凋亡[20-21]。本实验结果显示,在NaAsO2诱导AML12细胞发生氧化应激和凋亡过程中,p-MST1/2和MST2蛋白的相对表达量增加,MST1蛋白相对表达量逐渐降低,推测MST1/2可能通过其磷酸化形式以及提高caspase-3活性参与了砷致肝损伤过程,但其具体生物学机制有待深入研究。与本实验结果类似的,Shi等[22]和Wang等[23]分别在不同细胞发生凋亡的过程中发现,p-MST1或p-MST1/2的表达量显著上升而MST1的表达量显著下降。Lu 等[24]还发现在紫外线引起HaCat表皮细胞凋亡过程中,随着紫外线作用时间的延长,MST1蛋白表达量逐渐降低,而分子量为34 kDa的MST1蛋白片段逐渐增多。MST1在多种凋亡刺激作用下,可被caspase-3切割成分子量为34 kDa的高活性促凋亡片段,该片段通过进入细胞核内磷酸化组蛋白H2B,从而使得染色质固缩、DNA损伤,最终导致细胞凋亡[25-26]。因此,分析本研究中MST1降低的原因可能有:(1)MST1发挥促凋亡的作用可能主要依赖于其磷酸化形式,故在p-MST1/2升高而MST1降低时细胞仍然能发生凋亡;(2)伴随着caspase-3活性的增高,部分MST1经caspase-3切割活化,导致MST1蛋白呈逐渐降低趋势。
综上所述,NaAsO2可促进小鼠正常肝细胞AML12发生氧化应激和凋亡,在此过程中p-MST1/2、MST1及MST2蛋白表达水平出现异常。本研究仅初步验证了砷对p-MST1/2、MST1及MST2蛋白表达水平的影响,还需深入探讨MST1/2在砷致肝损伤过程中所调控的具体信号通路。

