氧化苦参碱对醛固酮诱导大鼠心肌纤维化的作用及机制*
徐旖旎, 陈婷婷, 杨非, 张彦燕, 潘迪, 罗红, 沈祥春, 付凌云**
(1.贵州医科大学 基础医学院, 贵州 贵阳 550025; 2.贵州医科大学 药学院 天然药物资源优效利用重点实验室 & 贵州省高等学校天然药物药理与成药性评价重点实验室, 贵州 贵阳 550025)
心血管疾病(cardiovascular diseases,CVDs)是威胁我国居民健康水平及生活质量的首要疾病,且全国乃至全球CVDs的发病率和死亡率仍处于上升阶段[1]。心肌纤维化(myocardial fibrosis,MF)是CVDs导致患者心肌顺应性和收缩功能下降而发生泵衰竭的必然过程,是心衰由代偿期向失代偿期转变的关键病理环节[2];与此同时,心肌成纤维细胞转分化(fibroblast-myofibroblast transition,FMT)在CVDs恶化过程中的地位和作用与心肌细胞病变同等重要[3]。因此研究MF的关键病变机制,尤其是FMT调控关键靶位,为研发疗效明确、副作用少、作用靶位明确、能直接抑制FMT发生、减轻或延缓纤维化的药物,对减少CVDs的发病率、降低死亡率及提高生存质量都具有十分重要的意义。研究表明,醛固酮(aldosterone,ALD)可独立作用于心血管系统,也可与血管紧张素联合对心脏结构和功能造成不良后果,是引起心脏损伤、重塑、纤维化及衰竭的重要因子[4],但ALD诱导心脏损伤机制至今不明。Notch-1是与细胞分化密切相关的信号分子,在心血管系统中发挥着重要的作用,研究表明黄芩素改善异丙肾上腺素诱导的大鼠MF过程中,伴随有Notch-1蛋白表达减少[5]。Notch-1信号异常活化对多脏器如肺、肝、肾、皮肤、心血管等的纤维化具有重要的调控作用[6-9],但其对ALD诱导FMT的作用及机制目前尚不清楚。苦参是豆科槐属植物苦参(SophoraflavescensAit.)的干燥根,有清热、燥湿及杀虫的功效[10],氧化苦参碱(oxymatrine,OMT)是苦参主要药效成分之一,有抗心律失常、保护血管内皮、保护缺血和梗死心肌等作用[11-13]。有研究显示,OMT对心肺复苏术后大鼠心肌重塑有抑制作用[14];可明显减轻异丙肾上腺素诱导实验大鼠心肌组织的重构和纤维化,对急性心肌梗死后MF有显著的逆转作用;可降低病毒性心肌炎小鼠心肌的炎症和损伤,对损伤后心肌细胞具有保护作用,对心肌成纤维细胞(cardiac fibroblasts,CFs)增殖也有显著的抑制作用[15-16]。本课题组前期研究表明,OMT对大鼠冠状动脉结扎诱发的急性心肌梗死、心肌重塑及MF具有显著的改善作用,其作用与逆转心肌细胞凋亡,抑制CFs增殖及分化等密切相关[17-18]。本研究以ALD联合高钠盐饮水诱导大鼠MF模型,通过观察OMT对大鼠心肌病理形态、心肌羟脯胺酸(hydroxyproline, HYP)含量、心肌FMT指标以及Notch-1信号蛋白的表达,分析OMT对ALD诱导大鼠MF的作用以及与Notch-1信号的关系,为临床MF的防治提供新的作用靶点,为传统中药防治MF提供理论依据和实验基础。
1 材料与方法
1.1 实验材料
1.1.1实验动物 健康雄性Sprague-Dawley(SD)大鼠40只,体质量180~220 g,Ⅱ级清洁级,由学校实验动物中心提供[SCXK(黔)2012-0001]。
1.1.2主要药物、试剂及仪器 Aldosterone(美国sigma),OMT(南京广润生物);甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH) Mouse McAb、基质金属蛋白酶抑制剂2(tissue inhibitor of metalloproteinase 2,TIMP2)Rabbit polyclonal antibody及Ⅰ型胶原(collagen typeⅠ, ColⅠ)Rabbit Polyclonal antibody(美国Proteintech Group),基质金属蛋白酶抑制剂1(tissue inhibitor of metalloproteinase 1,TIMP1)、基质金属蛋白酶9(matrix metalloproteinase 9,MMP9)及MMP2(英国abcam),Notch-1(DIE11)XP(R) RABBIT mAb(美国Cell Signaling technology);CFX型凝胶成像系统仪、PowerPac Basic及Mini-PROTEAN Tetra System(美国BIO-RAD),XDS-2B倒置显微镜(日本尼康),HF240 CO2培养箱(上海力申科学)。
1.2 研究方法
1.2.1造模和分组 大鼠按体质量随机分为对照组、模型组、25 mg/kg OMT(低剂量)组、50 mg/kg OMT(高剂量)组,10只/组;对照组大鼠给予等容积生理盐水皮下注射、自由饮水,其余各组大鼠采用80 μg/kg ALD皮下注射联合1%NaCl饮水复制MF模型;造模持续4周时,处死各组大鼠,切取左心室,待后续实验使用。
1.2.2天狼星红染色 取福尔马林固定的各组大鼠心肌组织,梯度乙醇脱水,二甲苯透明,石蜡包埋、固定,切片(厚度4~8 μm),展片,贴于载玻片上,烘干;切片脱蜡、水化,weigert铁苏木素染色15 min;1%盐酸酒精分化3 s,自来水冲洗10 min,ddH2O洗5 min,天狼星红染色1 h;自来水冲洗去除染液,梯度乙醇上行脱水、二甲苯透明、中性树胶封片;普通光学显微镜下观察,胶原纤维呈红色,胞核呈蓝色,肌纤维呈黄色,拍照分析。
1.2.3碱水解法分析心肌HYP含量 称取各组大鼠心肌组织100 mg,置于预先编号的试管中,加水解液1 mL,混匀,95 ℃水浴20 min,水解10 min时混匀1次;pH值调至6.0~6.8,各试管内加ddH2O至10 mL混匀,取稀释的水解液3~4 mL置于对应编号的新的试管内,加活性炭20~30 mg混匀,3 500 r/min离心10 min,取上清液1 mL做检测;同时设空白管、标准管;混匀,60 ℃水浴15 min,冷却,3 500 r/min离心10 min,取上清于波长550 nm,ddH2O调零,测定各管光密度(optical density,OD)值并计算。
1.2.4Western blot法分析FMT指标及Notch-1信号指标 液氮中取每只大鼠组织样本100 mg,置于预冷研钵中加液氮研磨至白色干粉,将组织干粉转入提取液中,混匀后瞬时离心,低温震荡至无明显沉淀,11 441 r/min离心20 min;常规提取蛋白、定量、制胶、电泳、转膜、封闭及杂交(一抗稀释浓度GAPDH 1 ∶7 500、ColⅠ 1 ∶1 000、 MMP9 1 ∶10 000、MMP2 1 ∶1 000、TIMP2 1 ∶1 000、TIMP1 1 ∶750、Jagged-1 1 ∶1 000、Notch-1 1 ∶1 000、DLL-4 1 ∶1 000及Hes-1 1 ∶1 000),置于CFX型凝胶成像系统仪暗室曝光,用Image Lab图像分析软件对选择的目标条带进行光密度值分析。
1.3 统计学分析
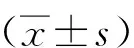
2 结果
2.1 心肌组织学
普通光学显微镜下观察,天狼星红染色后,心肌胶原呈红色,其余组织呈淡黄色;与对照组相比,模型组大鼠可见大量红色胶原;与模型组相比,OMT低、高剂量组组大鼠心肌红色胶原不同程度减少。见图1。

图1 各组大鼠心肌组织的天狼星红染色结果(200×)Fig.1 Sirius red staining results of rats cardiac histomorphology in each group (200×)
2.2 心肌HYP含量
ALD皮下注射联合高钠盐饮水造模4周后,与对照组相比,模型组大鼠心肌HYP含量升高(P<0.05);与模型组相比,OMT低剂量组大鼠心肌HYP含量降低(P<0.05)。见图2。
注:(1) 与对照组比较,P<0.05;(2) 与模型组比较,P<0.05。图2 各组大鼠心肌HYP含量 Fig.2 Hydroxyproline content of rats myocardial tissue in each group
2.3 心肌FMT指标
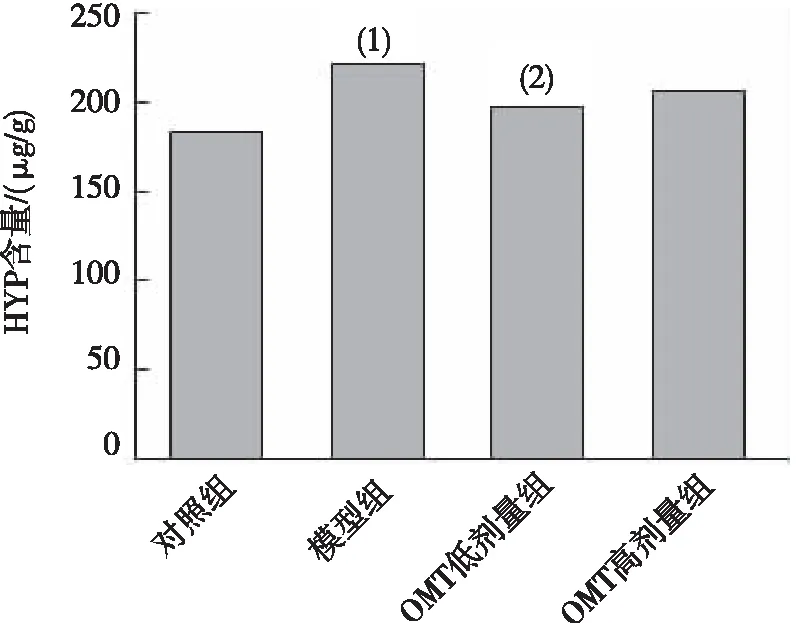
ALD皮下注射联合高钠盐饮水造模4 周时,与对照组相比,模型组大鼠心肌ColⅠ、 MMP9、MMP2、TIMP2及TIMP1升高(P<0.05);与模型组相比,OMT低剂量组大鼠心肌上述FMT指标均有降低(P<0.05),OMT高剂量组大鼠心肌MMP2、TIMP2和TIMP1蛋白表达降低(P<0.05)。见图3。
注:A为蛋白条带,B~F分别为 ColⅠ、MMP9、MMP2、TIMP1及TIMP2的定量表达结果;(1) 与对照组比较,P<0.05;(2) 与模型组比较,P<0.05。图3 各组大鼠心肌FMT指标的表达Fig.3 Expression of FMT indexes in myocardium of rats in each group
2.4 心脏Notch-1信号蛋白的表达
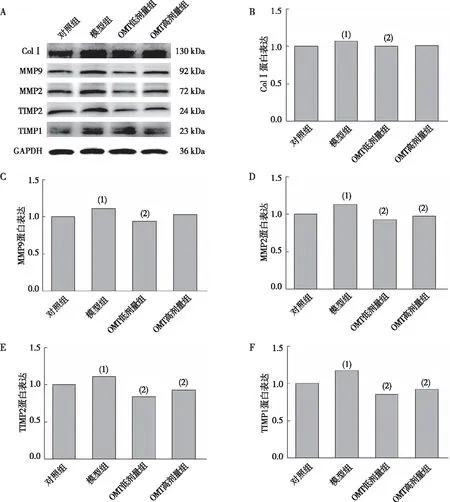
ALD皮下注射联合高钠盐饮水造模4周时,与对照组相比,模型组大鼠心肌Jagged-1、Notch-1、DLL-4及Hes-1蛋白表达升高(P<0.05);与模型组相比,OMT低剂量组大鼠心肌Jagged-1、Notch-1及DLL-4蛋白表达均降低(P<0.05)。见图4。
注:A为蛋白条带,B~E分别为Jagged-1、Notch-1、DLL-4及Hes-1蛋白的定量表达;(1) 与对照组比较,P<0.05;(2) 与模型组比较,P<0.05。图4 各组大鼠心脏Notch-1信号蛋白的表达Fig.4 Expression of Notch-1 signal proteins in myocardium of rats in each group
3 讨论
ALD联合高钠盐饮水造模后,显微镜下观察结果显示,模型组大鼠心肌纤维排列紊乱,大量胶原纤维沉积,纤维组织明显增生,肌纤维溶解坏死、残留心肌数目少且排列紊乱,提示ALD联合高钠盐饮水造模,大鼠心脏出现肥厚和纤维化的病理表现;与对照组相比,OMT低、高剂量组大鼠亦出现不同程度的病理改变,但与模型组相比,OMT组病理改变较轻,提示OMT可改善ALD联合高钠盐饮水造成的大鼠心肌肥厚和纤维化。
在各种致病因素作用下,心肌正常组织结构中胶原纤维过量积聚,胶原浓度显著升高或胶原成分发生改变,最终发生MF[19]。HYP是胶原蛋白的特征性氨基酸,HYP含量的变化可以反映胶原含量的变化,因此,检测心肌中HYP含量可以反映MF的程度[20]。本研究结果显示,与对照组比较,ALD联合高钠盐饮水造模,模型组大鼠心肌组织HYP含量升高(P<0.05),提示模型组大鼠心肌胶原沉积增多,发生了MF;与模型组相比,OMT组大鼠心肌HYP含量不同程度降低,胶原沉积减少,提示OMT能够缓解ALD联合高盐饮水引起的MF。
正常情况下,心肌中细胞外基质(extracellular matrix, ECM)的合成和降解保持着动态平衡状态[21]。其中,基质金属蛋白酶(matrix metalloproteinases,MMPs)和基质金属蛋白酶抑制剂(tissue inhibitor of metalloproteinases,TMIPs)是维系这种平衡状态的重要物质基础,MMPs负责降解ECM,以MMP2和MMP9的研究居多,可以降解ColⅠ、弹性蛋白酶等,在心肌组织重塑方面有重要作用[22];TIMPs具有抑制MMPs的功能[23]。病理状态下,ECM的动态平衡被打破,ECM沉积,其中Col Ⅰ是沉积于纤维化病灶部位ECM的核心成分,Col Ⅰ的聚集是纤维化进程的特征[24-25]。因此,研究心肌病变后的ColⅠ、MMPs及TIMPs的表达可以反映MF的程度。本研究结果显示,模型组大鼠心肌ColⅠ、MMP9、MMP2、TIMP2及TIMP1均较对照组升高,OMT组大鼠心肌上述蛋白表达较模型组降低,提示ALD联合高钠盐饮水造模大鼠心脏发生纤维化,OMT可以通过逆转ColⅠ、MMP9、MMP2、TIMP2及TIMP1蛋白的表达上调从而逆转ALD联合高钠盐饮水引起的MF及FMT。
Notch信号通路在组织器官的发生、发育过程中具有重要作用[26],近年来有关Notch与疾病的关系越来越受到人们的重视。Notch信号的研究主要集中在其受体(Notch-1)、配体(Jagged,DLL)和下游靶基因(Hes-1)上[27]。一般认为,Notch信号的活化要经过3步蛋白水解,首先是Notch受体的前体在高尔基体经过Furin蛋白酶剪切、变成有活性的Notch受体,之后转运至细胞膜与配体(Jagged、DLL)结合后经第二步酶切,即金属蛋白酶家族参与完成的胞外域的水解,最后经γ分泌酶水解胞内域,酶切后的胞内域进入胞核,与核内效应蛋白结合,启动下游靶基因(Hes-1)的转录,影响细胞增殖、分化和凋亡[28]。本研究通过整体动物模型验证ALD诱导的MF大鼠模型心肌中Notch-1信号的变化,结果显示,ALD皮下注射联合高钠盐饮水造模后,模型组大鼠心肌组织中Notch-1、Jagged-1、DLL-4及Hes-1均高于对照组,提示ALD诱导MF模型中Notch-1信号表达上调;OMT低剂量组大鼠心肌组织Jagged-1、Notch-1及DLL-4蛋白表达较模型组降低,提示OMT改善ALD诱导的大鼠MF可能与降低Notch-1信号的蛋白表达存在相关性。
综上所述,OMT能够逆转ALD诱导的大鼠MF,其机制可能与下调Nothc-1信号相关蛋白表达有关。

