头花蓼对幽门螺杆菌刺激骨髓来源巨噬细胞炎症反应的作用及机制*
袁蕴馨, 简单, 张姝,, 何芸, 孙朝琴,, 黄健, 莫非,**
(1.贵州医科大学 医学检验学院, 贵州 贵阳 550004; 2.贵州医科大学附属医院 临床检验中心, 贵州 贵阳 550004)
幽门螺杆菌(Helicobacterpylori,H.pylori)是一种定植于人胃黏膜的革兰阴性螺旋杆菌。据报道,世界范围内H.pylori感染率高达50%,且呈逐年上升的趋势[1]。H.pylori在人体内通常难以清除,H.pylori长期感染是引起慢性胃炎、消化性溃疡及胃腺癌等胃肠道疾病的原因之一[2],1994年H.pylori被世界卫生组织列为一级致癌物[3-4]。NOD样受体蛋白3(NOD-like receptor protein3,NLRP3)炎症小体是一种细胞内蛋白复合体,主要在固有免疫细胞中表达,如单核细胞和巨噬细胞[5]。NLRP3炎性小体作为固有免疫的重要组分,在机体免疫反应中发挥着关键作用[6]。核因子κB(nuclear factor kappa-B,NF-κB)严格监管NLRP3在转录水平上的表达,激活NF-κB信号通路,能够使在未激活的巨噬细胞中低表达的NLRP3的表达增加;另外,活化的NLRP3可激活天冬氨酸蛋白水解酶 1(caspase-1),活化的caspase-1继而促进无活性的炎症因子白细胞介素-1β(interleukin-1beta,IL-1β)前体和IL-18前体的加工,形成成熟的IL-1β和IL-18释放入体内,促进炎症反应、应激反应等生物学效应的发生[7-8]。在由细胞因子介导的H.pylori感染相关的炎症反应的研究中发现,IL-1β和IL-18在H.pylori感染的胃黏膜中的分泌明显增加[9-10]。此外,NLRP3不仅能被机体内产生的内源性物质或某种细胞状态的变化所激活,也可以捕捉病毒、细菌等病原微生物入侵的“危险信号”[11-12]。研究表明,H.pylori空泡毒素VacA可促进胃上皮细胞NLRP3炎性小体的激活,H.pylori的感染与NLRP3炎症小体的活化密切相关[13]。因此,NLRP3炎症小体可能成为H.pylori相关性胃炎提供新的治疗靶点。头花蓼(Polygonumcapitatum, PC)是一种具有贵州地方特色的民族药,因其具有抗菌、抗炎、清热及利湿等功效被广泛使用[14-15]。本课题组前期研究表明,PC可显著降低H.pylori在胃黏膜的定植率,同时可缓解H.pylori引起的小鼠胃黏膜炎症反应,减轻其导致的胃炎等疾病[16],但PC是否能够通过影响NF-κB/NLRP3/IL-1β信号通路发挥作用尚未见研究报道。鉴于H.pylori感染引起的是全身性炎症反应,本研究以骨髓来源巨噬细胞(bone marrow-derived macrophages,BMDMs)为研究对象,观察PC对H.pylori刺激后的BMDMs细胞模型中NF-κB/NLRP3/IL-1β信号通路的影响,以期发现新的PC作用靶点,为其临床应用提供依据和参考。
1 材料与方法
1.1 实验材料
1.1.1细胞株及菌株 BMDMs购自青旗(上海)生物技术发展有限公司,H.pyloriSS2000由中国疾病控制中心传染病所张建中研究员惠赠。
1.1.2主要药物、试剂及仪器 PC浸膏粉(贵州威门药业);酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒(欣博盛生物),抗鼠IL-1β抗体(美国 Cell Signaling Technology),抗兔NF-κB /p65 抗体和抗兔NLRP3抗体(英国 Abcam);三气培养箱(美国Thermo Fisher Scientific),Western blot电泳及转膜系统和酶标仪(英国Bio-Rad),低温离心机(美国Beckman),紫外分光光度计(日本SHIMADZU)。
1.2 实验方法
1.2.1H.pylori复苏、培养及鉴定 从-80 ℃冰箱中取出含H.pyloriSS2000菌株的冻存管,室温下溶解,用移液器将含菌冻存液转移至哥伦比亚血琼脂平板内,平板放入37 ℃的5%O2、10%CO2、85%N2及95%相对湿度的三气恒温培养箱中培养48 h待用;观察H.pylori生长状况,稳定传代3次后进行革兰染色、触酶试验、快速尿素酶试验和氧化酶试验,以鉴定H.pylori。
1.2.2细菌-细胞共培养模型的建立及分组 收集处于指数生长期的BMDMs,于培养皿中加无血清高糖(dulbecco's modified eagle medium,DMEM)培养基,饥饿培养4 h;收集H.pylori,使用含10%胎牛血清无双抗高糖DMEM培养基将其配制成均匀菌液,紫外分光光度计测定菌液D600值,计算菌液浓度并将菌液稀释至3.0×105CFU/L。用四甲基偶氮唑盐比色法(thiazolyl blue tetrazolium bromide,MTT)试剂盒,检测H.pylori对BMDMs细胞的影响。按照不同感染复数(multiplicity of infection,MOI;细菌数 ∶细胞数)分为空白、25 ∶1、50 ∶1、100 ∶1、200 ∶1、400 ∶1,96孔板中培养各组细胞12 h,加0.005 g/L MTT 20 μL,培养4 h,吸出培养液,加二甲基亚砜(dimethylsulfoxide,DMSO)150 μL,室温震荡溶解结晶,使用酶标仪检测D450值。
1.2.3细胞上清液中IL-18和IL-1β的表达 以MOI分别为空白、25 ∶1、50 ∶1及100 ∶1的比例置于三气培养箱中培养12 h,加H.pylori菌液刺激,培养3、6、12及24 h,倒置显微镜下观察H.pylori感染的BMDMs的细胞形态,收集各时间的培养上清液及细胞, ELISA检测细胞上清液中IL-18和IL-1β的表达水平,根据ELISA试剂说明书,并严格按照实验操作步骤进行操作,向各孔中加反应终止液100 μL,混匀并立即测量D450值,绘制标准曲线,计算各孔中IL-18和IL-1β的含量。
1.2.4PC治疗模型的建立及分组 将BMDMs分为空白组、模型组及PC治疗组,模型组和PC治疗组中加H.pylori,以MOI为100 ∶1刺激12 h;PC治疗组BMDMs中药物终质量浓度根据本课题组前期研究结果确定,以0.08 μg/L PC处理48 h[17];空白组和模型组BMDMs给予等量DMEM培养基培养48 h。
1.2.5NF-κB单体p65(NF-κB/p65)、NLRP3、IL-1β前体(IL-1β precursor,Pro-IL-1β)及IL-1β蛋白的表达 收集空白组、模型组及PC治疗组BMDMs,使用PBS洗涤3次,加含1%苯甲基磺酰氟(phenylmethylsulfonyl fluoride,PMSF)的蛋白裂解液(RIPA lysis buffer, RIPA),冰上裂解30 min,12 000 r/min于4 ℃离心10 min,取上清液,采用蛋白定量(bicinchoninic acid assay,BCA)法对其进行蛋白定量;根据胞浆、胞核蛋白提取试剂说明书,对空白组、模型组及PC治疗BMDMs的细胞核和细胞质的蛋白进行提取,使用BCA法定量;总蛋白以β-actin为内参蛋白,核蛋白以LaminB为内参蛋白;向蛋白样品加SDS loading buffer,100 ℃煮沸10 min,行聚丙烯酰胺凝胶电泳(polyacrylamide gelelectrophoresis,SDS-PAGE);200 mA恒流冰浴电泳转膜1.5 h,打开转移夹,肉眼可见清晰的Marker转移至聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)上;使用杂交膜清洗液(TBS with tween-20,TBST)漂洗后放于封闭液中,室温震荡封闭2 h;加相应抗体孵育;凝胶成像仪中曝光采集图像。
1.3 统计学分析
2 结果
2.1 细胞增殖
MTT比色法结果显示,当MOI高于100 ∶1时,细胞抑制率增高,BMDMs的数量减少(P<0.05)。见图1。

图1 H.pylori对BMDMs细胞增殖的影响Fig.1 Effect of H.pylori on BMDMs cell proliferation
2.2 H.pylori感染的细胞形态
倒置显微镜下观察BMDMs形态,结果表明,空白组细胞丰满呈梭形、表面光滑、颗粒物质少,模型组BMDMs多数变圆、表面不光滑、颗粒物质明显增多。见图2。
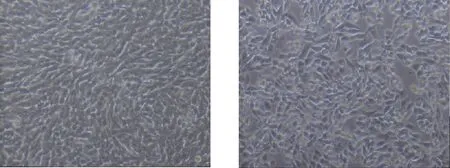
空白组 模型组图2 H.pylori感染的BMDMs细胞形态(未染色镜检,×100)Fig.2 Cellular morphology of H. pylori infected-BMDMs(unstained samples under microscopic examination,×100)
2.3 IL-1β和IL-18的表达
ELISA结果显示,经H.pylori刺激后,BMDMs中IL-1β 和IL-18的表达水平增高,与H.pylori呈明显的浓度依赖性;当MOI为100 ∶1且作用于DMEMs 12 h时,IL-1β 和IL-18的表达水平达到峰值,且高于空白组(P<0.05)。见图3。
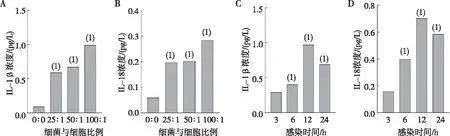
注:A、B为不同细菌与细胞比例下IL-1β、IL-18浓度;C、D为不同感染时间下IL-1β、IL-18浓度;(1)与细菌与细胞比例0组或感染时间3 h组比较,P<0.05。图3 H.pylori感染BMDMs的共培养模型中 IL-1β和IL-18的表达Fig.3 The expression levels of IL-1β and IL-18 in BMDMs cocultured with H. pylori
2.4 NF-κB/p65的表达
与空白组相比,模型组BMDMs细胞质内NF-κB/p65蛋白表达减少、细胞核内NF-κB/p65蛋白表达升高,差异均有统计学意义(P<0.05);与模型组相比,PC治疗组BMDMs细胞质内NF-κB/p65蛋白表达升高、细胞核内NF-κB/p65蛋白表达减少,差异均有统计学意义(P<0.05)。见图4。

注:A为Western blot检测NF-κB/p65表达,B、C为NF-κB/p65的蛋白定量结果;(1)与空白组比较,P<0.05;(2)与模型组比较,P<0.05。图4 各组BMDMs细胞质和细胞核中NF-κB/p65蛋白表达Fig.4 NF-κB/p65 expression levels in the cytoplasm and nuclei of BMDMs in each group
2.5 NLRP3、IL-1β及Pro-IL-1β蛋白的表达
研究结果显示,与空白组相比,模型组BMDMs中NLRP3、IL-1β蛋白表达升高,差异有统计学意义(P<0.05);与模型组相比,PC治疗组BMDMs中NLRP3、IL-1β蛋白表达减少,差异均有统计学意义(P<0.05);各组BMDMs中 Pro-IL-1β蛋白表达比较,差异均无统计学意义(P>0.05)。见图5。

注:A为IL-1β、Pro-IL-1β、NLRP3的Western blot检测结果;B、C、D为IL-1β、Pro-IL-1β、NLRP3蛋白的定量结果;(1)与空白组相比,P<0.05;(2)与模型组相比,P<0.05。图5 各组BMDMs中 NLRP3、IL-1β及Pro-IL-1β 蛋白的表达Fig.5 Proteins expression levels of NLRP3, IL-1β, and Pro-IL-1β in BMDMs in each group
3 讨论
H.pylori是一种革兰氏阴性螺旋状杆菌,通常定植于人体的胃黏膜和十二指肠黏膜,是胃炎的主要致病因子,其引起的炎症反应可进一步发展为胃黏膜肠化生,甚至癌变[18-19]。H.pylori在全球范围内广泛传播,我国H.pylori总感染率达56.22%[20]。在西医上,H.pylori的治疗主要采用质子泵抑制剂(铋剂)联合两抗生素的三联或四联疗法,但由于抗生素的广泛使用,使得H.pylori对抗生素的耐药性增强,根除率逐年下降[21]。因此,寻求新的治疗H.pylori感染的方法成为亟待解决的问题。
PC作为“十大苗药产业链”之一,具有清热解毒、活血化瘀等多重疗效,临床上可用于治疗泌尿系统疾病[22]。有研究表明,PC的水提物显示出良好的抗菌、抗炎效果,具有进一步开发应用的前景[17];本课题组前期研究也表明,PC能够抑制H.pylori生长,调节细胞周期,可对H.pylori胃炎小鼠进行免疫调节,并抑制其胃肠激素的紊乱,改善内环境[23]。
本研究结果显示,当MOI为100 ∶1时,且作用于DMEMs 12 h时,IL-1β和IL-18的产生达到最大值;当MOI高于100 ∶1时,H.pylori可抑制BMDMs的增殖,这表明当H.pylori达到一定浓度时,其会对BMDMs细胞产生一定的细胞毒性,影响其正常生长。倒置显微镜下观察细胞形态发现,空白组BMDMs细胞丰满呈梭形、表面光滑、颗粒物质少,H.pylori感染后大多数细胞变圆、表面不光滑、颗粒物质明显增多,提示H.pylori感染可引起BMDMs细胞的形态发生改变,这可能是H.pylori突破BMDMs细胞的细胞屏障,在细胞内生长繁殖,产生毒素和其他代谢产物进而损伤BMDMs细胞造成的。
NLRP3是一种细胞内蛋白复合物,与多种慢性炎症相关。有研究表明,H.pylori能够活化NLRP3炎症小体,并进一步诱导中性粒细胞分泌成熟的IL-1β[24]。作为炎症反应的关键因子,NLRP3在H.pylori引起的慢性炎症中扮演着重要的角色。Li等[25]研究显示,H.pylori可通过活性氧(reactive oxygen species,ROS)信号通路激活NLRP3炎症小体,诱导人单核细胞系产生IL-1β和IL-18;另外有研究表明,中药可通过抑制NLRP3等炎症因子的活化控制病情[26];Choi等[27]研究表明,查尔酮衍生物可通过抑制白细胞介素-1受体激活的激酶4 (interleukin-1 receptor-activated kinase 4 ,IRAK4)/核因子抑制蛋白-α(inhibitor of NF-κB-α,IκBα)/NF-κB信号通路阻断H.pylori引起的NLRP3炎症小体的激活,抑制IL-1β、IL-18及caspase-1的产生,从而减轻炎症反应;Lian等[28]研究结果显示,广藿香醇能抑制H.pylori引起的单核细胞趋化蛋白-1(monocyte chemoattractant protein-1,MCP-1)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)及白细胞介素-6(interleukin-6,IL-6)等促炎因子的分泌,且经广藿香醇作用后,NLRP3的表达水平较模型组明显降低,因此其机制可能与抗氧化活性、抑制促炎因子的分泌和调节NLRP3炎症小体功能有关。
在本研究中,经PC作用后,与模型组相比,PC治疗组BMDMs细胞浆内NF-κB/p65蛋白表达升高,细胞核内NF-κB/p65蛋白表达减少,表明PC可抑制由H.pylori引起的NF-κB/p65核内转移,且可抑制炎症反应中NLRP3、IL-1β及IL-18的表达上调,因此有理由认为PC可通过调节NF-κB/NLRP3/IL-1β信号通路在H.pylori胃炎中发挥治疗作用。

