长链非编码RNA C17orf91在肝细胞癌中低表达的临床意义
庞玉艳 李建棣 罗嘉嫄 莫伟嘉
肝癌是全世界癌症相关死亡的第三大原因,肝细胞癌约占肝癌的75%~85%[1]。肝细胞癌发病机制迄今未明,其危险因素主要有肝炎病毒、黄曲霉毒素、非酒精性脂肪肝等[2-5]。肝癌治疗策略包括药物治疗及非药物治疗[6-7]。由于肝细胞癌起病隐匿,许多患者错失最佳治疗时机[8-9]。因此,迫切需要深入研究肝细胞癌发病机制,为晚期肝癌患者提供高效治疗靶点,改善预后。
长链非编码RNA异常表达是癌症中常见的分子事件[10-11]。由于长链非编码RNA表达的广泛性及组织特异性,它极有可能成为癌症生物标志物[12-13]。长链非编码RNA C17orf91为hsa-miR-22-3p、hsa-miR-22-5p前体,可参与抑制肝细胞癌增殖、侵袭等恶性生物学行为[14-15]。C17orf91通过miR-10a-5p/NCOR2轴抑制肝细胞癌生长,且C17orf91下调预示肝细胞癌患者不良预后[16]。C17orf91衍生的hsa-miR-22-3p可靶向调控高迁移率族蛋白1,灭活其下游通路;C17orf91还可竞争结合RNA结合蛋白HuR,使β-连环蛋白(βcatenin)编码基因表达减弱[17]。C17orf91衍生的hsamiR-22-5p可抑制组蛋白去乙酰化酶2(histone deacetylase 2,HDAC2)活性,增加组蛋白乙酰化水平,增强肝细胞癌放射敏感性[18]。上述研究揭示C17orf91在肝细胞癌中的抑癌角色,C17orf91及其衍生miRNA有望成为肝细胞癌治疗靶点。然而,C17orf91在肝细胞癌中的分子机制尚不明确。因此,本研究旨在评估长链非编码RNA C17orf91在肝细胞癌中的表达水平及其临床意义,进而探讨C17orf91及其衍生miRNA的靶向机制,最终为肝细胞癌患者预测治疗靶点。
1 材料和方法
1.1 肝细胞癌mRNA表达谱 本研究所纳入的全球肝细胞癌mRNA与miRNA表达谱均下载自高通量基因表达(Gene Expression Omnibus,GEO)、ArrayExpress、癌症基因组图谱(The Cancer Genome Atlas,TCGA)和基因组织表达(Genotype-Tissue Expression,GTEx)数据库。纳入标准:(1)物种为人类;(2)明确病理诊断为肝细胞癌;(3)对照为健康肝脏组织;(4)表达数据及临床信息完整。排除标准:(1)样本中混有肝胆管细胞癌;(2)患者手术前经过放射或者药物治疗。分别合并同一平台的mRNA及miRNA数据集,产生的批次效应经limma程序包移除,并进行标准化处理。
1.2 C17orf91在全球肝细胞癌组织的表达分析及其潜在临床意义 利用移除批次后的全球肝细胞癌mRNA表达矩阵计算C17orf91在肝细胞癌组织及非癌肝组织中的表达总数、均值、标准差,计算C17orf91表达水平的标准化平均差(SMD)。通过绘制ROC曲线获取C17orf91表达鉴别肝细胞癌的最佳灵敏度及特异度,计算真阳性率、假阳性率、假阴性率和真阴性率,经Stata 12.0统计软件合并得到汇总ROC(summary ROC,sROC)及AUC。最后,利用 Kaplan-Meier Plotter评估C17orf91对肝细胞癌患者预后的潜在影响。
1.3 肝细胞癌mRNA及miRNA差异表达分析 分别利用移除批次后的全球肝细胞癌mRNA及miRNA表达矩阵计算表达值的SMD,鉴定差异表达mRNA(differentially expressed messenger RNA,DEmRNA)及差异表达miRNA(differentially expressed micro RNA,DEmiRNA)(|SMD|>0,P<0.05)。
1.4 C17orf91来源hsa-miR-22-3p及hsa-miR-22-5p靶基因预测 鉴于C17orf91作为hsa-miR-22-3p及hsa-miR-22-5p宿主基因,其功能依赖于miRNA对下游mRNA靶点的调控。本研究全面探讨hsa-miR-22-3p及hsa-miR-22-5p的靶基因,利用的11个数据库包括 miRecords、DIANA-microT-CDS、ElMMo、Micro-Cosm、miRanda、miRDB、miRTarBase、PicTar、PITA、TarBase和 TargetScan。hsa-miR-22-3p、hsa-miR-22-5p与靶基因的相互作用均经过研究验证(如荧光素酶报告基因实验、降解组测序、紫外交联免疫沉淀结合高通量测序等)。
1.5 肝细胞癌C17orf91-DEmiRNA-DEmRNA竞争性内源RNA机制 C17orf91还有可能通过其他miRNA发挥功能,本研究进一步查询了C17orf91相关的miRNA及经荧光素酶报告基因实验验证的mRNA靶基因。两者分别与DEmiRNA、DEmRNA交集,用于构建C17orf91-DEmiRNA-DEmRNA竞争性内源RNA调控网络。
1.6 17orf91相关靶基因功能注释 利用Metascape对hsa-miR-22-3p、hsa-miR-22-5p及C17orf91-DEmiRNA-DEmRNA靶基因的潜在分子生物学功能进行预测。
1.7 计算机辅助预测潜在抗肝细胞癌治疗药物 通过靶向肝细胞癌中的C17orf91调控分子通路,对FDA批准或临床试验研究抗癌药物进行重新利用,初步筛选可能具有较高敏感性的抗肝细胞癌药物及其潜在作用靶点。
2 结果
2.1 肝细胞癌组织及非癌肝组织C17orf91表达水平比较 本研究共纳入24个基因芯片及高通量测序合并数据集,其肝细胞癌组织及非癌肝组织对照样本分别达1 381、1 052例,见表1。肝细胞癌组织中C17orf91表达水平明显下调,其SMD低至-0.96(-1.25~-0.67)(图1a)。发表偏倚检测、敏感性分析结果提示未见明显发表偏倚、未发现明显的异质性来源,故整合分析结果可靠(图1b-c)。
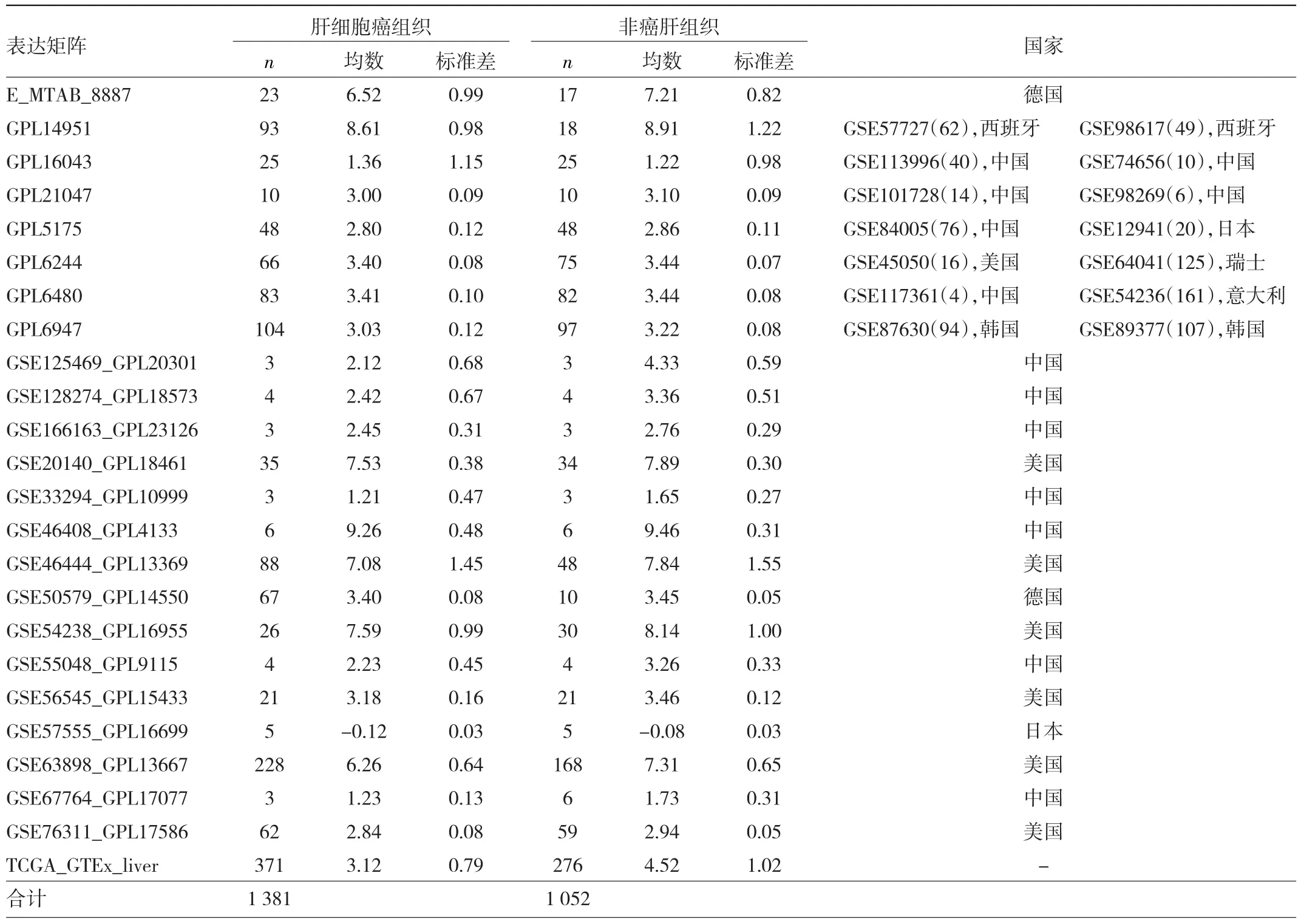
表1 全球肝细胞癌表达矩阵中的C17orf91表达水平
2.2 C17orf91表达水平对肝细胞癌患者预后的影响为评估C17orf91在肝细胞癌中的潜在临床价值,本研究首先利用C17orf91表达水平对肝细胞癌组织、非癌肝组织进行诊断试验,见表2。结果表明,C17orf91有能力甄别肝细胞癌组织及非癌肝组织,其sROC AUC为0.84(0.80~0.87),灵敏度及特异度分别为0.72(0.63,0.80)、0.82(0.72~0.89)(图1d),皆提示C17orf91对肝细胞癌具有中等区分能力。阳性似然比、阴性似然比森林图结果亦揭示了C17orf91用于区分肝细胞癌的准确性(图1e-f)。本研究进一步评估C17orf91的预后能力,发现C17orf91高表达可预示肝细胞癌患者较低的生存风险(图2a-b)。由此得知,低表达C17orf91预示肝细胞癌患者预后不良。
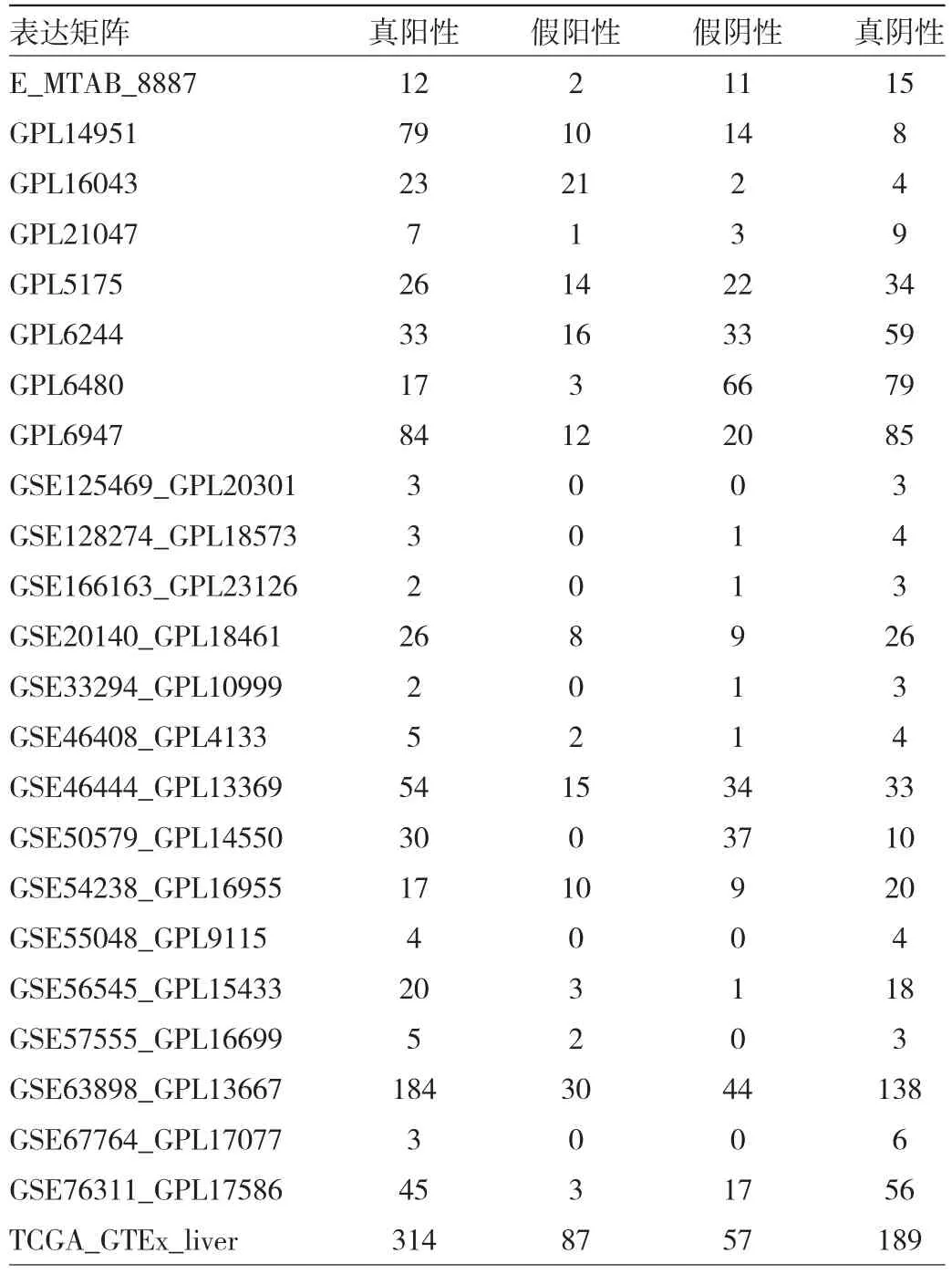
表2 C17orf91对肝细胞癌组织与非癌肝组织的区分能力(例)

图1 C17orf91在全球肝细胞癌组织中的表达下调及其对肝癌患者的潜在鉴别意义(a:与非癌肝组织相比,肝细胞癌组织中C17orf91呈低表达;b:未检测到明显发表偏倚;c:敏感性分析未鉴别出明显异质性来源;d:C17orf91对肝细胞癌组织与非癌肝组织有中等区分能力;e:阳性似然比森林图;f:阴性似然比森林图)
2.3 C17orf91的潜在分子功能 本研究共获取肝细胞癌hsa-miR-22-3p差异表达靶点1 395个、hsa-miR-22-5p差异表达靶点798个,其中分别包含hsa-miR-22-3p上调靶点1 018个、下调靶点377个以及hsamiR-22-5p上调靶点554个、下调靶点244个。hsamiR-22-3p和hsa-miR-22-5p下调靶基因在肝细胞癌差异表达调控网络中分别参与细胞迁移正性调控和血管发育(图2c)。
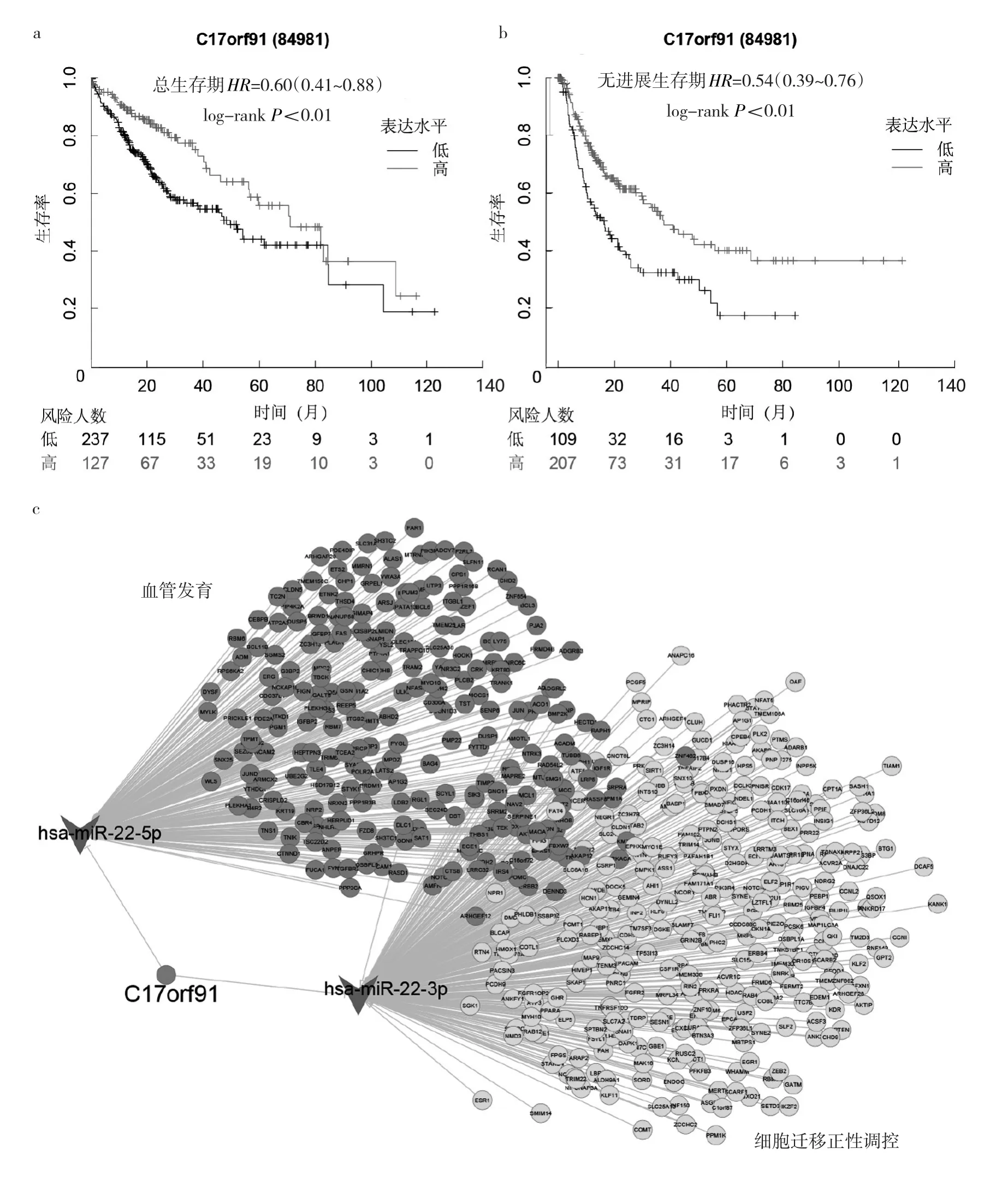
图2 C17orf91衍生miRNA在肝细胞癌进展中的潜在机制(a:C17orf91低表达预示肝细胞癌患者总体生存期高风险;b:C17orf91低表达预示肝细胞癌患者无进展生存期高风险;c:C17orf91系hsa-miR-22-3p及hsa-miR-22-5p宿主基因,其靶基因在肝细胞癌差异表达调控网络中分别参与细胞迁移正性调控和血管发育)
2.4 肝细胞癌C17orf91-DEmiRNA-DEmRNA调控机制 本研究首先反向预测调控C17orf91的69个miRNA,其中仅有16个显著高表达miRNA及2个显著低表达miRNA。利用这18个差异表达miRNA,预测得差异表达靶基因42个(下调15个、上调27个)。功能注释结果表明,上调靶基因主要参与癌症通路(图3a),而下调靶基因主要参与细胞迁移正性调控、细胞群增殖负性调控及PID CMYB信号通路(图3b)。图4展示了C17orf91-DEmiRNA-DEmRNA调控网络参与癌症通路及细胞迁移正性调控的相互作用关系。
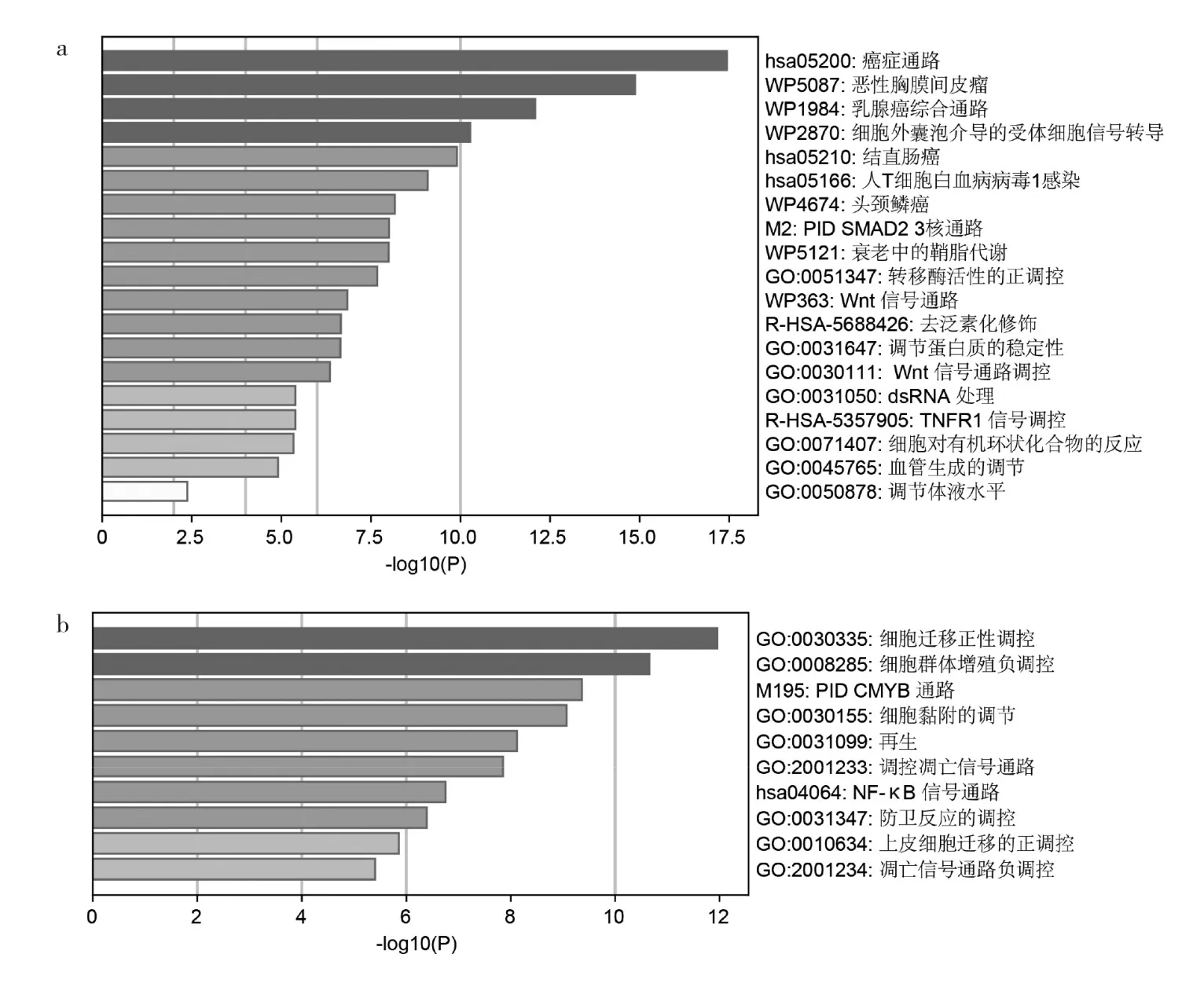
图3 C17orf91上游相关miRNA靶基因功能注释(a:C17orf91上游相关miRNA的上调靶基因主要参与癌症通路;b:C17orf91上游相关miRNA的下调靶基因主要参与细胞迁移正性调控)
2.5 潜在抗肝细胞癌药物及其治疗靶点预测 相关分析结果提示,C17orf91衍生hsa-miR-22-3p靶基因具有血小板反应蛋白1型基序1的ADAM金属肽酶(ADAM metallopeptidase with thrombospondin type 1 motif 1,ADAMTS1)表达水平与多种抗癌药物敏感性显著相关:ADAMTS1在肝细胞癌组织中显著低表达,且与雷帕霉素、Wnt/β-catenin通路抑制剂XAV-939、莫特塞尼、博来霉素抗癌药物的半抑制浓度(IC50)呈正相关,但与他莫昔芬、伏拉塞替等多种抗癌药物的IC50呈负相关(图5)。且ADAMTS1低表达提示雷帕霉素、莫特塞尼、博来霉素抗癌药物IC50水平较低(图6)。因此,ADAMTS1可能作为肝癌治疗靶点,且ADAMTS1低表达肝细胞癌患者对雷帕霉素、莫特塞尼、博来霉素抗癌药物敏感性可能较好。
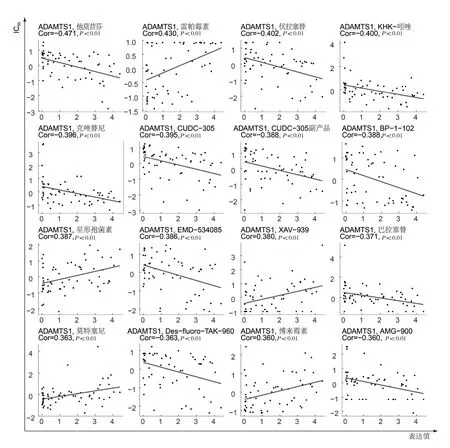
图5 靶向C17orf91-miRNA-mRNA调控网络筛选潜在抗肝细胞癌药物(C17orf91衍生的hsa-miR-22-3p在肝细胞癌中被下调,其调控靶标ADAMTS1亦在肝细胞癌中呈低表达,与雷帕霉素、XAV-939、莫特塞尼、博来霉素抗癌药物的IC50呈正相关,但与他莫昔芬、伏拉塞替等多种抗癌药物的IC50呈负相关)

图6 ADAMTS1通过靶向C17orf91-miRNA-mRNA调控网络作为肝细胞癌患者的潜在治疗靶标
3 讨论
长链非编码RNA C17orf91可抑制肝细胞癌的生长发育,然而C17orf91在肝细胞癌中的相关研究依旧十分有限。利用全球基因芯片、测序数据来研究C17orf91的表达意义,探索C17orf91衍生miRNA、C17orf91相关miRNA的靶向调控关系,有助于深入剖析C17orf91抗肝细胞癌的分子机制,并对肝细胞癌患者靶向治疗药物的开发有一定的指导意义。
本研究立足于全球1 381例肝细胞癌及1 052例非癌肝组织样本,从转录层面印证了C17orf91的低表达水平。本研究中,笔者采集了来自德国、韩国、美国、日本、瑞士、西班牙、意大利和中国这8个国家的总共32个单一的肝细胞癌基因芯片、基因高通量测序数据集,不仅证实了C17orf91在肝细胞癌组织中的低表达,还进一步阐明了C17orf91对肝细胞癌的中等区分能力。本研究纳入的肝癌样本量更大、面更广,对研究C17orf91表达的临床意义有极大的补充。
C17orf91作为miRNA宿主基因,与hsa-miR-22-3p和hsa-miR-22-5p有着密切联系。在肝癌细胞系中,C17orf91来源的hsa-miR-22-3p可显著抑制C17orf91敲除对肝癌细胞迁移、侵袭的促进作用[17]。此外,C17orf91衍生的hsa-miR-22-5p在肝细胞癌中低表达,且在经受放射治疗后hsa-miR-22-5p表达水平升高[18]。这些研究表明hsa-miR-22-3p与hsa-miR-22-5p在肝细胞癌中可能发挥抑癌效果,其中hsamiR-22-5p还可能与肝癌的放疗敏感性有关。本研究中,hsa-miR-22-3p和hsa-miR-22-5p的下调靶基因在肝细胞癌差异表达调控基因网络中分别参与细胞迁移和血管发育。无独有偶,hsa-miR-22-3p曾多次被报道可通过靶向组蛋白去乙酰化酶6(histone deacetylase 6,HDAC6)、PLAG1样锌指蛋白2(PLAG1 like zinc finger 2,PLAGL2)和OC1/血管内皮生长因子A(vascular endothelial growth factor A,VEGFA)分别抑制晶状体上皮、乳腺癌以及内皮祖细胞的迁移能力[19-21]。不仅如此,研究人员证实了hsa-miR-22-3p还可通过靶向下调Sp1转录因子[22]、靶向调控Snail1表达[23]、调控上皮-间质转化相关基因(E-钙黏蛋白、β-catenin、N-钙黏蛋白和波形蛋白)[24]等多种机制抑制肝细胞癌细胞系的迁移能力。因此,hsa-miR-22-3p在肝细胞癌中的抑癌作用也极有可能是通过其5'端非翻译区与靶基因的3'端非翻译区进行不完全互补配对,从而抑制其靶基因介导的促细胞迁移机制。虽然目前尚无研究阐明hsa-miR-22-5p与血管发育有直接关联,但不可否认的是,miR-22可促进促炎细胞因子的合成并通过靶向血管内皮-钙黏蛋白诱发血管生成[25]。综上所述,C17orf91对抗肝细胞癌的部分原因可能是hsa-miR-22-3p和hsa-miR-22-5p对下游靶基因的抑制作用。
本研究还进一步探索了hsa-miR-22-3p靶基因ADAMTS1作为肝癌治疗靶点的潜能。ADAMTS1作为ADAMTS蛋白家族的一员,它所编码的蛋白质含有2个去整合素环和3个C末端TS基序,并具有抗血管生成活性[26]。ADAMTS1可能是维持正常生长、生育能力以及器官形态和功能所必需,且其表达可能与各种炎症过程以及癌症恶病质的发展均有关。研究表明,ADAMTS1可抑制卵巢癌及纤维肉瘤细胞的增殖和迁移能力[27-28]。本研究中,笔者发现ADAMTS1在肝细胞癌中呈显著低表达,且其低表达可能还提示癌症细胞对雷帕霉素、莫特塞尼、博来霉素抗癌药物具有更高敏感性。综上,ADAMTS1有可能用于预测肝细胞癌对抗癌药物的敏感程度。
然而,本研究尚存些许不足。C17orf91来源的hsa-miR-22-5p参与抑制血管发育的机制还未得到佐证。因此,在未来的研究中,还需要开展更进一步的实验以证实本文提出的假说。
综上所述,C17orf91在肝细胞癌组织中被显著下调,且低表达C17orf91预示肝细胞癌患者预后不良。C17orf91来源的hsa-miR-22-3p和hsa-miR-22-5p可能参与抑制细胞迁移正性调控及血管发育。hsamiR-22-3p靶基因ADAMTS1可能作为肝细胞癌的治疗靶点。

